Tin tức
Khả Năng Kháng Kháng Sinh Của Vibrios Trong Nuôi Tôm
Tóm tắt
Độ nhạy cảm với kháng sinh của 100 chủng vi khuẩn Vibrio phân lập từ tôm thẻ chân trắng Litopenaeus vannamei đã được kiểm tra và xác định về mặt kiểu hình. Kết quả quan sát thấy chỉ số kháng kháng sinh cao (75%), với các đặc điểm kiểu hình như sau: kháng đơn (n = 42), kháng chéo với β-lactam (n = 20) và đa kháng (n = 13). Kháng plasmid đặc trưng cho penicilin (n = 11), penicilin + ampicilin (n = 1), penicilin + aztreonam (n = 1) và ampicilin (n = 1). Khả năng kháng kháng sinh của các chủng khác (n = 86) có thể do gen nhiễm sắc thể trung gian. Các phát hiện của nghiên cứu này hỗ trợ kết luận rằng tôm nuôi có thể mang vi khuẩn Vibrio kháng β-lactam và tetracycline.
1/ Giới thiệu
Các vi khuẩn thuộc chủng Vibrio thường xuất hiện trong nước biển, nước ngọt và cửa sông. Chúng là những tác nhân gây bệnh cho tôm. Các nghiên cứu đã chỉ ra rằng khả năng kháng kháng sinh của vi khuẩn Vibrio được phân lập từ môi trường nuôi tôm He không phải là hiếm, thực tế cho thấy nó là một vấn đề lớn đối với ngành nuôi trồng thủy sản. Ngoài ra, nó còn có nguy cơ ảnh hưởng đến môi trường, vì việc sử dụng các chất diệt khuẩn như một biện pháp phòng bệnh trong nuôi trồng thủy sản đã tạo điều kiện thuận lợi cho việc chọn lọc các vi khuẩn có khả năng kháng thuốc, tăng khả năng hoạt động của các gen kháng thuốc, gây bệnh cho người và động vật trên cạn.
Xem xét tầm quan trọng của việc nghiên cứu sự xuất hiện của vi khuẩn kháng kháng sinh ở động vật không xương sống ở biển dùng làm thức ăn cho con người, nghiên cứu này xác định độ nhạy cảm với thuốc kháng khuẩn của vi khuẩn Vibrio phân lập từ dịch tương của tôm thẻ chân trắng Litopenaeus vannamei.
2/ Nguyên liệu và phương pháp
Có tổng cộng 100 chủng Vibrio từ bộ sưu tập vi khuẩn của Phòng thí nghiệm Vi sinh tại Viện Khoa học Môi trường Fish-Sea (LABOMAR-UFC) được sử dụng trong thí nghiệm này. Chỉ những chủng đã được xác định kiểu hình mới được sử dụng trong nghiên cứu. 100 chủng được phân lập từ dịch tương của tôm thẻ chân trắng sử dụng các xét nghiệm sinh hóa bao gồm: arginine dihydrolase, lysine decarboxylase và ornithine decarboxylase, oxidase, indole, ortho-nitrophenyl-β-galactoside (ONPG), Voges-Proskauer, D-glucosamine cs, tăng trưởng ở mức 0%, 3%, 8% và 10% NaCl, với nhiệt độ 40°C và 4°C, citrate, gelatinase, urease, kháng đến O/129 và axit từ glucose, sucrose, arabinose, mannitol và melibiose. Các chủng có đặc điểm kiểu hình phù hợp với các loài V. navarrensis (n = 53), V. brasiliensis (n = 15), V. parahaemolyticus (n = 10), V. xuii (n = 8), V. coralliilyticus (n = 5), V. cholerae (n = 4), V. neptunius (n = 2), V. alginolyticus (n = 1), V. diazotrophicus (n = 1) và V. vulnificus B3 (n = 1).
Tất cả các chủng phân lập (n = 100) đều được xét nghiệm thông qua mô hình kiểm tra độ nhạy cảm với kháng sinh bằng phương pháp khuếch tán đĩa thạch. Nghiên cứu này sử dụng các loại thuốc kháng sinh được sử dụng cho con người và ngành công nghiệp tôm, bao gồm: nalidixic acid (Nal 30 μg), ampicillin (Amp 10 μg), aztreonam (Atm 30 μg), cephalothin (Cpl 30 μg), ceftriaxone (Cro 30 μg), ciprofloxacin (Cip 5 μg ), chloramphenicol (Clo 30 μg), streptomycin (Est 10 μg), gentamicin (Gen 10 μg), imipenem (Ipm 10 μg), nitrofurantoin (Nit 300 μg), penicillin (Pen 10 U) sulfazotrim (Sut 25 μg), và tetracycline (Tcy 30 μg). Đối với thử nghiệm kháng sinh đồ, mật độ vi khuẩn trước đó đã được điều chỉnh với nồng độ 108 UFC/mL, bằng cách huyền phù vi khuẩn trong dung dịch muối có độ đục 1% tương đương với thang đo tỷ trọng McFarland 0,5. Các chất huyền phù với mật độ tiêu chuẩn được cấy bằng “tăm bông” trong đĩa Petri có chứa môi trường thạch Mueller-Hinton (Difco) với 1% NaCl, và sau đó dùng đĩa kháng sinh (Labourclin). Các đĩa được ủ ở 35°C trong 24 giờ. Các vùng ức chế được đo (mm) bằng thước cặp kỹ thuật số (Digmess) và vì không có điểm ngắt nào được xác định cho Vibrio, nên chúng tôi sử dụng tiêu chuẩn diễn giải đường kính vùng ức chế cho các vi khuẩn thuộc họ Enterobacteriaceae (theo CLSI, 2010).
Để xác định cơ chế kháng kháng sinh, các chủng đã được chọn lọc và xử lý plasmid bằng cách sử dụng chất nhuộm Acridine Orange (Sigma A-6014). Tất cả các chủng kháng kháng sinh được nuôi trong môi trường Luria Bertani Broth, bổ sung 0,100 mg/mL Acridine Orange, ủ trong 24 giờ ở nhiệt độ 35°C. Sau đó, chất cấy được lấy ra và áp dụng phương pháp Pour-Plated trong TSA chứa 1% NaCl, tiếp tục ủ trong 24 giờ ở nhiệt độ 35°C. Từ sự tăng trưởng TSA, kháng sinh đồ được thực hiện như đã đề cập ở trên. Sự kháng kháng sinh liên quan đến nhiễm sắc thể nếu quan sát thấy hiện tượng kháng thuốc sau quy trình điều trị; ngược lại, nó sẽ được xem là do plasmid.
3/ Kết quả và thảo luận
Các chủng được sử dụng trong nghiên cứu này chỉ được nhận dạng sinh hóa. Vì nhiều loài thuộc chủng Vibrio có thể bị xác định sai, nên việc chỉ xác định kiểu hình thôi là chưa đủ. Tuy nhiên, việc xác định tất cả các chủng được sử dụng đã được xác nhận và công bố trước đó.
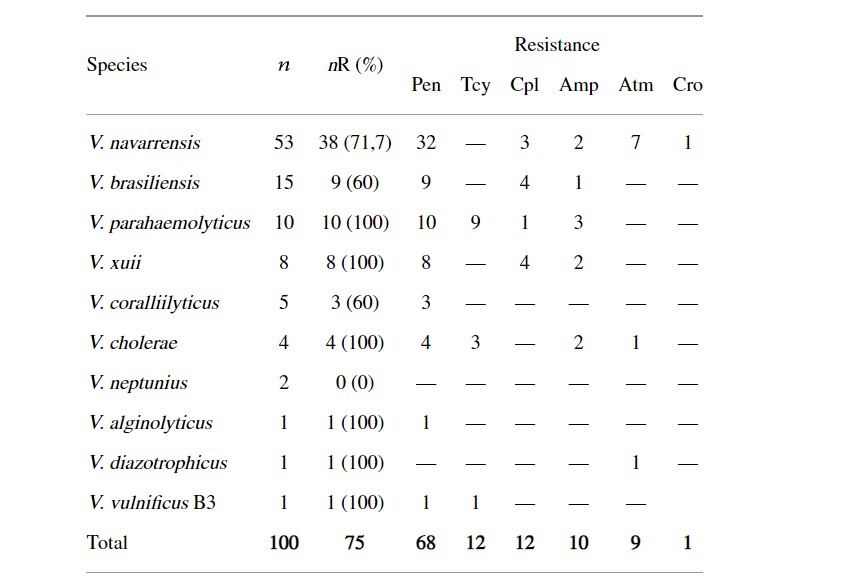
Khả năng kháng với ít nhất một loại kháng sinh đã được quan sát thấy ở 75 chủng (Bảng 1). Loài duy nhất nhạy cảm với tất cả các loại thuốc kháng sinh là V. neptunius. Ngược lại, khả năng kháng đã được xác minh và xác nhận ở tất cả các chủng V. parahaemolyticus, V. xuii, V. cholerae, V. alginolyticus, V. diazotrophicus và V. vulnificus B3. Các chủng V. navarrensis, V. brasiliensis và V. coralliilyticus cho thấy khả năng kháng kháng sinh cao, lần lượt là 71,7%, 60% và 60%.
Bảng 1: Khả năng kháng kháng sinh ở vi khuẩn Vibrio phân lập từ dịch tương của tôm thẻ chân trắng Litopenaeus vannamei.
Trong đó:
n: số lượng phân lập; nR: số chủng phân lập kháng; Pen: penicillin G; Tcy: tetracycline; Amp: ampicillin; Cpl: cephalothin; Atm: aztreonam; Cro: ceftriaxone.
Bảng 2 mô tả dữ liệu liên quan đến 9 đặc điểm kiểu hình của 75 loài Vibrio kháng kháng sinh. Thường gặp nhất là kháng với penicillin (n = 42), tiếp theo là kháng chéo với β-lactam (n = 20) và kháng đa (n = 13).
Bảng 2: Mô hình kháng kháng sinh ở vi khuẩn Vibrio được phân lập từ dịch tương của tôm thẻ chân trắng Litopenaeus vannamei.

Trong đó:
n: số lượng phân lập; Pen: penicillin G; Tcy: tetracycline; Amp: ampicillin; Cpl: cephalothin; Atm: aztreonam; Cro: ceftriaxone
Khả năng kháng kháng sinh của Vibrios đã được phát hiện ở nhiều loài tôm khác nhau. Biểu hiện của vấn đề này thường liên quan đến việc sử dụng không hiệu quả các loại thuốc diệt khuẩn trong nuôi trồng thủy sản.
Trong một nghiên cứu về mô hình kiểm tra độ nhạy cảm với kháng sinh của V. parahaemolyticus có nguồn gốc từ tôm, Bhattacharya và cộng sự (2000) cho biết rằng có sự xuất hiện của các chủng kháng ampicillin và nhạy cảm với axit nalidixic và nitrofurantoin. Những phát hiện này có thể được so sánh với các phát hiện của nghiên cứu hiện tại, vì 3 chủng V. parahaemolyticus đã kháng với ampicillin và tất cả đều nhạy cảm với các kháng sinh khác trong thử nghiệm (Bảng 1). Ngoài ra, biểu hiện của sự kháng ampicillin và tetracycline do Vibrio từ các khu vực nuôi tôm cũng đã được báo cáo.
Gần đây, theo Laganà và cộng sự (2011), vi khuẩn (Vibrio spp. và Photobacterium damsela spp. piscicida) được phân lập từ các khu vực nuôi trồng thủy sản ở Ý (cá, động vật có vỏ và giáp xác) kháng lại β-lactam (ampicillin, carbenicillin, mezlocillin, piperacillin, cephalothin, cefazolin, cefuroxime, cefoxitin, ceftazidime và aztreonam), quinolones (cinoxacin, axit nalidixic, axit oxolinic và axit pipemidic), sulfonamide (sulfamethoxazole + trimethoprim), polymyxin (colistin sulphat), fosfomycin, tetracycline và chất ức chế tổng hợp RNA (rifampicin). Kết quả của chúng tôi cũng cho thấy mức độ kháng với kháng sinh beta-lactam, bao gồm cả kháng chéo (Pen + Cpl, Pen + Atm, Pen + Amp, Cro + Atm và Pen + Cpl + Amp) (Bảng 2).
Ở Brazil, vi khuẩn Vibrio kháng với thuốc kháng sinh đã được phát hiện trên tôm và các khu vực canh tác. Costa và cộng sự (2008) đã phát hiện ra các chủng Vibrio kháng ampicillin, sulfazotrim và ceftriaxone trong các mẫu tôm thẻ Litopenaeus vannamei. Họ cho rằng tôm He và môi trường nuôi của nó có thể là nguồn vi khuẩn kháng thuốc chính. Nghiên cứu hiện tại đã xác minh được các chủng có khả năng kháng chéo với ceftriaxone và aztreonam; tuy nhiên, không có hiện tượng kháng sulfazotrim. Melo và cộng sự (2011) đã báo cáo tỷ lệ kháng kháng sinh đối với ampicillin và amikacin ở các chủng V. parahaemolyticus phân lập từ tôm thẻ L. vannamei nuôi trong ao lần lượt là 90% và 60%. Helena Rebouças và cộng sự (2011) đã quan sát thấy một tỷ lệ kháng tương đối cao ở Vibrio được phân lập từ môi trường nuôi tôm biển, trong đó kháng với ampicillin (45,2%) và tetracycline (38,7%).
Khả năng kháng penicillin G tương đối cao được nhấn mạnh trong nghiên cứu (Bảng 1 và 2) với 68%. Sự xuất hiện của vi khuẩn Vibrio kháng penicillin đã được báo cáo ở các khu vực nuôi tôm He khác nhau. Srinivasan và Ramasamy (2009) đã phát hiện khả năng kháng penicillin G lên đến 100% ở các loài Vibrio có liên quan đến các vấn đề dịch bệnh ở tôm do virus ở Ấn Độ gây ra. Ngoài ra, các vấn đề về môi trường, kinh tế và quản lý có thể liên quan đến sự xuất hiện của vi khuẩn kháng kháng sinh trong nuôi trồng thủy sản.
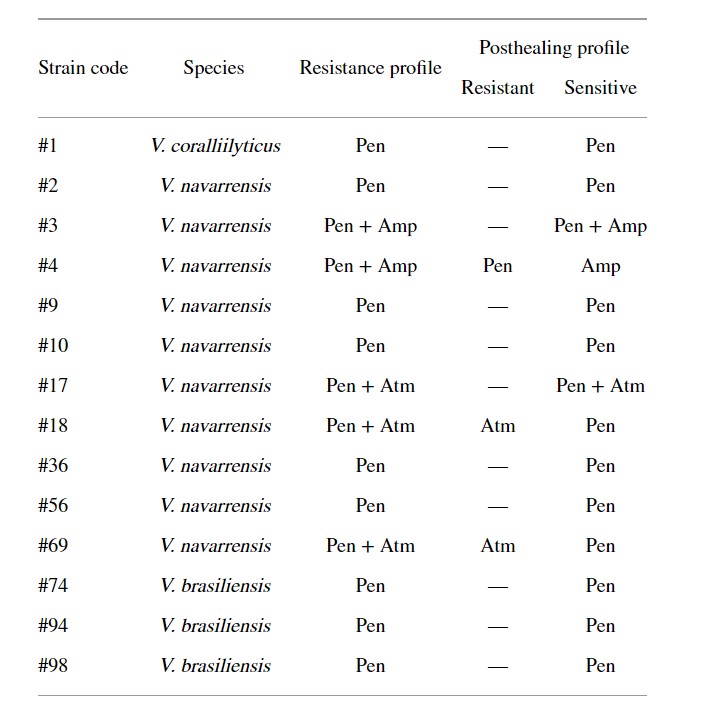
Khả năng kháng nhờ vào plasmid đặc trưng ở Pen (n = 11), Pen + Amp (n = 1), Pen + Atm (n = 1) và Amp (n = 1) (Bảng 3). Khả năng kháng kháng sinh của các chủng khác (n = 86) có thể do gen nhiễm sắc thể trung gian.
Bảng 3: Plasmid trung gian kháng kháng sinh ở vi khuẩn Vibrio được phân lập từ dịch tương của tôm thẻ chân trắng Litopenaeus vannamei.
Trong đó:
Pen: penicillin; Amp: ampicillin; Atm: aztreonam.
Nghiên cứu hiện tại thực hiện việc xác định kiểu hình của plasmid. Từ những năm 1960, chất nhuộm Acridine đã được sử dụng, nhưng nó thường làm mất toàn bộ plasmid. Năm 1970, Dastidar và cộng sự đã chứng minh hiệu quả của chất nhuộm Acridine Orange trong việc loại bỏ plasmid R ở các chủng vi khuẩn đa kháng Vibrio cholerae. Chất nhuộm Acridine Orange có thể loại bỏ plasmid khỏi tế bào nhân sơ; và mặc dù các phương pháp thông thường để xử lý plasmid bằng chất rắn có thể gây ra đột biến trong DNA nhiễm sắc thể của vật chủ, nhưng việc sử dụng nó để phát hiện plasmid vẫn đang được báo cáo trong các thử nghiệm lâm sàng đối với các chủng và động vật / môi trường phận lập.
Trong 13 chủng, khả năng kháng penicillin G được xác định do plasmid (Bảng 3). Đối với vi khuẩn thuộc chủng Vibrio, sự tồn tại của plasmid đã mã hóa khả năng kháng penicilin. Reid và Amyes (1986) cho biết plasmid SAR-1 có khả năng thủy phân các kháng sinh carbenicillin và penicilin G. Theo các tác giả, đây là loại phổ biến nhất. Cơ chế kháng với các kháng sinh nhóm β-lactam là sản sinh ra các enzym β-lactamase, enzym này có thể thủy phân và làm bất hoạt nó.
Chúng tôi đã phát hiện 2 chủng có khả năng kháng ampicillin của plasmid (Bảng 3). Teo và cộng sự (2000) đã nhận thấy khả năng kháng ampicillin ở Vibrio và nó có thể xảy ra thông qua trung gian bởi các gen β-lactamase blaVHW-1 và blaVHH-1 có kích thước xấp xỉ 60 kb hiện diện trong plasmid.
Trong một nghiên cứu về mô hình plasmid và khả năng kháng kháng sinh ở các chủng Vibrio phân lập từ tôm He, Molina-Aja và cộng sự (2010) đã phát hiện tỷ lệ các chủng phân lập kháng với cephalothin cao hơn so với nghiên cứu hiện tại, với 36,1% số chủng mang kháng với β-lactam. Các tác giả tương tự cho rằng plasmid với 21,226 pb có khả năng mã hóa khả năng kháng cephalothin, do đó đặc trưng cho tính kháng đó là plasmid. Kết quả này không được so sánh với kết quả ở nghiên cứu hiện tại, vì khả năng kháng cephalothin được quan sát ở 12 chủng có thể có bản chất của nhiễm sắc thể.
4/ Kết luận
Các kết quả của nghiên cứu này bổ sung cho kết luận rằng tôm nuôi có thể mang vi khuẩn Vibrio kháng β-lactam và tetracycline. Do đó, sự xuất hiện của các vi khuẩn kháng kháng sinh là dấu hiệu cho thấy việc sử dụng bừa bãi các loại thuốc kháng sinh trong nuôi trồng thủy sản. Hơn nữa, việc phát hiện khả năng kháng kháng sinh qua trung gian của các yếu tố di truyền di động, plasmid, đóng vai trò cảnh báo về khả năng chuyển gen kháng kháng sinh giữa các vi khuẩn.
Theo: Renata Albuquerque Costa, Rayza Lima Araújo, Oscarina Viana Souza, and Regine Helena Silva dos Fernandes Vieira
Nguồn: https://www.hindawi.com/journals/bmri/2015/505914/
Biên dịch: Huyền Thoại – Công ty TNHH PTTS Bình Minh
Xem thêm:
- Nghiên Cứu Lại Giá Trị Của Các Trang Trại Nuôi Tôm Ở Bangladesh
- Đánh Giá Chất Thuỷ Phân Như Một Thành Phần Chức Năng Trong Thức Ăn Của Tôm Thẻ Chân Trắng Thái Bình Dương
- BỆNH PHÁT SÁNG TRÊN TÔM NUÔI

 English
English