Kỹ Thuật Nuôi, Tin tức
Tăng trưởng giảm trên tôm sú nhiễm IHHNV
Nuôi thương phẩm mô phỏng củng cố giá trị cho việc lựa chọn tôm bố mẹ ít/không nhiễm IHHNV dựa trên sàng lọc, sử dụng đàn giống SPF và lựa chọn kháng/chịu IHHNV

Vì IHHNV có thể làm giảm đáng kể năng suất ao nuôi của tôm sú (Penaeus monodon) và nhiễm trùng cấp tính kéo dài có thể gây biến dạng vỏ nghiêm trọng, nên điều quan trọng là phải sàng lọc từng đàn tôm bố mẹ và/hoặc các bể nuôi tôm post có kích thước phù hợp để đảm bảo rằng chỉ nuôi giống không có IHHNV hoặc giống có IHHNV thấp.
Virus gây hoại tử cơ quan tạo máu và cơ quan biểu mô (IHHNV) lần đầu tiên được xác định ở Châu Mỹ vào năm 1983, là nguyên nhân gây ra cái chết hàng loạt khi nuôi tôm càng xanh (Litopenaeus stylirostris). Ngay sau đó, nó cũng được xác định là nguyên nhân gây dị dạng và tăng trưởng còi cọc – được gọi là “hội chứng dị dạng còi cọc” ở tôm thẻ chân trắng (Litopenaeus vannamei).
Ở Úc và các khu vực khác ở Ấn Độ Dương-Thái Bình Dương, IHHNV thường được phát hiện ở tôm sú tự nhiên và nuôi với tần suất cao (Penaeus monodon). Mặc dù nhiễm IHHNV được coi là tương đối lành tính và ít ảnh hưởng đến hoạt động nuôi trồng thủy sản của loài này, nhưng nhiễm trùng cấp tính được cho là nguyên nhân gây ra dị dạng vỏ nghiêm trọng trên một đàn tôm sú gia hóa thế hệ 3 được nuôi ở Indonesia vào đầu những năm 1990.
Việc phát hiện IHHNV dựa trên thử nghiệm PCR rất phức tạp do sự biến đổi trình tự bộ gen giữa các chủng thuộc ba chủng đã biết (I, II và III) và bởi các dạng bộ gen IHHNV không lây nhiễm đã được tích hợp trong DNA nhiễm sắc thể của một số P. monodon trong các quần thể phân tán rộng khắp phạm vi phân bố tự nhiên.
Để tránh phát hiện chéo các dạng bộ gen IHHNV đã tích hợp, các thử nghiệm PCR thông thường và PCR thời gian thực đã được thiết kế để loại trừ sự khuếch đại hoặc phát hiện cụ thể yếu tố vi rút nội sinh IHHNV tích hợp khi loại trừ các dòng lây nhiễm IHHNV. Các thử nghiệm qPCR định lượng thời gian thực đối với IHHNV cũng cung cấp phương tiện định lượng chính xác lượng DNA của IHHNV như một phép đo tải lượng lây nhiễm tương đối.
Bài viết này tóm tắt kết quả của một nghiên cứu (https://doi.org/10.1016/j.aquaculture.2018.09.032) là một thử nghiệm nuôi thương phẩm trên hai dòng sú thuần P.monodon khác nhau về sự hiện diện và mức tải lượng IHHNV. Sự khác nhau này là do mức độ nhiễm IHHNV của tôm mẹ khác nhau. Tôm được nuôi theo điều kiện mô phỏng trong 4 ao nghiên cứu rộng 0,16 ha. Thử nghiệm qPCR thời gian thực được sử dụng để theo dõi tải lượng và tỷ lệ nhiễm IHHNV giữa các nhóm 48 con tôm được lấy mẫu định kỳ trong suốt quá trình nuôi thương phẩm từ mỗi ao trong 4 ao. Những dữ liệu này đã xác định mối liên hệ rõ ràng giữa việc bắt đầu nhiễm IHHNV ở mức độ cao sớm và giảm đáng kể tốc độ tăng trưởng, tỷ lệ sống và năng suất thu hoạch.
Thiết lập thử nghiệm nuôi thương phẩm
Tôm sú bố mẹ Penaeus monodon được đánh bắt ở vùng nước ven biển gần Bãi biển Bramston ở Bắc Queensland đã được vận chuyển bằng đường hàng không đến Trung tâm Nghiên cứu Đảo Bribie trong vòng 48 giờ sau khi đánh bắt. Sau khi nhận, mỗi con tôm được phân loại giới tính, cân, đánh dấu mắt và bảo quản một mảnh mô chân bơi để phân tích PCR. Mỗi bể trưởng thành tròn 2 x 10.000 lít được thả 32 tôm cái và 32 tôm đực. Các bể được đặt trong phòng tối, có nắp đậy để giảm ánh sáng, sử dụng lớp cát 3 mm và được cung cấp nước biển có nâng nhiệt và sục khí đủ để duy trì mức oxy hòa tan tối ưu. Tôm bố mẹ được cho ăn nhiều loại thức ăn tự nhiên điển hình trong các trại sản xuất giống thương mại tại địa phương để thúc đẩy khả năng sinh sản. Một mô chân bơi bổ sung đã được lấy mẫu từ mỗi con cái vào thời điểm nó bị cắt bỏ cuống mắt và sinh sản.
Trứng sinh ra từ con cái được nuôi trong bể đến giai đoạn hậu ấu trùng 20 (PL20) bằng cách sử dụng quy trình sản xuất giống tiêu chuẩn. Các ao PL20 có nguồn gốc từ một nhóm 3 con cái hoặc một nhóm 4 con cái, mỗi nhóm được thả vào hai ao nuôi thương phẩm lặp lại có lót ni lông và lưới che chim (sâu 40m x40m x2m; 0,16 ha) và ương nuôi sử dụng các phương pháp thương mại tiêu chuẩn của địa phương. Các nhóm gồm 144 con tôm từ mỗi ao trong số 4 ao được lấy mẫu định kỳ trong suốt quá trình nuôi thương phẩm để ghi lại trọng lượng và giới tính cũng như để bảo quản mô chân bơi và/ hoặc mô cơ quan tạo máu (LO) cho phân tích PCR tiếp theo. Tôm được thu hoạch bằng lưới và cuối cùng là tháo cạn nước ao trong khoảng thời gian từ 150 đến 170 ngày nuôi (DOC) để xác định sản lượng cuối cùng của ao và tỷ lệ sống của tôm.

Ảnh 1. Quan sát ấu trùng tôm được sản xuất cho nghiên cứu ngoài ao.
Năng suất ao và sự khác biệt về tỷ lệ sống
Trọng lượng của 144 con tôm sú được thu thập ngẫu nhiên từ mỗi ao trong số 4 ao nghiên cứu có diện tích 0,16 ha được theo dõi đều đặn trong suốt quá trình nuôi thương phẩm. Từ 120 ngày nuôi (DOC) trở đi, trọng lượng tôm từ nhóm tôm thuần được thả vào 2 trong số 4 ao (tức là ao 1 và 4; Hình 1) thấp hơn đáng kể. Hình thức chung của tôm thu từ hai ao này từ thời điểm này trở đi cũng giảm rõ rệt so với tôm thu từ ao 2 và 3.
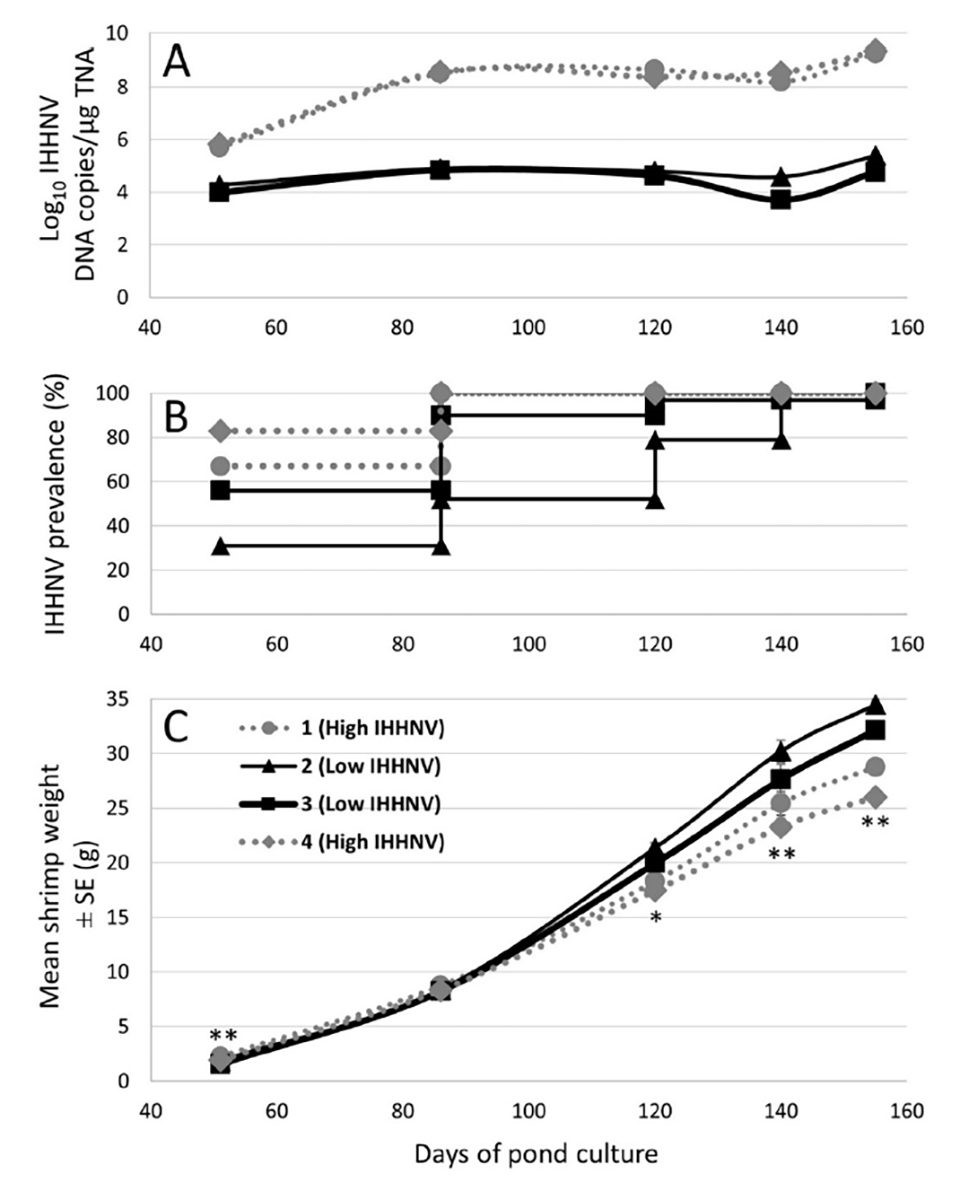
Hình 1. (A) Log10 bản sao DNA IHHNV trung bình/μg TNA được xác định bằng qPCR thời gian thực sử dụng mô pleopod của 48 trong số 144 con tôm được lấy mẫu từ mỗi trong số 4 ao tại mỗi thời điểm, ngoại trừ ở 140 DOC khi cơ quan bạch huyết mô từ 30 con tôm đã được thử nghiệm. (B) Mức độ phổ biến (%) mà tại đó IHHNV được phát hiện bằng qPCR thời gian thực ở 48 con tôm được kiểm tra từ mỗi ao tại mỗi thời điểm, ngoại trừ ở mức 140 DOC khi mức độ phổ biến chỉ được đánh giá cho 30 con tôm. (C) Trọng lượng tôm trung bình ± SE (gam) của 144 con tôm/ao được lấy mẫu tăng dần trong suốt quá trình nuôi thương phẩm ngoại trừ ở 140 DOC khi chỉ có 30 con tôm/ao được cân. Các mức ý nghĩa thống kê (* P < 0,05; ** P < 0,001) được xác định bằng cách sử dụng trọng lượng trung bình được biến đổi logarit của tôm từ các ao 1 và 4 có mức độ IHHNV cao kết hợp với nhau và các ao có mức độ IHHNV thấp 2 và 3 được kết hợp tại mỗi thời điểm lấy mẫu điểm.
Tôm được thu hoạch dần dần trong khoảng 2 tuần từ sau ngày nuôi (DOC) thứ 155. Để định lượng sự khác biệt ở quy mô thương mại, năng suất thu hoạch cuối cùng đạt được trong mỗi ao nghiên cứu 0,16 ha được xác định và ngoại suy (x 6,25) cho ao thương mại 1 ha điển hình. Sử dụng những dữ liệu này, sản lượng từ ao 2 và 3 (tương ứng là 12,3 và 14,2 tấn) cao hơn từ 22% đến 58% so với sản lượng từ ao 1 và 4 (tương ứng là 9,0 và 10,1 tấn) (Bảng 1). Dựa trên trọng lượng trung bình được xác định cho tôm thu hoạch, tỷ lệ sống ước tính ở ao 2 và 3 (tương ứng là 95,9% và 99,8%) cũng cao hơn từ 13% đến 25% so với ao 1 và 4 (tương ứng là 79,9% và 84,5%). Nhờ tốc độ tăng trưởng và tỷ lệ sống cao hơn của nhóm tôm nuôi trong ao 2 và 3.
Bảng 1. Các số liệu về sản xuất tôm sú trong ao trong quá trình nghiên cứu
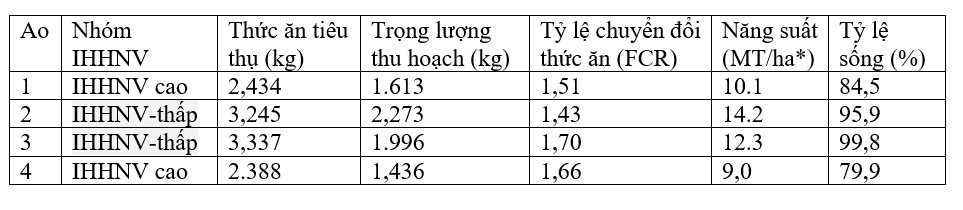
* ngoại suy từ ao 0,16 ha (tức là tổng trọng lượng/0,16)
Sử dụng các con số ngoại suy, ao 2 và 3 sản xuất tổng cộng 7,44 tấn (av =3,72 tấn/ha) tôm so với ao 1 và 4. Vì những con tôm này có trọng lượng thu hoạch trung bình nên đạt 35 đến 38 con/kg với giá bán nấu chín thông thường giá trị ở Úc khoảng 18 đô la Úc/kg, năng suất bổ sung 3,72 tấn/ha này sẽ cải thiện tổng giá trị của vụ nuôi (không tính đến chi phí thức ăn bổ sung, chế biến và phụ trợ) khoảng 67.000 đô la Úc trên 1 ha ao.
Chênh lệch tải lượng nhiễm IHHNV
Thử nghiệm qPCR thời gian thực của TaqMan đã xác định không có vi rút liên quan đến mang (GAV; kiểu gen vi rút đầu vàng 2 (YHV2)) hoặc vi rút đầu vàng kiểu gen 7 (YHV7) trong tôm bố mẹ và các đàn con được nuôi trong 4 ao. Do đó, thử nghiệm tương tự đã được thực hiện để xác định xem nhiễm IHHNV có thể là nguyên nhân làm giảm năng suất tăng trưởng của nhóm tôm nuôi trong ao 1 và 4 hay không.
Lượng TNA chuẩn hóa đã được xét nghiệm bằng TaqMan qPCR định lượng thời gian thực để so sánh trực tiếp tải lượng DNA của IHHNV (như một thước đo thực tế về tải trọng/mức độ nghiêm trọng của nhiễm trùng) giữa các mẫu. Dữ liệu qPCR về mô pleopod được lấy mẫu tại thời điểm tôm bố mẹ được nhận từ Bắc Queensland đã xác định tải lượng IHHNV cực thấp ở năm con và tải trọng cao hơn đáng kể ở một con cái từ mỗi nhóm đóng góp con cháu được thả vào ao 1 và 4 hoặc ao 2 và 3. Tải trọng cao nhất (6,71 x 105 mẫu DNA của IHHNV/µg TNA) được phát hiện ở 1 trong 3 cá thể cái đã sinh tôm con vào ao 1 và 4.
Tải lượng IHHNV nhìn chung tăng lên trong khoảng 6 tuần khi tôm bố mẹ đã trưởng thành, cuống mắt bị cắt bỏ và sinh sản. Tuy nhiên, tải trọng tăng lên mức cao nhất ở 3 con cái đóng góp ao 1 và 4 con, với con cái cao nhất cao hơn 100 lần so với mức cao nhất trong số bốn con cái đóng góp ao 2 và 3 con. Thử nghiệm các bể trứng đã xác định tải lượng IHHNV cao nhất và cao hơn >100 lần so với trứng của bất kỳ con cái nào khác, trong bể được thu thập từ con cái được xác định là có tải lượng IHHNV cao nhất khi được lấy mẫu cả khi đến và vào thời điểm nó sinh sản.
Thử nghiệm qPCR thời gian thực cũng được sử dụng để phát hiện và định lượng tải lượng IHHNV trong pleopods từ 48 trong số 142 đến 144 con tôm riêng lẻ được thu thập và cân từ mỗi trong số bốn ao ở 51, 86, 120 và 155 DOC cũng như từ 30 con tôm được lấy mẫu từ mỗi ao ở 140 DOC (Hình 1). Trong số tôm được thử nghiệm vào thời điểm này từ ao 1 và 4, IHHNV được phát hiện với tỷ lệ nhiễm 100% từ 86 DOC trở đi. Ngược lại, trong số tôm được thử nghiệm từ ao 2 và ao 3 cùng thời điểm, tỷ lệ nhiễm IHHNV thấp hơn ở thời điểm nuôi sớm hơn và chỉ đạt 100% ở thời điểm lấy mẫu rất muộn (140-155 DOC) trong quá trình nuôi thương phẩm. Tải lượng IHHNV trung bình ở ao 1 và 4 cao hơn 100 lần so với ao 2 và 3 tại thời điểm lấy mẫu ban đầu (51 DOC) và cao hơn 1000 lần ở bốn thời điểm lấy mẫu sau đó (Hình 1).
Kết luận và ứng dụng
Nhiễm IHHNV thường được chứng minh là tương đối lành tính trong nuôi trồng thủy sản tôm sú (Penaeus monodon). Bất chấp giả định chung này, các kết quả được báo cáo ở đây cho thấy việc nhiễm IHHNV ở loài này cần được xem xét nghiêm túc hơn so với suy nghĩ trước đây. Trong những trường hợp mà tôm nhiễm trùng mức độ rất cao và kéo dài, IHHNV được phát hiện là có khả năng gây ảnh hưởng nghiêm trọng đến sự tăng trưởng, sức khỏe chung, tỷ lệ sống và năng suất thu hoạch của ao. Với số lượng thiệt hại về sản lượng ước tính trị giá tổng cộng 67.000 đô la Úc cho một ao thương mại rộng 1 ha, các biện pháp ngăn chặn sự lây nhiễm như vậy phát sinh rất đáng được xem xét.
Liên quan đến những biện pháp can thiệp nào có thể mang lại phương tiện hiệu quả nhất để hạn chế xảy ra bùng phát dịch bệnh, người ta nhận thấy rằng 1 trong 7 con tôm cái được sử dụng (những con có số lượng IHHNV cao nhất từ trước khi bị bắt từ tự nhiên) cũng có tải lượng cao nhất ở những lần nó bị cắt mắt và sinh sản.
Hơn nữa, trứng sinh ra từ con cái này có IHHNV ở mức tải (2,3 x 105 bào tử IHHNV DNA/µg TNA) cao hơn rất nhiều so với bất kỳ cá thể cái nào trong số sáu cá thể cái còn lại (30 đến 1030 bào tử IHHNV DNA/µg TNA), bất kể thực tế là số lượng IHHNV cũng tăng vừa phải đến ồ ạt ở những cá thể cái này trong khoảng sáu tuần khi chúng được nhận và sinh sản. Vì vậy, trong trường hợp khi IHHNV rất phổ biến ở tôm bố mẹ hoang dã được bắt để sử dụng trong các trại sản xuất giống và có khả năng định lượng mức độ nghiêm trọng của nhiễm trùng bằng qPCR, thì thử nghiệm như vậy nên được sử dụng như một phương tiện để xác định và loại bỏ những con cái có tải trọng cao như vậy trước khi chúng được đưa vào điều kiện nuôi nhốt và đẻ trứng. Việc sàng lọc qPCR đối với các bể trứng để xác định và loại bỏ bất kỳ con nào có lượng IHHNV cao cũng nên được xem xét trong những trường hợp như vậy để đảm bảo rằng chỉ những con giống không có IHHNV hoặc ít IHHNV mới được nuôi.
Cơ hội tồn tại cho các chiến lược can thiệp RNA (RNAi) để giảm tải các ca nhiễm vi-rút có sẵn và do đó, xu hướng lây nhiễm được truyền theo chiều dọc cho thế hệ con cái. Tuy nhiên, công nghệ này vẫn chưa đủ trưởng thành đến mức cung cấp một giải pháp ngắn hạn, ngoại trừ khả năng hỗ trợ loại bỏ các bệnh lây nhiễm tải trọng thấp từ các dòng giống P. monodon thuần hóa. Các dòng nhân giống P. monodon sạch bệnh (SPF) cụ thể như vậy sẽ cung cấp giải pháp, với các dòng cũng được lựa chọn để tăng cường khả năng kháng/chống chịu IHHNV mang lại một giải pháp lý tưởng hơn.
Tuy nhiên, ở các quốc gia như Úc, nơi các quy định kiểm dịch nghiêm cấm nhập khẩu tôm sống cho mục đích nuôi trồng thủy sản, những nỗ lực tạo ra và duy trì các dòng giống như vậy đã không thể phá vỡ chu kỳ phụ thuộc vào tôm bố mẹ đánh bắt tự nhiên. Mặc dù có một số tiến bộ, cho đến khi các dòng tôm SPF có thể được thiết lập hoặc được duy trì, việc lựa chọn dựa trên sàng lọc sẽ vẫn là phương tiện duy nhất để ngăn ngừa IHHNV gây ra tác động sản xuất đối với tôm sú nuôi ở Úc và các nơi khác có cùng tình trạng khó khăn.
Theo Melony J. Sellars, Ph.D. Jeff A. Cowley, Dean Musson, Min Rao, M.L. Menzies, Greg J. Coman, Brian S. Murphy
Nguồn: https://www.globalseafood.org/advocate/reduced-growth-performance-black-tiger-shrimp-infected-ihhnv/
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
NaturalShrimp Dự Kiến Doanh Thu Đạt Đến 500.000 USD Trong Quý Tới

 English
English