Kỹ Thuật Nuôi, Tin tức
Việc Sử Dụng Kết Hợp Pediococcus Pentosaceus Và Fructooligosaccharide Cải Thiện Hiệu Suất Tăng Trưởng, Đáp Ứng Miễn Dịch Và Sức Đề Kháng Của Tôm Thẻ Chân Trắng Litopenaeus vannamei Chống Lại Vibrio parahaemolyticus
Tóm tắt
Nghiên cứu này đã đánh giá tác động của vi khuẩn probiotic Pediococcus pentosaceus được bổ sung ở các mức bổ sung khác nhau trong khẩu phần đối chứng [khẩu phần cơ bản chứa 0,5% fructooligosacarit (FOS)] đối với hiệu suất tăng trưởng, hệ số chuyển hóa thức ăn, phản ứng miễn dịch và khả năng kháng bệnh của tôm con Litopenaeus vannamei chống lại Vibrio parahaemolyticus. Khẩu phần ăn đối chứng với 0,5% FOS nhưng không bổ sung P. pentosaceus (Đối chứng) đã được chuẩn bị. Ngoài ra, 3 khẩu phần ăn thử nghiệm khác cũng được xây dựng: khẩu phần ăn đối chứng bổ sung P. pentosaceus ở (i) 1 × 106 cfu/ g khẩu phần (P1), (ii) 1 × 107 cfu/ g khẩu phần (P2), hoặc (iii) 1 × 108 cfu/ g khẩu phần (P3). Sau 60 ngày thử nghiệm cho ăn, tôm thử nghiệm đã được cảm nhiễm với V. parahaemolyticus. Kết quả cho thấy việc bổ sung P. pentosaceus vào khẩu phần ăn đã cải thiện đáng kể năng suất tăng trưởng và phản ứng miễn dịch của tôm thẻ chân trắng L. vannamei chưa trưởng thành (giai đoạn juvenile). Những con non được nuôi bằng khẩu phần ăn P2 hoặc P3 đã ghi nhận mức tăng tối đa về trọng lượng cơ thể cuối cùng, chiều dài cuối cùng, mức tăng trọng và tỷ lệ sống sót. Tổng số lượng tế bào máu, hoạt tính phenoloxidase và lysozyme của tôm được cho ăn bằng một trong 2 khẩu phần ăn này đã được tăng cường đáng kể. Kết quả cũng cho thấy rằng những con non được nuôi bằng khẩu phần ăn P2 hoặc P3 có tỷ lệ chết thấp hơn đáng kể khi cảm nhiễm với V. parahaemolyticus. Kết quả tổng thể cho thấy rằng sự kết hợp của P. pentosaceus ở mức bổ sung của khẩu phần ăn 1 × 107 cfu/ g (P2) và 0,5% FOS có thể được coi là một công thức tổng hợp tiềm năng để cải thiện sự tăng trưởng, sức khỏe và độ chắc khỏe của L.vannamei.
1. Giới thiệu
Ngành nuôi trồng thủy sản chiếm 46% tổng sản lượng và sản lượng cá chiếm 52% sản lượng tiêu thụ (FAO, 2020). Đóng một vai trò quan trọng trong việc cung cấp protein động vật chất lượng cao cho dân số ngày càng tăng và tạo việc làm trên toàn thế giới, bao gồm cả ở Việt Nam và nhiều nước Đông Nam Á. Tôm thẻ chân trắng Litopenaeus vannamei là một trong những loài tôm He được nuôi phổ biến nhất ở các nước châu Á, đạt sản lượng 5,4 triệu tấn vào năm 2019 (FAO, 2021). Dịch bệnh bùng phát do mầm bệnh vi rút và vi khuẩn là trở ngại chính cho việc sản xuất bền vững loài này ở cả Châu Á và các nơi khác trên thế giới. Đặc biệt, bùng phát dịch bệnh hoại tử gan tụy cấp (AHPND) trên tôm biển nuôi do các chủng vi khuẩn độc lực Vibrio parahaemolyticus và các loài liên quan gây chết hàng loạt tôm thẻ chân trắng và tôm sú (Penaeus monodon). (Shinn và cộng sự, 2018; Tang và cộng sự, 2020). Thiệt hại kinh tế do dịch bệnh này lên tới hơn 7 tỷ USD mỗi năm (Tang và cộng sự, 2020), và do đó AHPND đã được Tổ chức Thú y Thế giới (OIE) liệt kê là một bệnh phải khai báo vào năm 2019 (OIE, 2019).
Việc áp dụng kháng sinh là một chiến lược hiệu quả để ngăn ngừa nhiều loại vi khuẩn Gram âm/dương trên tôm nuôi (Baticados và Paclibare, 1992; Yano và cộng sự, 2014). Tuy nhiên, việc sử dụng kháng sinh bừa bãi trong nuôi tôm đã dẫn đến sự phát triển nhanh chóng của các chủng vi khuẩn kháng thuốc, cuối cùng tạo thành mối đe dọa trực tiếp đến sức khỏe con người và môi trường (Cabello, 2006; DeLorenzo và cộng sự, 2016; Knipe và cộng sự, 2021). Kháng sinh (AMR) hiện là một trong những vấn đề quan trọng nhất đe dọa sức khỏe con người và vật nuôi trên toàn thế giới (Watts và cộng sự, 2017; Okocha và cộng sự, 2018). Do đó, có một nhu cầu cấp thiết là phải phát triển một chiến lược để ngăn chặn sự lan truyền mầm bệnh và tăng cường khả năng miễn dịch của tôm trong các hoạt động nuôi trồng. Probiotic được định nghĩa là các vi sinh vật sống mang lại lợi ích sức khỏe cho vật chủ khi được cung cấp với số lượng đầy đủ (Hill và cộng sự, 2014). Trong vài năm qua, chế phẩm sinh học đang ngày càng trở thành lựa chọn thay thế phổ biến cho kháng sinh để thúc đẩy tăng trưởng, tình trạng sức khỏe và ngăn ngừa bệnh tật trong nuôi trồng thủy sản tôm. Một số nghiên cứu đã chỉ ra vai trò quan trọng của men vi sinh trong việc cạnh tranh loại trừ vi khuẩn gây bệnh, đóng góp chất dinh dưỡng và enzyme vào quá trình tiêu hóa của tôm, tăng cường phản ứng miễn dịch của tôm và tác dụng kháng vi-rút (Hoseinifar và cộng sự, 2018; Ringø, 2020). Probiotics có thể được sử dụng bằng đường uống cùng với thức ăn, hoặc trực tiếp vào nước nuôi tôm dưới dạng nuôi cấy hoặc bào tử tinh khiết (Ringø, 2020), hoặc trong môi trường tăng trưởng lên men, ví dụ, bột đậu nành lên men Bacillus subtilis E20 (Tsai và cộng sự, 2019; Wang và cộng sự, 2019). Tương tự như vậy, chế phẩm sinh học có thể được sử dụng kết hợp với một thành phần thực phẩm không tiêu hóa được (ví dụ, prebiotic) ảnh hưởng có lợi đến vật chủ bằng cách gây ra tác dụng hiệp đồng, một cách tiếp cận được gọi là “synbiotics” (Schrezenmeir và de Vrese, 2001; Li và cộng sự, 2018; Knipe và cộng sự, 2021). Công thức synbiotic bao gồm các chế phẩm sinh học được đánh giá tương ứng với hai chi vi khuẩn, Enterococcus spp. và Bacillus spp., với prebiotic, chẳng hạn như mannan oligosacarit (MOS) và fructooligosacarit (FOS), và đã được nghiên cứu trên các loài cá, chẳng hạn như cá hồi vân, cá bơn Nhật Bản, cá đù vàng và cá bớp (Cerezuela và cộng sự, 2011; Huynh và cộng sự, 2017; Villumsen và cộng sự, 2020). Synbiotic cải thiện khả năng sống sót, khả năng kháng bệnh và hệ sinh thái vi sinh vật trong đường tiêu hóa của vật chủ dẫn đến lợi ích lớn hơn so với việc áp dụng probiont riêng lẻ (Ohtani và cộng sự, 2020; Knipe và cộng sự, 2021). Pediococcus pentosaceus, một loài vi khuẩn axit lactic, đã được chứng minh là tác nhân thúc đẩy tăng trưởng, phản ứng miễn dịch và kháng bệnh, đồng thời thay thế kháng sinh ở tôm nuôi (Leyva-Madrigal và cộng sự, 2011; Adel và cộng sự, 2017; Won và cộng sự, 2020). Việc bổ sung FOS trong thức ăn đã được chứng minh là có lợi trong việc cải thiện năng suất tăng trưởng, đáp ứng miễn dịch và tỷ lệ sống của tôm thẻ chân trắng (Hu và cộng sự, 2019; Mustafa và cộng sự, 2020). Tuy nhiên, cơ chế tác động của P. pentosaceus kết hợp với FOS lên phản ứng miễn dịch của vật chủ vẫn chưa rõ ràng (Cerezuela và cộng sự, 2011; Huynh và cộng sự, 2018). Nghiên cứu này nhằm mục đích kiểm tra xem hiệu suất tăng trưởng, đáp ứng miễn dịch và khả năng chống lại cảm nhiễm V. parahaemolyticus có thể được cải thiện hay không khi tôm thẻ chân trắng L. vannamei được cho ăn khẩu phần ăn có bổ sung kết hợp P. pentosaceus và FOS.
2. Vật liệu và phương pháp
2.1. Chế phẩm Probiotic
P. pentosaceus chủng R6 được chọn đánh giá trong nghiên cứu này được phân lập từ nước mắm cá cơm lên men sản xuất tại nhà, một sản phẩm nước mắm thương mại ở tỉnh Thừa Thiên Huế, Việt Nam theo phương pháp cải tiến của Adel và cộng sự (2017). Nước mắm được rửa sạch, đồng nhất và hòa tan trong dung dịch muối đệm phốt phát vô trùng (PBS) theo tỷ lệ 1 nước mắm và 9 PBS (v/v). Sau đó, huyền phù được pha loãng thành 10–3, 10–4, 10–5 và 10–6. Cuối cùng, huyền phù được cấy trên thạch De Man Rogosa và Sharp (MRS) (Merck, Damstadt, Đức) và được ủ trong điều kiện hiếu khí ở 28°C trong 24 giờ. Trong số 11 chủng được phân lập từ nước mắm cá cơm, sáu chủng được xác định là P. pentosaceus theo kết quả giải trình tự 16S rDNA bằng cách sử dụng đoạn mồi đa năng của 16S rDNA của sinh vật nhân sơ: 27F (5′-AGAGTTTGATCCTGGCTCAG-3′), và 1492R (5′-AAGGAGGTGATCCAGCCGCA-3′) (Ngõ, 1991). Sáu chủng P. pentosaceus được thử nghiệm tác dụng kháng V. parahaemolyticus bằng phương pháp khuếch tán trên thạch (Bernal và cộng sự, 2015) và hoạt tính hemolysis trong máu tôm thẻ chân trắng theo mô tả của Chang và cộng sự (2000). Tóm lại, các chủng P. pentosaceus được nuôi cấy trên môi trường MRS trong 24 giờ ở 28°C. 100 µL huyền dịch V. parahaemolyticus ở nồng độ 106 cfu/ ml, được thu hồi từ các ổ dịch AHPND ở tỉnh Thừa Thiên Huế (Việt Nam), được cấy trên TSA (Tryptone Soya Agar, Oxoid, Hamsphire, United Kingdom)) có thêm 2% NaCl. Sau 30 phút, từ đĩa TSA, sáu nút thạch 2 mm đã được loại bỏ bằng một mũi khoan nút chai (đường kính 2 mm) và 100 μl dịch cấy qua đêm của mỗi chủng P. pentosaceus được đặt trên các giếng này. Sau đó, các đĩa này được ủ ở 28°C trong 24 giờ và đường kính của vùng ức chế được đo để xác định hoạt tính kháng khuẩn.
Thạch máu tôm bao gồm 1 ml dịch hemolymp tôm thẻ chân trắng trong môi trường chứa 200 ppm Rose Bengal được sử dụng để xác định hoạt tính tan huyết của 6 chủng P. pentosaceus phân lập (Chang và cộng sự, 2000). Hemolymph (1 ml) được rút ra giữa lớp vỏ thứ nhất và lớp vỏ thứ hai từ tôm thẻ chân trắng trước đó đã được khử trùng bề mặt bằng cồn 70%. Dịch hemolymp (1 ml) ngay lập tức được chuyển vào một ống đã khử trùng có chứa 0,2 ml dung dịch đệm citrate-EDTA (glucose 0,1 M, trinatri citrate 30 mM, axit xitric 26 mM và EDTA 10 mM được hòa tan trong nước biển 20 ppt) và được nhuộm bởi thêm 133 μl 3% (w/v) Rose Bengal (hòa tan trong dung dịch đệm EDTA citrate) và xoay nhẹ để thu được hỗn hợp hoàn chỉnh. Hemolymph nhuộm màu Rose Bengal (1 ml) được thêm vào 15 ml Nutrient Agar (Himedia, Mumbai, Ấn Độ) với 1,5% NaCl, được làm lạnh đến 45–50°C trong bể nước và lắc nhẹ để trộn đúng cách và đổ vào đĩa petri. Sáu phân lập P. pentosaceus được cấy vào đĩa thạch máu tôm. Các đĩa này được ủ trong 48 giờ ở 28°C và quan sát sự hình thành vùng trong suốt xung quanh các khuẩn lạc được cấy.
Dựa trên kết quả về tác dụng kháng khuẩn và không gây tan huyết (xem Dữ liệu bổ sung) trên môi trường thạch máu tôm chân trắng, phân lập P. pentosaceus R6 đã được chọn để điều chế lợi khuẩn. P. pentosaceus R6 được nuôi cấy và ủ ở 28°C trong 48 giờ trên thạch MRS. Từ một đĩa tăng trưởng vi khuẩn thuần khiết của P. pentosaceus R6 trên thạch MRS, một khuẩn lạc duy nhất được phân lập và đặt trực tiếp vào 20 ml môi trường MRS vô trùng và ủ trong 48 giờ ở 28°C trong tủ ấm lắc (máy lắc Kuhner, ISF-1-W, Thụy Sĩ; 140 vòng/phút). Sau 48 giờ, huyền phù vi khuẩn được ly tâm ở tốc độ 3.500 vòng/phút (Sanyo NSE Mistral 2000R, Nhật Bản) trong 30 phút, rửa hai lần trong PBS vô trùng có chứa 0,02 M phosphat và 0,15 M NaCl, và các viên tế bào thu được được tái huyền phù trong PBS để đạt được giá trị OD600nm là 1, tương đương với 1 × 109 cfu/ ml dựa trên các đường cong sinh trưởng của vi khuẩn tiêu chuẩn (dữ liệu không được trình bày). Nồng độ vi khuẩn thực tế được xác định bằng số lượng khuẩn lạc khả thi theo phương pháp của Miles và cộng sự (1938). Các viên được thu thập bằng cách ly tâm ở 3.500 vòng/phút trong 30 phút, trộn với 20% sữa không kem và được bảo quản ở -70°C. Mẫu vi khuẩn đông lạnh được cô đặc trong máy sấy đông lạnh và đồng nhất, sau đó bảo quản bột vi khuẩn ở 4°C cho đến khi sử dụng. Khả năng tồn tại của hỗn hợp vi khuẩn được xác định theo phương pháp của Miles và cộng sự (1938).
2.2. Chuẩn bị khẩu phần ăn thử nghiệm
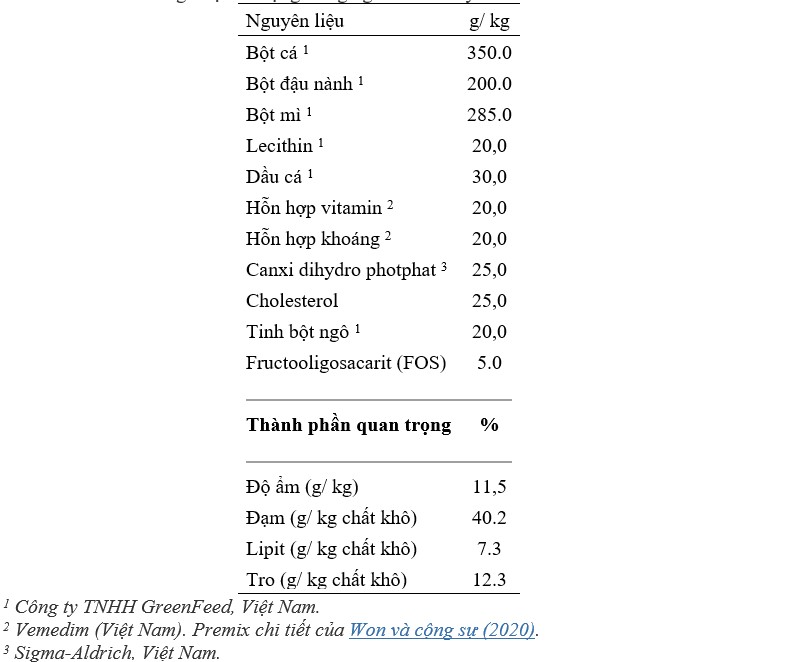
Tổng cộng, một khẩu phần ăn đối chứng và ba khẩu phần ăn thử nghiệm đã được xây dựng trong nghiên cứu này. Công thức thức ăn và thành phần gần đúng của khẩu phần ăn đối chứng được chuẩn bị có bổ sung 0,5% FOS trong khẩu phần ăn cơ bản được trình bày trong Bảng 1. Khẩu phần ăn đối chứng không được bổ sung P. pentosaceus (Đối chứng), trong khi ba khẩu phần ăn thử nghiệm khác được xây dựng công thức bằng cách bổ sung P. pentosaceus vào khẩu phần ăn đối chứng ở mức đưa vào là khẩu phần ăn 1 × 106 cfu/ g (P1), 1 × 107 cfu/ g khẩu phần (P2), hoặc 1 × 108 cfu/ g khẩu phần (P3). Việc chuẩn bị và bảo quản khẩu phần ăn được tiến hành theo Adel và cộng sự (2017). Tất cả các thành phần khô được cân, nghiền trong máy nghiền búa để đi qua sàng lưới 250 μm, sau đó được trộn trong máy trộn. Sau đó, dầu cá và nước được thêm vào cho đến khi tạo thành một khối bột nhão. Mỗi khẩu phần sau đó được đưa qua máy ép viên phòng thí nghiệm (3A, Việt Nam) để thu được các viên có đường kính từ 0,5 đến 1 mm. Các viên được sấy khô trong không khí trong 72 giờ đến độ ẩm <10%, sau đó được bảo quản ở 4°C trong tủ lạnh cho đến khi sử dụng. Các lô thức ăn mới được sản xuất 2 tuần một lần để duy trì khả năng sống sót của P. pentosaceus.
Bảng 1. Thành phần và thành phần quan trọng (% trọng lượng khô) của khẩu phần đối chứng cho tôm thẻ chân trắng được sử dụng trong nghiên cứu này.
2.3. Tôm và thiết kế thí nghiệm
Tôm thẻ chân trắng giống được mua từ Trung tâm Quốc gia Giống Thủy sản Trung ương tại xã Phú Hải, huyện Phú Vang, tỉnh Thừa Thiên Huế, Việt Nam. Chúng được chuyển bằng ô tô có máy lạnh đến phòng thí nghiệm ướt của Phòng thí nghiệm bệnh học cá của trường Đại học Nông Lâm, thành phố Huế, Việt Nam. Tôm con được duy trì trong bể sợi thủy tinh 1.000L sử dụng dòng nước chảy liên tục ở 0,38 L/ phút ở 28 ± 2°C. Chúng đã thích nghi với các điều kiện thí nghiệm trong 14 ngày, trong đó chúng được cho ăn 4 lần/ ngày với khẩu phần ăn đối chứng. Tôm sử dụng trong nghiên cứu này được kiểm dịch miễn phí bệnh AHPND, hội chứng đốm trắng, đầu vàng tại Phòng khám Thú y, Chi cục Chăn nuôi và Thú y Thừa Thiên Huế. Trước khi bắt đầu thí nghiệm cho ăn, việc kiểm tra sức khỏe của tôm được thực hiện bằng cách lấy mẫu gan tụy của 5 con tôm trực tiếp trên môi trường thạch Thiosulfate Citrate Bile Salts (TCBS, Himedia, Mumbai, Ấn Độ) và kiểm tra sự phát triển của vi khuẩn (Phuoc và cộng sự, 2021) .
Tổng số 1.200 tôm con với trọng lượng cơ thể ban đầu là 0,5 (± 0,1) g được phân phối ngẫu nhiên vào 12 bể sợi thủy tinh (120L, 3 bể mỗi khẩu phần, 100 con tôm mỗi bể) được trang bị sục khí liên tục. Tôm được cho ăn 4 lần/ ngày (07:00 giờ, 12:00 giờ, 16:00 giờ và 20:00 giờ) với khẩu phần ăn đối chứng hoặc thử nghiệm với tỷ lệ 5–7% trọng lượng cơ thể ướt. Trong thời gian thí nghiệm, các thông số nước được duy trì ở nhiệt độ 27 ± 1°C, pH 7,7–8,3, oxy hòa tan 5,5–7,3mg/ L, độ mặn 20–22g/ L và quang kỳ 12 giờ sáng: 12 giờ tối trong 60 ngày. Tình trạng của các bể được duy trì bằng cách hút sạch tất cả các chất cặn bã, phân, tôm lột xác và tôm chết vào buổi sáng. Thức ăn thừa được hút ra sau 2 giờ cho ăn từ bể. Sau chế độ cho ăn 60 ngày, 30 con tôm từ mỗi nhóm thử nghiệm được thu thập để thử nghiệm với V. parahaemolyticus. 6 con tôm từ mỗi nhóm được thu thập để đánh giá các phản ứng miễn dịch, bao gồm tổng số tế bào máu, hoạt tính phenoloxidase và hoạt tính lysozyme, và 6 con tôm khác từ mỗi nhóm được sử dụng để thử nghiệm hoạt động thực bào.
2.4. Phân tích hiệu suất tăng trưởng
Gia đoạn cuối của thí nghiệm, tôm được ngưng cho ăn trong 24 giờ, sau đó được cân và đếm. Dựa trên trọng lượng của từng con tôm và số lượng tôm con sống sót, tốc độ tăng trưởng cụ thể (SGR), tăng trọng (WG), hệ số chuyển đổi thức ăn (FCR) và tỷ lệ sống (SR) được tính toán theo công thức chuẩn (Adel và cộng sự, 2017):

2.5. Phân tích phản ứng miễn dịch không đặc hiệu
2.5.1. Tổng số tế bào máu
Tổng số lượng tế bào máu (THC) được tiến hành theo mô tả của Chiu và cộng sự (2007). Tóm lại, hemolymp (100 μl) được rút ra từ xoang bụng của mỗi con tôm bằng cách sử dụng ống tiêm vô trùng 1 ml (25 ống đo) chứa 0,9 ml dung dịch chống đông máu (30 mM trinatri citrate, 0,34 M natri clorua và 10 mM EDTA, tại độ pH là 7,55 và với độ thẩm thấu được điều chỉnh bằng glucose thành 780 Osm/ kg). Nhỏ một giọt của từng mẫu hemolymp đã pha loãng vào máy đo hemocytometer và quan sát dưới kính hiển vi ánh sáng để xác định tổng số lượng tế bào máu.
2.5.2. Hoạt động của phenoloxidase
Hoạt tính của Phenoloxidase (PO) được đo bằng phương pháp đo quang phổ bằng cách ghi lại sự hình thành dopachrom được tạo ra từ l-dihydroxyphenylalanine (l-DOPA). 1 µl hemolymp pha loãng từ mỗi ống được ly tâm ở 800 × g và 4°C trong 20 phút. Chất nổi trên bề mặt được loại bỏ và viên được rửa sạch, tái huyền phù nhẹ nhàng trong dung dịch đệm 500 μl cacodylate citrate (natri cacodylate 10 mM, natri clorua 450 mM và trinatri citrate 100 mM; pH 7,0), sau đó ly tâm lại. Chất nổi trên bề mặt đã bị loại bỏ và viên nhỏ được tạo huyền phù lại trong 100 μl dung dịch đệm cacodylat (natri cacodylat 10 mM, natri clorua 450 mM, canxi clorua 10 mM và magie clorua 260 mM; pH 7,0) và các phần dịch bằng nhau (huyền phù tế bào) là đặt vào hai ống. Một ống được sử dụng để đo hoạt tính PO và ống còn lại được đo hoạt tính PO nền. Huyền phù tế bào (100 μl) được ủ trong 10 phút ở 25–26°C với 50 μl trypsin (1 mg/ ml), đóng vai trò như một elicitor. 50 µL l-DOPA đã được thêm vào, tiếp theo là 800 μl dung dịch đệm cacodylate 5 phút sau đó. Dung dịch đối chứng, bao gồm 100 μl huyền phù tế bào, 50 μl dung dịch đệm cacodylate (để thay thế trypsin), 50 μl l-DOPA và 800 μl dung dịch đệm cacodylate, được sử dụng cho hoạt tính PO nền. Hoạt tính PO của tôm được đo ở OD 490nm bằng máy đo quang phổ (Jasco V-630, Hachioji, Tokyo, Nhật Bản).
2.5.3. Hoạt tính lysozyme
Hoạt tính lysozyme (LYS) được định lượng theo các quy trình được mô tả bởi Chiu và cộng sự (2007). Tóm lại, 500 μl hemolymp pha loãng được ly tâm và kết tủa được trộn với 1 ml (0,02%) Micrococcus lysodeikticus (Sigma, St. Louis, MO, Hoa Kỳ). Phản ứng được thực hiện ở nhiệt độ phòng và độ hấp thụ ở bước sóng 530 nm được đo sau 0,5 và 4,5 phút. Một đơn vị hoạt tính LYS được định nghĩa là lượng enzyme tạo ra sự giảm độ hấp thụ 0,01/ phút và hoạt động cụ thể được biểu thị bằng U (g protein).
2.5.4. Xét nghiệm hoạt động thực bào
20 µL huyền phù vi khuẩn V. parahaemolyticus (2 × 106 cfu/ ml) được tiêm vào xoang bụng. Tôm sau khi tiêm được nuôi trong bể riêng chứa 40L nước biển (20‰) cho 2 hat 27 ± 1°C. Hemolymph (100 μl) từ 6 con tôm đã được rút ra và trộn với 900 μl dung dịch chống đông máu. 100 µL của mẫu hemolymp đã pha loãng được trộn với 100 μl paraformaldehyde 0,1% và ủ trong 30 phút ở 4°C để cố định các tế bào máu. Sau đó, 50 μl huyền phù được trải trên một phiến kính. Phiến kính được đặt trong máy ly tâm cytospin và ly tâm ở 113 × g trong 3 phút. Phiến kính sau đó được làm khô trong không khí, nhuộm màu Diff-Quick và quan sát bằng kính hiển vi ánh sáng. 200 tế bào máu đã được đếm. Hoạt động thực bào (PA) được thể hiện như sau:

2.6. Thử nghiệm cảm nhiễm
V. parahaemolyticus gây bệnh được lấy từ phòng thí nghiệm Bệnh học cá, Khoa Thủy sản, Trường Đại học Nông Lâm, Đại học Huế, Việt Nam. Một khuẩn lạc V. parahaemolyticus duy nhất phát triển trên thạch TCBS được cấy truyền trong 10 ml Môi trường Tryptone Soya (Oxoid, Hamsphire, Vương quốc Anh) chứa 2% NaCl ở 28°C trong 24 giờ để đạt được sự tăng trưởng theo cấp số nhân. Môi trường nuôi cấy được ly tâm ở 3.000 vòng/ phút trong 30 phút ở 4°C. Phần nổi phía trên được loại bỏ và viên vi khuẩn được tái huyền phù trong dung dịch muối (NaCl 0,85%), tương ứng với khoảng 109 cfu/ ml cho thử nghiệm đối chứng. Số lượng khuẩn lạc khả thi được thực hiện bằng phương pháp của Miles và cộng sự (1938).
Sau 60 ngày, tôm được nuôi bằng các khẩu phần ăn thử nghiệm khác nhau (30 con tôm mỗi bể × 3 bể mỗi nghiệm thức = 90 con mỗi nghiệm thức) đã được cảm nhiễm với V. parahaemolyticus bằng cách ngâm trong 1 giờ. Tôm được ngâm trong 10 L nước biển 20‰ có chứa vi khuẩn ở 1,1 × 106 cfu/ ml ở 28 ± 1°C, vớt ra sau 1 giờ và đặt vào bể thí nghiệm dòng chảy (120 L) ở 0,38 L/ phút, với nhiệt độ nước ở 26 ± 2°C trong 14 ngày để ghi lại mọi hành vi bất thường, dấu hiệu lâm sàng và tỷ lệ chết hàng ngày. Nồng độ vi khuẩn được xác định từ các nghiên cứu thí điểm trước đó và được thiết kế để đưa ra tỷ lệ chết tổng cộng là 60% (dữ liệu không được hiển thị). Sục khí được cung cấp thông qua một viên đá không khí cho mỗi bể và tôm được cho ăn bằng khẩu phần ăn đối chứng đến mức cảm thấy no rõ ràng 2 lần mỗi ngày. Khi kết thúc thử nghiệm cảm nhiễm, tỷ lệ chết tích lũy (%) được tính toán như mô tả trước đây (Kongnum và Hongpattarakere, 2012).
2.7. Phân tích thống kê
Dữ liệu được biểu thị dưới dạng trung bình ± độ lệch chuẩn. Đầu tiên, chúng được kiểm tra để phân phối dữ liệu Gaussian cơ bản bằng cách sử dụng phép thử Shapiro–Wilks. Sau khi phân phối này được xác nhận, dữ liệu được phân tích bằng ANOVA một chiều và nhiều phép so sánh được thực hiện bằng bài kiểm tra Tukey post hoc. Tất cả các phân tích thống kê được thực hiện bằng SPSS 20.0 (SPSS Inc, Chicago, IL, United States). Sự khác biệt được coi là đáng kể ở p < 0,05.
3. Kết quả
3.1. Hiệu suất tăng trưởng
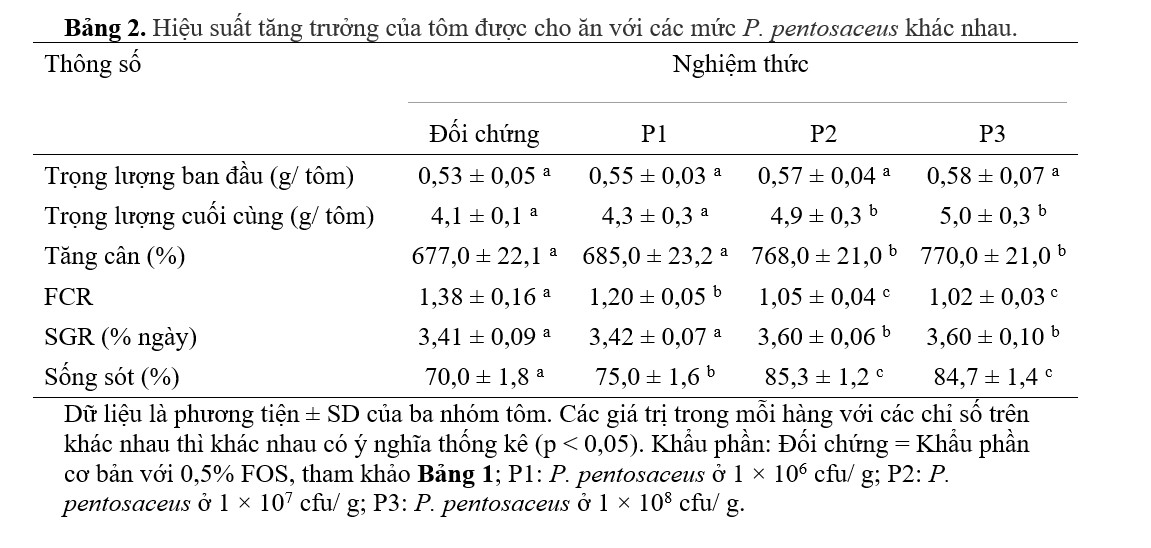
Hiệu suất tăng trưởng của L. vannamei đã được trình bày trong bảng 2. Trọng lượng cơ thể cuối cùng, WG và SGR của tôm đều tăng ở tất cả các nhóm được cho ăn bằng khẩu phần ăn có bổ sung P. pentosaceus so với nhóm được cho ăn bằng khẩu phần ăn đối chứng. Trọng lượng cơ thể cuối cùng và WG của tôm được cho ăn khẩu phần ăn P2 hoặc P3 cao hơn đáng kể (p <0,05) khi so sánh với nhóm đối chứng và nhóm P1. Các giá trị này của tôm trong nhóm được cho ăn bằng khẩu phần ăn P1 cao hơn nhưng không khác biệt đáng kể so với tôm trong nghiệm thức đối chứng (p > 0,05). FCR giảm và thấp hơn đáng kể ở tất cả các nghiệm thức được cho ăn bằng khẩu phần ăn có bổ sung P. pentosaceus so với ở nhóm đối chứng (p < 0,05). Tương tự như vậy, tỷ lệ sống sót cao hơn đáng kể trong tất cả các nhóm được cho ăn P. pentosaceus so với nhóm được cho ăn bằng khẩu phần ăn đối chứng. Tỷ lệ sống cao nhất được quan sát thấy ở nghiệm thức P2 khi tôm được cho ăn khẩu phần ăn có bổ sung P. pentosaceus ở mức bổ sung 1 × 107 cfu/ g, cao hơn đáng kể so với tỷ lệ quan sát thấy ở nghiệm thức P1 khi tôm được cho ăn P. pentosaceus ở 1 × 106 cfu/ g (p < 0,05) nhưng không khác biệt đáng kể so với tôm được nuôi bằng P. pentosaceus ở 1 × 108 cfu/ g (P3) (p > 0,05).
3.2. Phản ứng miễn dịch
Cho ăn khẩu phần có bổ sung P. pentosaceus đã cải thiện đáng kể phản ứng miễn dịch của tôm con L. vannamei, đặc biệt là liên quan đến THC, lysozyme, PO và hoạt động thực bào chống lại V. parahaemolyticus (bảng 3, 4). Một sự gia tăng đáng kể (p <0,05) trong hoạt tính THC và PO đã được ghi nhận ở nhóm được cho ăn bằng khẩu phần ăn có bổ sung P. pentosaceus so với nhóm đối chứng. Trong trường hợp THC, giá trị cao nhất được ghi lại trong nhóm P3, tiếp theo là nhóm P2, trong khi đó trong trường hợp hoạt tính PO, nhóm P3 ghi lại hoạt tính PO tối đa, nhưng không khác biệt đáng kể so với hoạt động của nhóm P1 và P2 (p > 0,05). Cho tôm ăn khẩu phần ăn có bổ sung P. pentosaceus trong khẩu phần ăn P2 cho thấy hoạt tính của enzyme LYS tăng tối đa. Tuy nhiên, không có sự khác biệt đáng kể nào được ghi nhận với nhóm P3 (p> 0,05). Hoạt tính lysozyme của tôm ăn khẩu phần P1 và của nhóm đối chứng không khác biệt đáng kể (p > 0,05) (bảng 3).
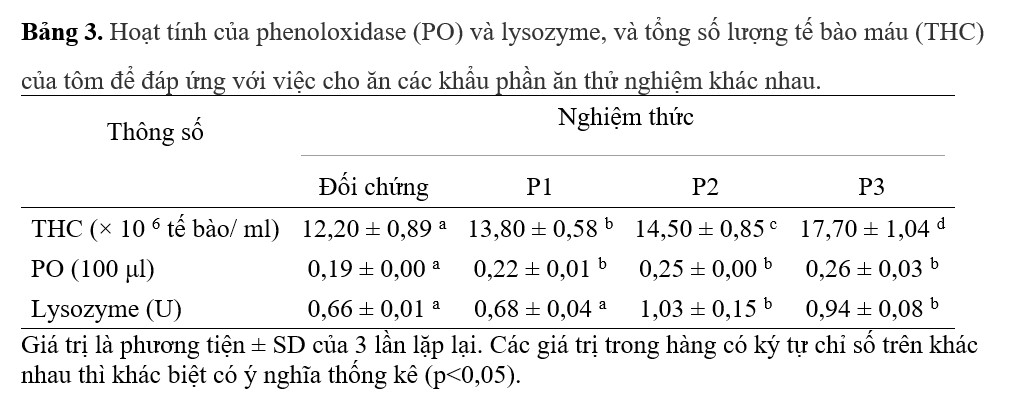

Trong nghiên cứu hiện tại, các hoạt động thực bào của tôm được cho ăn khẩu phần ăn có bổ sung P. pentosaceus cao hơn đáng kể so với nhóm được cho ăn khẩu phần ăn đối chứng. Trong số các nghiệm thức, những nhóm được nuôi bằng khẩu phần ăn P3 có bổ sung P. pentosaceus thể hiện hoạt động thực bào cao nhất, tiếp theo là nhóm P2 và P1. Tuy nhiên, không có sự khác biệt có ý nghĩa thống kê giữa nhóm P2 và P3 (p > 0,05) (Bảng 4).
3.3. Thử nghiệm cảm nhiễm
Cho ăn khẩu phần ăn có bổ sung P. pentosaceus gây ra ảnh hưởng đáng kể đến tỷ lệ chết tích lũy của tôm, bất kể liều lượng P. pentosaceus trong thức ăn được sử dụng, lưu ý rằng phân lập được sử dụng ở mức LD60 (Hình 1). Tỷ lệ chết được ghi nhận cao nhất ở nhóm đối chứng được cho ăn bằng khẩu phần ăn đối chứng không bổ sung P. pentosaceus. Tỷ lệ chết mỗi nghiệm thức giảm khi tăng liều P. pentosaceus (Hình 1). Tỷ lệ chết của tôm được cho ăn bằng khẩu phần ăn P3 là thấp nhất nhưng không khác biệt đáng kể so với nhóm nghiệm thức được cho ăn bằng khẩu phần ăn P2 (p > 0,05). Tỷ lệ chết của hai nghiệm thức này thấp hơn đáng kể so với nhóm P1 (p < 0,05 cho cả hai nhóm). Tỷ lệ chết của tôm nuôi bằng khẩu phần ăn P3 thấp hơn nhưng không khác biệt đáng kể so với nhóm đối chứng (p > 0,05).
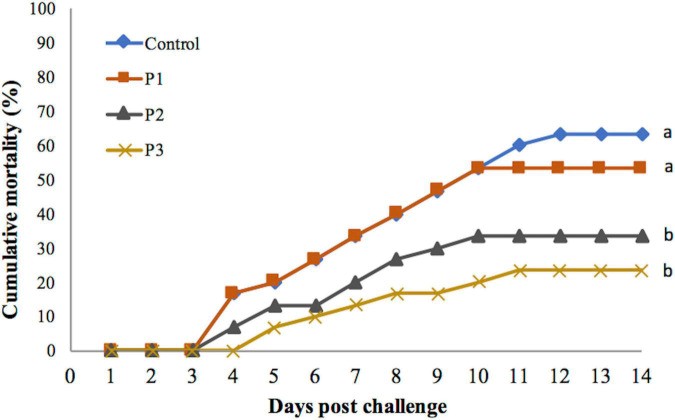
Hình 1. Tỷ lệ chết tích lũy của tôm thẻ chân trắng chưa trưởng thành được cho ăn với các liều lượng P. pentosaceus khác nhau trong 60 ngày và thử nghiệm cảm nhiễm với V. parahaemolyticus trong 14 ngày. Số liệu có chữ cái khác nhau thì khác biệt có ý nghĩa thống kê giữa các nhóm (p <0,05).
Tỷ lệ chết lần đầu tiên được quan sát thấy vào ngày thứ 3 sau cảm nhiễm ở tất cả các nhóm thử nghiệm ngoại trừ nhóm P3 được cho ăn bằng khẩu phần ăn có bổ sung 1 × 108 cfu/ g P. pentosaceus. Trong nhóm P3, tỷ lệ chết được ghi nhận vào ngày thứ 4 sau cảm nhiễm. Tỷ lệ chết thấp hơn có liên quan đến tỷ lệ chết khởi phát muộn hơn. Tỷ lệ chết tiếp tục cho đến ngày thứ 12 sau cảm nhiễm trong nhóm đối chứng. Trong khi ở các nghiệm thức, tỷ lệ chết chỉ tiếp tục cho đến ngày thứ 10, ngoại trừ nhóm P3, trong đó tỷ lệ chết tiếp tục cho đến ngày thứ 11 sau cảm nhiễm (Hình 1).
4. Thảo luận
Các chủng vi khuẩn lactic từ lâu đã được sử dụng làm chế phẩm sinh học trong nuôi trồng thủy sản, nhưng trong những năm gần đây P. pentosaceus được quan tâm nhiều hơn để ứng dụng trên tôm nuôi. Điều này là do có nhiều tác dụng có lợi, đặc biệt là về năng suất tăng trưởng, hoạt tính của enzyme tiêu hóa (Adel và cộng sự, 2017; Won và cộng sự, 2020), khả năng miễn dịch và khả năng chống chịu đối với vibrio gây bệnh (Adel và cộng sự, 2017). Trong nghiên cứu này, các mức độ bao gồm khác nhau của chủng lợi khuẩn P. pentosaceus kết hợp với một mức độ cố định của thành phần prebiotic FOS đã biết để phát triển công thức synbiotic nhằm xác định tác động đối với các chỉ số tăng trưởng, tình trạng miễn dịch và đặc điểm chống chịu căng thẳng do nhiễm trùng ở tôm thẻ chân trắng L. vannamei quan trọng về mặt thương mại. Kết quả cho thấy khi P. pentosaceus được kết hợp với 0,5% FOS, đặc biệt là ở các nghiệm thức P2 và P3, đã đạt được sự gia tăng đáng kể về trọng lượng cuối cùng. Cải thiện tăng trọng của tôm con khi cho ăn khẩu phần ăn P2 hoặc P3 dẫn đến FCR thấp hơn đáng kể so với các khẩu phần ăn khác. Điều quan trọng cần lưu ý rằng tỷ lệ chết trong nhóm đối chứng khoảng 63% khi kết thúc thử nghiệm cho ăn. Tuy nhiên, ở các nghiệm thức, tỷ lệ chết giảm đáng kể, nhóm P2 và P3 có tỷ lệ chết là 15%. Điều này cho thấy chủng lợi khuẩn ở các mức độ bao gồm 1 × 107 cfu/ g (P2) hoặc 1 × 108 cfu/ g (P3) và kết hợp với 0,5% FOS không có tác động bất lợi đến sự sống sót của tôm con, ít nhất là trong điều kiện thí nghiệm được mô tả, và do đó có thể được coi là an toàn để sử dụng trong thức ăn của L. vannamei. Mặc dù tất cả các loại thức ăn thử nghiệm trong nghiên cứu này đều được tạo công thức có bổ sung prebiotic, nhưng sự cải thiện quan sát được về hiệu suất tăng trưởng có liên quan đến sự khác biệt trong thành phần lợi khuẩn của công thức synbiotic. Theo hiểu biết của chúng tôi, không có báo cáo sẵn có nào về ảnh hưởng của việc bổ sung P. pentosaceus trong khẩu phần ăn kết hợp với FOS đối với hiệu suất tăng trưởng và tỷ lệ sống ở tôm con L. vannamei. Tuy nhiên, trong các nghiên cứu trước đó, Adel và cộng sự (2017) và Won và cộng sự (2020) báo cáo rằng việc bổ sung P. pentosaceus vào khẩu phần ăn có thể tạo ra sự cải thiện đáng kể về năng suất tăng trưởng và sử dụng dinh dưỡng ở tôm thẻ chân trắng L. vannamei, những phát hiện phù hợp với nghiên cứu này. Ngoài ra còn có các nghiên cứu về tôm thẻ chân trắng trong đó tăng trưởng và sử dụng thức ăn được cải thiện để đáp ứng với khẩu phần ăn có bổ sung men vi sinh, chẳng hạn như Bacillus subtilis (Munaeni và cộng sự, 2014; Tsai và cộng sự, 2019; Won và cộng sự, 2020), Bacillus licheniformis (Fan và cộng sự, 2021) và Lactococcus lactis (Won và cộng sự, 2020), đã được báo cáo. Trong một nghiên cứu khác, việc sử dụng 0,2–0,4% FOS trong khẩu phần ăn của tôm đã được chứng minh là cải thiện hiệu suất tăng trưởng, FCR và sự đa dạng của vi sinh vật, đồng thời ngăn chặn một số mầm bệnh tiềm tàng, chẳng hạn như Vibrio tubiashii, V. parahaemolyticus và Photobacterium damselae – giống trong ruột tôm thẻ chân trắng (Hu và cộng sự, 2019). Tuy nhiên, điều đáng chú ý là việc bổ sung FOS trong khẩu phần ăn ở mức 0, 0,15 và 0,30% không gây ra bất kỳ tác dụng có lợi đáng kể nào đối với tỷ lệ sống, tăng trọng và phản ứng miễn dịch của tôm con (Mustafa và cộng sự, 2020). Các nghiên cứu trước đây đã báo cáo rằng việc kết hợp prebiotic, chẳng hạn như MOS, FOS hoặc galactooligosacarit (GOS), với vi khuẩn sinh học, Enterococcus spp., Bacillus spp., hoặc LAB đã cải thiện việc sử dụng chất dinh dưỡng (Zhou và cộng sự, 2009; Won và cộng sự, 2020) và hiệu suất tăng trưởng ở tôm bằng cách tăng diện tích bề mặt hấp thụ của vi nhung mao đường ruột (Das và cộng sự, 2017; Huynh và cộng sự, 2017; Chen và cộng sự, 2020; Butt và cộng sự, 2021; Yao và cộng sự, 2021). Trong quá trình lên men synbiotic, nhiều axit amin thiết yếu được giải phóng, chẳng hạn như histidine, isoleucine, leucine, lysine, tryptophan và các axit amin không thiết yếu như alanine, glutamate và tyrosine (Ndagijimana và cộng sự, 2009; Rodrigues và cộng sự, 2011), và các vitamin, chẳng hạn như ascorbate (vitamin C), folate (vitamin B9) và cyanocobalamin (vitamin B12) (Rossi và cộng sự, 2005; Rodrigues và cộng sự, 2011). Các hợp chất có hoạt tính sinh học này có thể đóng một vai trò quan trọng trong quá trình đồng hóa, hấp thụ và tăng trưởng thức ăn của động vật thủy sinh. Bên cạnh đó, tác động tích cực của việc sử dụng kết hợp FOS và P. pentosaceus, dưới dạng synbiotics, đối với hoạt động tăng trưởng của tôm thẻ chân trắng có thể là do sự gia tăng hoạt tính của enzyme tiêu hóa do P. pentosaceus gây ra. Sự hiện diện của chủng LAB này có thể kích thích sản xuất các enzyme nội sinh trong vật chủ hoặc góp phần vào tổng hoạt tính của enzyme trong ruột như đã được báo cáo trước đây ở tôm (Adel và cộng sự, 2017; Wanna và cộng sự, 2021).
Một số dòng bằng chứng cho thấy rằng hoạt động của hemocytes, PO và lysozyme của giáp xác đóng vai trò quan trọng trong việc tạo ra phản ứng miễn dịch bảo vệ chống lại các bệnh do vi khuẩn bao gồm cả bệnh do vibrios gây ra (Oktaviana và cộng sự, 2014; Zubaidah và cộng sự, 2015; Kuo và cộng sự, 2021). Tôm sở hữu 3 loại tế bào máu có tên là tế bào hyaline, tế bào bán hạt và tế bào hạt (Johansson và cộng sự, 2000). Số lượng tế bào máu có thể thay đổi rất nhiều do phản ứng với nhiễm trùng, áp lực môi trường và vòng đời của động vật (Zubaidah và cộng sự, 2015; Kuo và cộng sự, 2021). Sự gia tăng THC giúp tăng cường khả năng miễn dịch trong thời kỳ căng thẳng dẫn đến khả năng kháng bệnh ở loài giáp xác (Chiu và cộng sự, 2007). Prophenoloxidase đóng một vai trò quan trọng trong việc tạo ra các phản ứng miễn dịch bảo vệ ở động vật giáp xác. Cơ chế được đề xuất của prophenoloxidase là PO hoạt động gây ra quá trình oxy hóa phenol thành quinon và dẫn đến sản xuất melanin, chất này có thể giữ và ngăn chặn mầm bệnh truyền nhiễm dẫn đến thực bào và sản xuất chất phản ứng gây độc tế bào (Chiu và cộng sự, 2007; Amparyup và cộng sự, 2012). Trong nghiên cứu này, P. pentosaceus bổ sung ở cấp độ bao gồm 1 × 106 cfu/ g (P1) hoặc 1 × 107 cfu/ g (P2), hoặc 1 × 108 cfu/ g (P3) trong các khẩu phần ăn có 0,5% FOS tạo ra sự cải thiện đáng kể nhất trong hoạt tính PO, so với các khẩu phần ăn đối chứng. Thực bào là một cơ chế bảo vệ tế bào quan trọng, trong khi lysozyme là một cơ chế bảo vệ thể dịch quan trọng ở động vật giáp xác. Kết quả của nghiên cứu hiện tại phù hợp với các nghiên cứu trước đây đã chứng minh rằng synbiotic làm tăng sự tăng sinh tế bào máu và hoạt tinh của các enzyme PO và lysozyme (Adel và cộng sự, 2017). Kết quả cho thấy rằng sự cải thiện trong các phân tử tác động miễn dịch đã được thử nghiệm ở nhóm được cho ăn bằng khẩu phần ăn có bổ sung 1 × 107 cfu/ g (P2) hoặc 1 × 108 cfu/ g (P3) có liên quan chặt chẽ với việc giảm đáng kể tỷ lệ chết của tôm L. vannamei bị cảm nhiễm bởi V. parahemolyticus được cho ăn bằng khẩu phần ăn có bổ sung P. pentosaceus. Kết quả này cho thấy rằng bên cạnh tác động tích cực đến sự tăng trưởng, loài P. pentosaceus probiont còn có những tác động bổ sung có lợi cho sức khỏe.
Trong ruột, vi khuẩn có thể bám vào bề mặt biểu mô ruột bằng cách gắn đặc hiệu protein bề mặt vi khuẩn vào oligosacarit bổ sung trên bề mặt mô. Các oligosacarit như FOS có thể điều chỉnh chất kết dính của vi khuẩn chọn lọc bằng cách đóng vai trò là chất chống kết dính đối với mầm bệnh cơ hội (Van den Abbeele và cộng sự, 2009; Altamimi và cộng sự, 2016). Ngoài ra, oligosacarit có thể tạo ra axit béo chuỗi ngắn (SCFA) làm giảm độ pH trong ruột kết, do đó tạo ra điều kiện không thích hợp cho sự phát triển và tồn tại của vi khuẩn gây bệnh (Chen và cộng sự, 2020). Bằng chứng này có thể giải thích cho khả năng sống sót cao hơn của tôm thẻ chân trắng L. vannamei đã được quan sát thấy ở các nhóm điều trị (P2 và P3) sau khi được cảm nhiễm với V. parahaemolyticus khi P. pentosaceus được bổ sung FOS trong khẩu phần ăn cơ bản.
Tóm lại, công thức synbiotic đã được phát triển kết hợp P. pentosaceus ở mức độ bao gồm 1 × 107 CFU/g hoặc 1 × 108 CFU/g với 0,5% FOS, cho thấy hiệu quả có lợi đối với hiệu suất tăng trưởng và phản ứng miễn dịch của tôm thẻ chân trắng. Kết quả cũng cho thấy rằng sự cải thiện sức đề kháng của tôm con đối với cảm nhiễm V. parahaemolyticus có liên quan đến sự cải thiện đáng kể trong phản ứng miễn dịch được biểu hiện bằng sự gia tăng hoạt tính của các enzyme LYS và PO và số lượng tế bào máu trong các nhóm được cho ăn synbiotic. Kết quả chung cho thấy rằng sự kết hợp của P. pentosaceusvà FOS có thể được cofi là một synbiotic tiềm năng cho các loài tôm nuôi.
Theo Nguyễn Thị Xuân Hồng, Nguyen Thi Hue Linh, Kartik Baruah, Do Thi Bich Thuy, Nguyen Ngoc Phuoc
Nguồn: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8914372/
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Các Chất Thay Thế Mới Như Bacteriocin Dẫn Đầu Trong Việc Thay Thế Kháng Sinh Trong Nuôi Trồng Thủy Sản Ở Tương Lai
- Chiết Xuất Nho Ở Mức Độ Thích Hợp Có Thể Cải Thiện Hiệu Suất Tăng Trưởng Và Hoạt Động Chống Oxy Hóa Của Tôm Thẻ Chân Trắng Litopenaeus vannamei
- Xác Định Tác Nhân Truyền Nhiễm Gây Bệnh Mờ Đục (TPD) Trên Hậu Ấu Trùng Tôm Thẻ Chân Trắng

 English
English