Kỹ Thuật Nuôi, Tin tức
Robins McIntosh về mọi điều bạn cần biết về EHP và nuôi tôm, phần 1
Chuyên gia nuôi tôm Robins McIntosh giải thích về Enterocytozoon hepatopenaei (EHP) và mối liên quan với ngành nuôi tôm toàn cầu.

Robins McIntosh
Robins McIntosh, Phó Giám đốc điều hành của Tập đoàn Charoen Pokphand Foods (Thái Lan), chuyên gia dày dặn kinh nghiệm trong ngành nuôi tôm toàn cầu, đã chia sẻ với Advocate về lịch sử và tác động của Enterocytozoon hepatopenaei (EHP), một trong những bệnh tôm chính ở châu Á và trên thế giới.
Xuất hiện lần đầu tiên trên tôm sú (Penaeus monodon) vào cuối những năm 1980, EHP sau đó được phát hiện trên tôm thẻ chân trắng (Litopenaeus vannamei) vào năm 2004 tại Thái Lan và nhanh chóng lan rộng toàn cầu. Tính chất khó nắm bắt và khó chẩn đoán khiến EHP trở thành mối đe dọa lớn cho các trại nuôi tôm.
McIntosh nhấn mạnh tầm quan trọng của các biện pháp an toàn sinh học, sử dụng tôm bố mẹ được chứng nhận và khử trùng, giám sát để giảm thiểu tác động của EHP.
Ông cũng tiết lộ mối quan hệ cộng sinh giữa EHP và Bệnh phân trắng, trong đó vi khuẩn kỵ khí, đặc biệt là Propionigenium, đóng vai trò quan trọng. Mức độ oxy hòa tan được cho là yếu tố ảnh hưởng đến mức độ nghiêm trọng của bệnh. McIntosh đề cập đến sự khác biệt về mức độ nghiêm trọng của EHP ở châu Mỹ so với châu Á, do sự khác biệt về chủng bệnh và mật độ thả giống.
Dưới đây là tóm tắt những điểm chính từ cuộc trò chuyện của chúng tôi với Robins McIntosh.
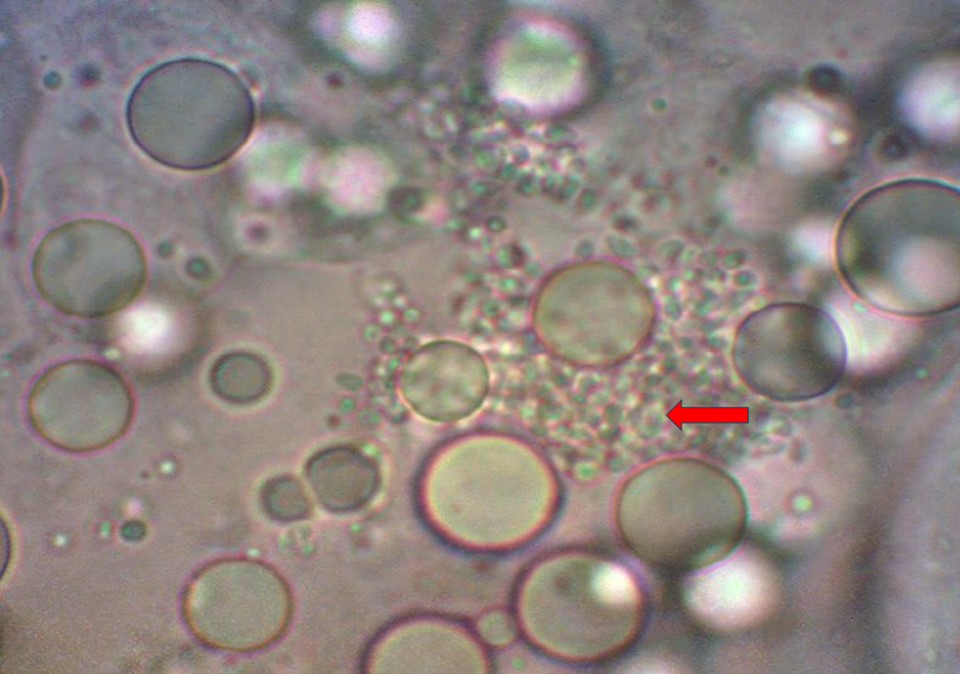
Bào tử Enterocytozoon hepatopenaei (EHP) trong gan tụy của tôm bị nhiễm bệnh.
Lịch sử của EHP
Mặc dù thường được coi là một căn bệnh mới nổi, EHP thực chất đã xuất hiện từ lâu.. Những ghi chép đầu tiên về EHP trên tôm sú (Penaeus monodon) được ghi nhận vào cuối những năm 1980. Tuy nhiên, phải đến năm 2004, EHP mới được mô tả chính xác ở Thái Lan. Năm 2011, nhà khoa học Robins McIntosh lần đầu tiên quan sát thấy EHP ở Thái Lan, ghi nhận các triệu chứng rõ ràng nhưng nguyên nhân vẫn chưa được xác định.
Tại hội nghị ở Bangkok năm 2012, McIntosh đã trình bày những con tôm Thái Lan nhiễm EHP cho Tiến sĩ Donald Lightner, chuyên gia về bệnh tôm. Tiến sĩ Lightner chưa từng gặp EHP trước đây và không thể chẩn đoán chính xác. Chỉ biết rằng những cấu trúc bất thường này xuất hiện trong gan tụy (HP) của tôm bị ảnh hưởng, đồng thời đi kèm với các vấn đề khác. Vào thời điểm đó, EHP vẫn là một căn bệnh bí ẩn, chưa được xác định. Năm 2012-2013, EHP lây lan nhanh chóng sang Trung Quốc, gây ra những tổn thất lớn cho ngành nuôi tôm tại đây. Các triệu chứng của EHP ở Trung Quốc cũng không được xác định vào thời điểm đó, nhưng sau này được xác nhận là do EHP gây ra.
Cũng trong thời gian này, các cấu trúc giống như grgarines (một nhóm động vật nguyên sinh ký sinh) được phát hiện trong ruột tôm.
Ban đầu, các cấu trúc giống gregarine (được gọi là ATM – Microvilli biến đổi tổng hợp) được cho là liên quan đến EHP. Chúng xuất hiện ở nhiều nơi và thường không được chẩn đoán. Vào thời điểm đó, chưa có phương pháp PCR, nên việc chẩn đoán EHP chỉ dựa vào quan sát bằng kính hiển vi để tìm kiếm bào tử EHP trong gan tụy (HP) của tôm. Việc xác định bào tử EHP rất khó khăn, nhưng có thể thực hiện được với những người có kinh nghiệm.
Tôm nhiễm EHP thường có tốc độ tăng trưởng chậm và hệ số biến đổi (CV) cao hơn. Tuy nhiên, điều này không ảnh hưởng đến khả năng sinh tồn của chúng.
Hiện nay, việc chẩn đoán EHP bằng bào tử không phải lúc nào cũng chính xác 100%. EHP có hai giai đoạn: giai đoạn hình thành bào tử và giai đoạn bào tử. Trong giai đoạn bào tử, bào tử EHP có hình dạng tương tự như mô HP, khiến việc xác định bằng kính hiển vi trở nên khó khăn. Để chẩn đoán chính xác trong giai đoạn bào tử, cần sử dụng phương pháp PCR hoặc lai tại chỗ. Do đó, việc chẩn đoán EHP có thể gặp sai sót nếu chỉ dựa vào quan sát bào tử.
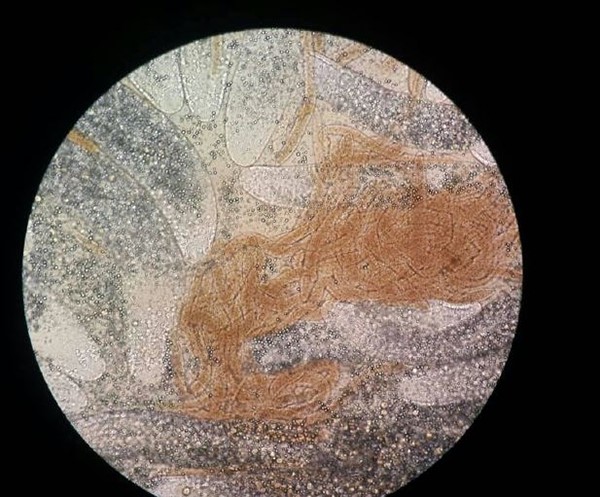
Vi nhung mao biến nạp tổng hợp (ATM) là các cấu trúc giống như grgarines thường được quan sát thấy trong gan tụy của tôm bị nhiễm bệnh.
Theo thời gian, EHP xuất hiện ở nhiều địa điểm khác nhau, bao gồm Việt Nam, Philippines, Indonesia và Ấn Độ. Con đường lây truyền chính của EHP là qua tôm, đặc biệt là tôm bố mẹ. Việc vận chuyển tôm bố mẹ không được kiểm soát và chẩn đoán EHP không chính xác đã góp phần vào sự lây lan rộng rãi của căn bệnh này.
Trước năm 2014, việc chẩn đoán EHP chỉ dựa vào kính hiển vi, dẫn đến nhiều sai sót. Phương pháp này không thể phân biệt được bào tử EHP với các tế bào ruột khác, dẫn đến kết quả dương tính giả. Năm 2014, mồi PCR EHP được phát triển bởi phòng thí nghiệm của Tiến sĩ Tim Flegel và các nhà nghiên cứu khác ở Anh. Phương pháp này dựa trên việc phát hiện thành bào tử EHP cụ thể, giúp chẩn đoán chính xác hơn và giảm thiểu kết quả dương tính giả. Trước khi có mồi PCR EHP, các thành phần thức ăn như bột nhuyễn thể và bột cá có thể dẫn đến kết quả dương tính giả.
Vì vậy, những gì đã xảy ra trong trường hợp của tôi? Chúng tôi áp dụng chương trình nhân giống hạt nhân với các biện pháp an toàn sinh học nghiêm ngặt cho đàn tôm bố mẹ. Bất kỳ con tôm nào có kết quả EHP dương tính đều bị loại bỏ. Do EHP tập trung ở gan tụy (HP), phương pháp kiểm tra không phá hủy được sử dụng là xét nghiệm phân để tìm kiếm bào tử. Phương pháp xét nghiệm phân chỉ phát hiện bào tử EHP. Do đó, nếu không có bào tử, kết quả sẽ là âm tính, dẫn đến nguy cơ âm tính giả. Mặt khác, nếu tôm bố mẹ ăn thức ăn nhiễm EHP, kết quả xét nghiệm phân có thể dương tính giả. Trước năm 2014, khi chưa hiểu rõ về EHP, chúng tôi từng nhận được báo cáo kết quả dương tính EHP từ một hệ thống nuôi tôm bố mẹ. Việc kiểm tra lại cũng cho kết quả dương tính. Do đó, chúng tôi buộc phải tiêu hủy đàn tôm bố mẹ trong hệ thống này, dẫn đến thiệt hại hơn 1 triệu USD.
Vào một lần, chúng tôi gặp trường hợp đàn tôm bố mẹ có kết quả xét nghiệm phân dương tính với EHP. Tuy nhiên, sau khi kiểm tra gan tụy (HP), kết quả lại âm tính. Việc kiểm tra thức ăn cho thấy thức ăn bị nhiễm EHP, dẫn đến kết quả dương tính giả trong xét nghiệm phân. Thức ăn nhiễm EHP có thể dẫn đến kết quả dương tính giả trong xét nghiệm phân. Một số loại bột nhuyễn thể và cá cũng có thể cho kết quả dương tính.
Để xác minh chính xác, cần thực hiện kiểm tra mô HP. Việc này giúp xác định xem EHP có thực sự hiện diện trong tôm hay chỉ do thức ăn nhiễm EHP. Để xác minh chính xác, bạn phải luôn kiểm tra gan tụy và mẫu đồng nhất của toàn bộ HP, vì nhiễm trùng có thể khu trú trong HP và không phân bổ đều trên toàn bộ HP.
Bào tử EHP phân bố không đồng đều và có thể có số lượng ít. Do đó, việc kiểm tra mô học cần được thực hiện cẩn thận với nhiều lát cắt qua HP. Việc sử dụng kỹ thuật nhuộm thông thường có thể khó nhìn thấy bào tử, đặc biệt là trong giai đoạn đầu của bệnh.
EHP là một trong những nguyên nhân chính gây ra sự tăng trưởng chậm và hệ số biến đổi (CV) cao về kích thước của tôm.
Ban đầu bệnh gây ra sự tăng trưởng chậm với sự thay đổi kích thước lớn (hoặc CV trên 25%). Tôm từ di truyền CP sẽ có tốc độ tăng trưởng trung bình tối thiểu trên 0,18 gram mỗi ngày. Bất cứ điều gì dưới 0,15 mức tăng trung bình hàng ngày (ADG) trong hầu hết các trường hợp sẽ là kết quả của nhiễm EHP. Đặc điểm xác định của EHP là sự thay đổi kích thước tương tự như những gì bạn đã thấy với Virus hoại tử cơ quan tạo máu (IHHNV) và Hội chứng còi cọc dị dạng ở tôm (RDS).
EHP có thể tấn công tôm ở các giai đoạn khác nhau trong chu kỳ sản xuất tôm. Nếu một trang trại báo cáo tăng trưởng chậm sau 30 ngày, có thể sau 30 ngày kích thước bình thường của chúng là 2,5 gram, nhưng bây giờ sau 30 ngày, kích thước tôm sẽ nhỏ hơn 1 gram – đây thường là dấu hiệu tốt cho thấy nhiễm trùng đến từ trại giống. Nếu EHP đến từ môi trường, sự tăng trưởng không bị ảnh hưởng cho đến 45 đến 50 ngày. Và nếu là từ môi trường, nhiều trang trại ở Việt Nam và nhiều nơi khác sẽ xây dựng chiến lược cố gắng vượt qua dịch bệnh để cho ra tôm cỡ cỡ có thể thu hoạch trong 70-80 ngày.
Sau đó, bằng cách sử dụng PCR thời gian thực, chúng tôi biết được rằng mức DNA EHP quyết định xem có bệnh hay không có bệnh. Ở nồng độ 101 đến 103, Tôm mang mầm bệnh EHP nhưng không có biểu hiện rõ rệt (chỉ tăng trưởng chậm), nhưng khi nồng độ tăng lên trên 103 thì tôm bắt đầu phát triển chậm hơn. Nếu đạt mức 106 đến 108, tốc độ tăng trưởng của tôm sẽ giảm đáng kể.
Đối với EHP có nguồn gốc từ trại giống và làm chậm tốc độ tăng trưởng trước 30 ngày thì không có cách nào thu được lợi nhuận kinh tế. Trong 30 ngày đầu tiên, tốc độ tăng trưởng của tôm là đầu mối tốt để xác định EHP có nguồn gốc từ trại giống hay từ môi trường ao nuôi.
Cũng phải giả định rằng nếu EHP được tìm thấy trong trại giống hoặc ao thì sự lây nhiễm sẽ vẫn tồn tại trong trại giống hoặc trong ao trừ khi các biện pháp cụ thể được thực hiện để loại bỏ các bào tử lây nhiễm khỏi trại giống và/hoặc ao.
Trại giống tôm và EHP
Khử trùng là điều cần thiết nếu nghi ngờ hoặc xác định trại giống có EHP. Tuy nhiên, việc tiêu diệt bào tử EHP rất khó khăn. Theo báo cáo, 35-40 ppm clo, thuốc tím hoặc formalin có thể khử trùng EHP trong điều kiện phòng thí nghiệm. Tuy nhiên, thực tế cho thấy các chất khử trùng này không hiệu quả cao do màng sinh học bảo vệ bào tử EHP, các yếu tố khác trong môi trường thực tế.
Trong trại giống, để khử trùng bề mặt, sử dụng dung dịch clo axit hóa (200 ppm/pH 4.0) hoặc dung dịch bazơ natri hydroxit (pH >12). Dung dịch này có thể phá vỡ màng sinh học và hòa tan bào tử EHP. Cần khử trùng toàn bộ cơ sở, bao gồm bể chứa và đường ống trong trại giống.
Nếu trại giống có EHP, Xác định nguồn lây nhiễm EHP là bước quan trọng để ngăn ngừa tái nhiễm sau khử trùng. Các nguồn lây nhiễm phổ biến như tôm bố mẹ, thức ăn cho tôm bố mẹ (thức ăn sống hoặc tươi, đặc biệt là thức ăn lọc), nguồn nước. Để kiểm tra nước, một vài lít nước có thể được lọc qua bộ lọc Whatman, sau đó có thể kiểm tra bằng PCR. Sử dụng tôm bố mẹ SPF (Specific Pathogen Free) được chứng nhận từ nguồn uy tín. Tránh sử dụng tôm bố mẹ nuôi trong ao từ vùng bị nhiễm bệnh. Thay thế thức ăn sống/tươi bằng thức ăn nhân tạo hoặc thức ăn từ nguồn sạch. Sử dụng vật liệu nuôi cấy từ nguồn sạch để sản xuất thức ăn cho tôm bố mẹ.
Quy trình kiểm soát EHP tại Thái Lan bao gồm sử dụng tôm bố mẹ SPF (Specific Pathogen Free) được chứng nhận từ cơ sở có lịch sử không nhiễm EHP, kiểm tra phân tôm bố mẹ bằng PCR để phát hiện bào tử EHP, chọn cơ sở cung cấp tôm bố mẹ có uy tín và có lịch sử lâu đời trong việc cung cấp tôm sạch bệnh.
Sau khi có tôm bố mẹ sạch sẽ chúng tôi đưa vào trại giống sạch. Theo dõi chất lượng nước mỗi tháng một lần hoặc mỗi tuần một lần, tùy thuộc vào lịch sử của trại giống, đảm bảo nguồn nước sạch và không bị nhiễm EHP. Tránh sử dụng thức ăn sống có nguy cơ cao như giun nhiều tơ sống, artemia sống hoặc sinh khối artemia được sản xuất trong vùng EHP.
Lựa chọn tốt nhất của bạn là nuôi cấy SPF hoặc polychaetes không chứa mầm bệnh đã được chứng nhận. Hoặc nấu polychaetes ở nhiệt độ 75-80°C để tiêu diệt bào tử EHP. Sử dụng thức ăn SPF hoặc polychaetes không chứa mầm bệnh đã được chứng nhận. Tránh sử dụng các loài hai mảnh vỏ (hàu, trai, trai) vì chúng có thể mang bào tử EHP.Polychaetes ăn trong trầm tích, có thể mang bào tử EHP vào ruột. Đó là tất cả các cách lây nhiễm EHP cho tôm bố mẹ.
Việc kiểm soát EHP hiệu quả trong trại giống đòi hỏi sự kết hợp nhiều biện pháp. Cẩn thận trong việc lựa chọn thức ăn, khử trùng trại giống và sử dụng nguồn nước sạch là những yếu tố thiết yếu để duy trì môi trường không EHP. Tuy nhiên, ở những khu vực có tỷ lệ EHP cao như một số trại giống ở Ấn Độ, Việt Nam hoặc Thái Lan, việc kiểm soát EHP trở nên khó khăn hơn do sự kết hợp mật thiết giữa trại giống và trang trại, dẫn đến nguy cơ EHP xâm nhập vào môi trường nước.
Việc khử trùng nước trại giống là cần thiết để loại bỏ EHP. Tuy nhiên, quá trình này gặp nhiều thách thức do sự tồn tại của màng sinh học và các yếu tố khác. Mặc dù các phương pháp khử trùng bằng hóa chất như sử dụng clo 40 ppm được áp dụng, nhưng hiệu quả thực tế còn hạn chế. Lọc vật lý bằng thiết bị siêu lọc có khả năng loại bỏ các hạt 2 micron ra khỏi nước là phương pháp hiệu quả nhất để giảm thiểu nguy cơ lây nhiễm EHP từ nguồn nước. Việc duy trì và bảo dưỡng hệ thống lọc sau khi cài đặt là yếu tố then chốt để đảm bảo hiệu quả lâu dài.

Các trại giống tôm chỉ nên sử dụng polychaetes được chứng nhận sạch bệnh trong khẩu phần ăn của tôm bố mẹ do nguy cơ lây nhiễm EHP cũng như các mầm bệnh khác. Ảnh của Alexander Semenov, qua Wikimedia Commons.
Điều kiện để sản xuất tôm giống không EHP là lọc nước hiệu quả, sử dụng tôm bố mẹ, thức ăn và nước sạch, áp dụng biện pháp ngăn chặn bào tử EHP xâm nhập vào cơ sở, thực hiện các chương trình giám sát thường xuyên bằng cách kiểm tra ấu trùng định kỳ.
Bây giờ, một vấn đề khác khi bạn kiểm tra PL – EHP có thể ở mức độ thấp và khó phát hiện bằng phương pháp thông thường. Vì vậy, Việc vận chuyển PL trong 24-28 giờ có thể kích thích EHP phát triển và dễ dàng phát hiện bằng PCR. Nếu kết quả xét nghiệm âm tính, cho thấy động vật sạch và không mang EHP.
Vì vậy, khoảng 11 hoặc 12 năm trước, chúng tôi bắt đầu quan sát dưới kính hiển vi cái mà chúng tôi gọi là vi nhung mao biến đổi tổng hợp (ATM), ruột bong tróc. ATM là dấu hiệu của việc lây nhiễm EHP, và liên quan đến việc giải phóng một số lượng lớn bào tử và làm bong tróc các mô HP.

Tiến sĩ McIntosh quan sát thấy có mối liên quan rõ ràng giữa EHP và bệnh phân trắng (WFD), một bệnh nghiêm trọng khác ở tôm nuôi. Bên trái: gan tụy bị cắt bỏ của tôm bị nhiễm WFD. Bên phải: những sợi phân màu trắng đặc trưng của bệnh WFD ở rìa ao nuôi tôm.
Phân trắng xuất hiện từ đầu những năm 2000 trong quá trình nuôi tôm sú (P. monodon) và trở thành vấn đề nghiêm trọng từ năm 2014 và ngày càng gia tăng. Phân trắng luôn bị nhiễm EHP. Và khi xuất hiện phân trắng, gây ảnh hưởng tiêu cực đến khả năng sống sót của tôm. Và câu hỏi đặt ra là nguyên nhân gây ra phân trắng. Chúng tôi biết EHP là tác nhân cần thiết, nhưng còn gì nữa?
Các yếu tố góp phần gây ra phân trắng là đáy ao bẩn và ao có lớp lót nhựa vỡ, tạo điều kiện kỵ khí và sử dụng lớp lót mỏng để tiết kiệm chi phí. Những ao này có nhiều khả năng tìm thấy phân trắng có EHP nhất. Và nếu nông dân xử lý những ao này bằng vi khuẩn quang hợp thì tình trạng phân trắng có thể giảm bớt hoặc thậm chí đảo ngược tình trạng phân trắng.
Vì vậy, để tìm nguyên nhân gây ra phân trắng, tôi bắt đầu tập trung vào vi khuẩn kỵ khí. Vì vậy, phòng thí nghiệm thu thập và nuôi cấy vi khuẩn kỵ khí từ môi trường ao nuôi có tôm bị phân trắng. Nuôi cấy vi khuẩn kỵ khí trong môi trường kỵ khí và phân lập các chủng vi khuẩn. Thêm các chủng vi khuẩn vào tôm có và không có EHP để quan sát tác động. Một số chủng vi khuẩn kỵ khí, đặc biệt là Propionigenium, khi kết hợp với EHP, có thể gây ra phân trắng ở tôm. Vi khuẩn Vibrio cũng được báo cáo có khả năng tương tự, nhưng chỉ khi có EHP.
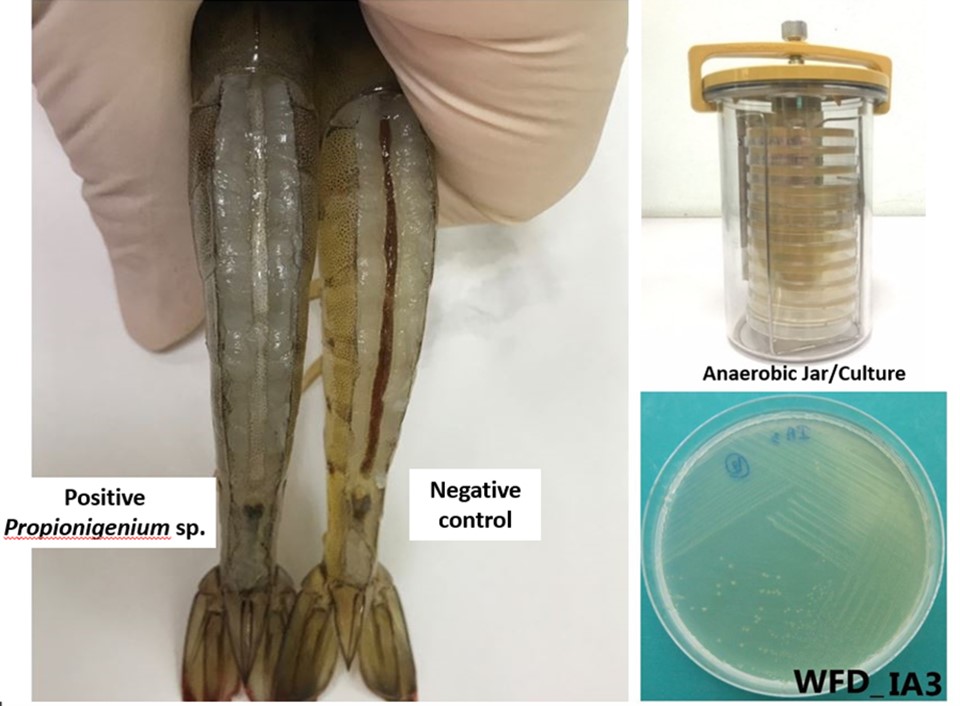
Tiến sĩ Kallaya từ Đại học Mahidol (Thái Lan) đã thực hiện phân tích metagenomic trên phân trắng và phát hiện ra Propionigenium là vi khuẩn phổ biến nhất. Propionigenium là vi khuẩn kỵ khí, thường phát triển trong môi trường ao nuôi bẩn, thức ăn dư thừa. Khi Propionigenium xâm nhập vào tôm bị nhiễm EHP, nó sẽ làm tăng tác động của EHP, dẫn đến bệnh phân trắng – một dạng EHP nghiêm trọng hơn. Giải pháp ở đây là đảm bảo tôm bố mẹ không mang Propionigenium để ngăn chặn việc truyền sang tôm giống và thực hiện kiểm tra Propionigenium tại trại giống để đảm bảo không lây lan vi khuẩn này.
EHP ở mức độ thấp được tìm thấy ở nhiều nước nuôi tôm Châu Mỹ, nhưng không gây ra triệu chứng bệnh rõ ràng. Ở Châu Á, EHP thường có liên quan đến bệnh phân trắng và ảnh hưởng nghiêm trọng đến hoạt động nuôi tôm. EHP từ Guatemala (Châu Mỹ) được phân tích trình tự và so sánh với EHP Châu Á, cho thấy sự tương đồng về gen. Điều này cho thấy EHP ở Châu Mỹ và Châu Á có thể là cùng một loại vi sinh vật..
Bây giờ tại sao nó lại gây bệnh lớn ở châu Á mà không phải ở châu Mỹ? Mật độ thả giống và mức độ căng thẳng có thể là nguyên nhân chính cho sự khác biệt về triệu chứng bệnh giữa EHP ở Châu Mỹ và Châu Á. Nuôi tôm thâm canh với mật độ cao ở Guatemala (Châu Mỹ) dẫn đến EHP gây bệnh giống như ở Châu Á. Vì vậy, hãy nhìn vào trường hợp của Guatemala, một quốc gia nuôi tôm “thâm canh” ở châu Mỹ và nước này gặp phải các vấn đề nghiêm trọng về EHP, giống như châu Á.
Mật độ thả giống thấp và hệ thống nuôi bán thâm canh ở một số khu vực Châu Mỹ có thể dẫn đến EHP tiềm ẩn, không biểu hiện triệu chứng rõ ràng. Nếu chúng ta đưa những con vật đó vào hệ thống nuôi mật độ cao, kết quả sẽ là bệnh EHP châu Á. Do đó, căng thẳng do mật độ thả giống cao đóng vai trò quan trọng trong việc kích hoạt EHP gây bệnh.
Chúng ta hãy quay trở lại một câu chuyện về 2 trang trại tôm. Vào năm 2016, EHP đang tạo ra nhiều vấn đề ở Thái Lan. Tôi sắp đi xem một trang trại có vấn đề về EHP. Tôi đang ăn sáng và đang đi thăm một trang trại lân cận trên cùng con lạch thủy triều. Họ đang làm rất tốt, họ rất thành công, trong khi một trang trại khác rất gần đó lại là một thảm họa. Trang trại đầu tiên nuôi tôm mật độ cao, sử dụng sục khí để duy trì >6ppm, tôm khỏe mạnh, tuy có EHP (microsporidian) nhưng không có bệnh. Trang trại thứ hai cũng nuôi tôm mật độ cao nhưng DO< 5 ppm, tôm bị EHP nặng. Vì vậy, nếu có mức oxy thấp hơn, EHP có xu hướng chiếm ưu thế do áp lực DO thấp hơn.
Mức oxy hòa tan thấp có thể làm tăng mức độ căng thẳng cho tôm, tạo điều kiện cho EHP phát triển mạnh. Mật độ thả giống cao và tỷ lệ thức ăn cao cũng góp phần làm tăng mức độ căng thẳng và EHP.
Nếu chúng tôi muốn tạo ra phản ứng EHP nhanh trong phòng thí nghiệm, chúng tôi thực hiện các thử nghiệm EHP. Thí nghiệm này giúp nhà sản xuất tôm bố mẹ đánh giá khả năng dung nạp EHP của tôm. EHP là một thách thức đối với khả năng dung nạp vì cần thời gian dài để đánh giá.
Làm thế nào để bạn kiểm soát mức độ lây nhiễm và các yếu tố khác? Nó đã rất khó khăn. Và câu hỏi còn lại là liệu có khả năng chịu đựng được EHP không? Giải pháp tốt hơn là nên tập trung vào quản lý EHP thay vì giải pháp di truyền.
Bây giờ chúng ta có thể xem xét loại trừ. Xem xét nó có tồn tại trong môi trường như ở các quốc gia này hay không, vì vậy khi EHP xâm nhập vào một khu vực, nó sẽ bắt đầu ở mức thấp. Mức độ nghiêm trọng của EHP tăng lên theo thời gian do lây lan từ trang trại này sang trang trại khác, bào tử EHP tích tụ trong môi trường.
Giảm mật độ thả giống và kiểm soát EHP trong ao bằng cách hợp tác giữa các nhà sản xuất để giảm mật độ thả giống và đảm bảo không có EHP trong ao nuôi và yêu cầu các trại giống nhiễm EHP đóng cửa để ngăn chặn sự lây lan của mầm bệnh.
Nitrit là một yếu tố gây căng thẳng lớn cho tôm và có thể làm tăng tỷ lệ lây nhiễm EHP. Các yếu tố gây căng thẳng khác như lượng oxy thấp, biến động pH, sunfua và axit hữu cơ cũng có thể tạo điều kiện cho EHP phát triển.
Theo Darryl E. Jory
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Công Nghệ Sản Xuất Tôm Sú Penaeus monodon Với Mật Độ Thả Khác Nhau Bằng Hệ Thống Tuần Hoàn
- Đánh giá: Ứng dụng chế phẩm sinh học trong nuôi trồng thủy sản
- Ảnh Hưởng Của Vỏ Chanh Lên Men Như Một Chất Phụ Gia Thức Ăn Chức Năng Lên Sự Tăng Trưởng, Đáp Ứng Miễn Dịch Không Đặc Hiệu Và Khả Năng Kháng Vibrio alginolyticus Ở Tôm Chân Trắng Litopenaeus vannamei

 English
English