Kỹ Thuật Nuôi, Tin tức
Nuôi Đa Dưỡng Tích Hợp Tôm Thẻ Chân Trắng Litopenaeus vannamei Và Cá Rô Phi Oreochromis niloticus Trong Hệ Thống Biofloc: Nghiên Cứu Quy Mô Thí Điểm
Nuôi tôm trong hệ thống biofloc tạo ra lượng chất hữu cơ dư thừa cần được loại bỏ. Do khả năng tiêu thụ năng suất tự nhiên, việc nuôi tích hợp cá rô phi với nuôi tôm có thể giúp giảm tổng lượng chất rắn lơ lửng trong hệ thống biofloc. Nghiên cứu này đánh giá hai mật độ thả cá rô phi trong nuôi kết hợp với tôm Litopenaeus vannamei trong hệ thống biofloc quy mô thí điểm. Hai mật độ thả cá rô phi được thử nghiệm là 35 và 65 con/ m3 trong hệ thống tuần hoàn với bể 10 m3 để nuôi tôm và 4 m3 để nuôi cá rô phi với tốc độ tuần hoàn nước là 965,66±92,83 L/ giờ trong suốt 78 ngày. Trọng lượng ban đầu của tôm là 0,9±0,1 g và cá rô phi là 7,1±3,2 g. Tôm được cho ăn theo bảng cho ăn và cá được cho ăn thiếu dinh dưỡng để kích thích tiêu thụ bioflocs. Các thông số chất lượng nước được lựa chọn đã được theo dõi trong quá trình thử nghiệm. Mật độ cá rô phi không ảnh hưởng đến tăng trưởng của tôm (11,5±1,9 g và 10,1±0,7 g lần lượt đối với nghiệm thức 35 và 65 con/ m3). Cá rô phi có FCR < 1, cho thấy bioflocs đã được cá tiêu thụ. Thời gian làm sạch ở nuôi tôm độc canh ngắn hơn so với các nghiên cứu khá. Giữa các nghiệm thức, thời gian làm sạch hệ thống giảm đi 10 giờ khi sử dụng mật độ thả cá thấp hơn. Kết quả chứng minh tính khả thi của nuôi tôm và cá rô phi kết hợp ở quy mô thí điểm mà không ảnh hưởng đến năng suất tôm.
1. Giới thiệu
Nuôi trồng thủy sản siêu thâm canh tạo ra lượng nước thải có hàm lượng chất hữu cơ cao. Việc cho ăn trong môi trường thâm canh đơn loài làm tăng lượng nước thải có khả năng gây ô nhiễm cao, với nồng độ nitơ và phốt pho cao (Briggs và Funge-Smith, 1994). Những vấn đề này đã gây lo ngại ở nhiều quốc gia do hoạt động này có thể tác động đến môi trường (Boyd và cộng sự, 2020).
Nuôi trồng thủy sản đa loài tích hợp (IMTA) nhằm mục đích tích hợp các loài có bậc dinh dưỡng khác nhau trong hệ thống nuôi, nhằm tận dụng dư lượng từ việc sản xuất một loài để nuôi các loài khác (Troell và cộng sự, 2009). Ngay cả những sinh vật cùng bậc dinh dưỡng trong hệ thống cũng có thể được tạo ra tại IMTA nếu chúng sử dụng các lưới thức ăn khác nhau trong hệ thống đó (Boyd và cộng sự, 2020). Sự đa dạng này trong sự kết hợp giữa các loài chiết xuất hữu cơ và vô cơ mang lại lợi thế cho IMTA về giảm thiểu sinh học và lợi ích kinh tế, do đó bền vững hơn khi so sánh với độc canh (Biswas và cộng sự, 2020).
Hệ thống biofloc là một công nghệ nuôi tôm mới, hướng đi mới bền vũng hơn so với nuôi tôm độc canh. Do duy trì chất lượng nước tốt hơn, hệ thống này có thể giảm lượng nước sử dụng tới 90% so với các hệ thống truyền thống (Krummenauer và cộng sự, 2014), cho phép nuôi ở mật độ thả cao (Wasielesky và cộng sự, 2013), giảm sử dụng đất (Liu và cộng sự, 2017) và tối ưu hóa việc sử dụng thức ăn nhân tạo (Santhana Kumar và cộng sự, 2018). Điều này có thể thực hiện được thông qua việc tăng tỷ lệ C:N trong nước, với việc sử dụng nguồn carbon hữu cơ và sục khí liên tục, kích thích sản xuất các vi sinh vật vừa có tác dụng chuyển hóa các hợp chất nitơ vừa làm thức ăn tự nhiên cho động vật được nuôi (Krummenauer và cộng sự, 2011; Lara và cộng sự, 2017; Khanjani và cộng sự, 2023).
Sản xuất tôm trong hệ thống biofloc mang lại nhiều lợi ích kinh tế (Rego và cộng sự, 2017). Tuy nhiên, vẫn còn những hạn chế về môi trường như sự tích tụ chất hữu cơ trong quá trình sản xuất trong một hệ thống có lượng trao đổi nước tối thiểu và mật độ cao. Sự tích tụ này tạo ra sự dư thừa chất rắn lơ lửng, làm tăng nhu cầu oxy sinh học do nồng độ vi sinh vật hiếu khí có trong biofloc cao (Ray và cộng sự, 2010). Do đó, nên loại bỏ tổng chất rắn lơ lửng (TSS) dư thừa trong hệ thống biofloc thông qua quá trình lọc (Gaona và cộng sự, 2017).
Quá trình lắng (loại bỏ các hạt bioflocs dư thừa bằng trọng lực) loại bỏ hiệu quả các chất rắn dư thừa lơ lửng trong hệ thống biofloc (Gaona và cộng sự, 2016) thường bị loại bỏ dưới dạng nước thải. Do đó, lý do cơ bản để tích hợp các loài vào hệ thống biofloc là tận dụng lượng protein vi sinh dư thừa dưới dạng chất rắn lơ lửng để nuôi các loài khác và từ đó chuyển hóa nước thải thành protein động vật, làm cho hệ thống trở nên bền vững hơn.
Cá rô phi (Oreochromis niloticus) có một số đặc điểm khiến nó trở thành loài lý tưởng để nuôi trong hệ thống IMTA dựa trên hệ thống biofloc (Azim và Little, 2008; Monroy-Dosta và cộng sự, 2013; Poli và cộng sự, 2019). Loài này có khả năng chịu đựng chất rắn lơ lửng cao, lượng oxy hòa tan vừa phải và mật độ thả nuôi cao (Azim và Little, 2008; Simão và cộng sự, 2013; Malpartida Pasco và cộng sự, 2018; Khanjani và Sharifinia, 2021). Ngoài ra, nó là loài ăn tạp, có cấu trúc lọc và hệ thống tiêu hóa cho phép nó trở thành một chất chiết xuất hữu cơ có tiềm năng, cung cấp năng lượng tự nhiên của hệ thống biofloc và loại bỏ lượng dư thừa của tổng chất rắn lơ lửng. Nó có thể được sử dụng làm tác nhân xử lý sinh học trong các hệ thống IMTA (Azim và cộng sự, 2003; Ekasari và cộng sự, 2014; Poli và cộng sự, 2019).
Việc mở rộng thương mại của IMTA gặp nhiều rắc rối. Mặc dù những lợi ích về mặt sinh học và môi trường của phương pháp này thường được người sản xuất và xã hội chấp nhận nhưng một số vấn đề liên quan đến kinh tế vẫn chưa được khắc phục để áp dụng phương pháp này (Ridler và cộng sự, 2007). Do đó, các nghiên cứu quy mô thí điểm nhằm mục đích tích hợp sản xuất siêu thâm canh tôm thẻ chân trắng (Litopenaeus vannamei) và cá rô phi sông Nile trong hệ thống biofloc là vô cùng cần thiết để phát triển các mô hình nuôi đa dưỡng tích hợp quy mô lớn.
Một số nghiên cứu đã báo cáo về nuôi kết hợp tôm và cá rô phi, mặc dù ở mật độ sản xuất thấp và trong hệ thống nước sạch (Tendencia và cộng sự, 2004; Tendencia và cộng sự, 2006; Muangkeow và cộng sự, 2007; Cruz và cộng sự, 2008; Yuan và cộng sự, 2010; Muangkeow và cộng sự, 2011; Simão và cộng sự, 2013). Gần đây hơn, Poli và cộng sự (2019) đã nghiên cứu nuôi kết hợp tôm và cá rô phi ở quy mô thử nghiệm và nghiên cứu này thể hiện bước đầu tiên hướng tới IMTA trong tương lai sử dụng công nghệ biofloc. Tuy nhiên, cho đến nay, chưa có nghiên cứu nào về sản xuất tôm và cá rô phi siêu thâm canh tích hợp trong hệ thống BFT ở quy mô thí điểm. Mục tiêu của nghiên cứu này là đánh giá hiệu quả của các mật độ thả cá khác nhau trong nuôi siêu thâm canh tổng hợp tôm thẻ chân trắng L. vannamei và cá rô phi Nile O. niloticus được nuôi trong hệ thống biofloc nhằm thúc đẩy duy trì TSS ở mức thích hợp cho nuôi tôm bằng cách cho cá tiêu thụ lượng bioflocs dư thừa.
2. Vật liệu và phương pháp
2.1. Thiết kế thí nghiệm
Thí nghiệm kéo dài 78 ngày và được thực hiện theo hai nghiệm thức với ba lần lặp lại: 1/ T35 – nuôi kết hợp tôm (550 con/ m3) và cá rô phi ở mật độ thả 35 con/ m3; và 2/ T65 – nuôi tôm kết hợp (550 con/ m3) và cá rô phi với mật độ thả 65 con/ m3.
2.2. Điều kiện nuôi cấy
Nghiên cứu được thực hiện tại Trạm Nuôi trồng Thủy sản Hàng hải, Đại học Liên bang Rio Grande (EMA-FURG), Nam Brazil (32°12’16S, 52°10’38W) trong nhà kính được sử dụng cho nghiên cứu IMTA.
Nauplii của L. vannamei được mua từ công ty Aquatec (Aquatec®, Canguaretama; Rio Grande do Norte, Brazil), và quá trình phát triển ấu trùng được thực hiện trong phòng thí nghiệm Carcinoculture tại EMA-FURG. Cá được mua từ một trang trại thương mại ở đô thị Camaquã, Rio Grande do Sul, Brazil.
Nước biển trước đây được pha loãng trong nước ngọt do công ty cung cấp địa phương cung cấp đã được sử dụng để tạo thành nước có độ mặn 15 g/ L. Độ mặn được giữ ở mức 15 bằng nước ngọt đã được khử trùng bằng clo và được trung hòa bằng vitamin C (Roselet và cộng sự, 2013). Thí nghiệm này đã được phê duyệt bởi Ủy ban Đạo đức và Phúc lợi Động vật của Đại học Liên bang Rio Grande – FURG (Số trường hợp 23116.005895/2016-42).
Trước khi thí nghiệm bắt đầu, chất cấy chiếm 20% tổng thể tích bể nuôi tôm, với biofloc trưởng thành (với quá trình nitrat hóa hoàn toàn, không phát hiện amoniac và nitrit, cũng như phát hiện nitrat), đã được sử dụng trong tất cả các nghiệm thức. Chất cấy được lấy từ quá trình nuôi cấy L. vannamei trong 60 ngày với mật độ 400 m3 trong các bể 35 m3 đặt trong nhà kính. Mật mía, chứa 37% carbon hữu cơ, được sử dụng làm nguồn carbon trong giai đoạn canh tác ban đầu để kiểm soát amoniac. Nồng độ ban đầu của chất cấy là TSS ± 400 mg/ L và ± 65 mg/ L nitrat, cho thấy quá trình nitrat hóa đang diễn ra trong bể ma trận này. Việc bón phân hữu cơ được thực hiện bằng cách điều chỉnh tỷ lệ C:N thành 15:1 (Ebeling và cộng sự, 2006; Khanjani và Sharifinia, 2022).
Trong quá trình nghiên cứu, tôm được cho ăn hai lần một ngày (9 giờ sáng và 5 giờ chiều) bằng thức ăn thương mại dành riêng cho loài, chứa 38% protein thô (Poty Active 38, 1.6 mm, Guabi®, Campinas, SP, Brazil), theo phương pháp luận được mô tả bởi Jory và cộng sự (2001). Cá được cho ăn 2 lần/ngày (9 giờ sáng và 5 giờ chiều) bằng thức ăn công nghiệp Guabitech Mirim QS (1,0 mm) khi bắt đầu thí nghiệm, điều chỉnh thức ăn cho cá ăn tạp Guabitech QS (2-3 mm/5-5 mm), trong suốt thời gian thí nghiệm. giai đoạn thử nghiệm khi cá lớn lên. Cá được cho ăn thiếu chất để kích thích tiêu thụ bioflocs. Trong nửa đầu của thí nghiệm, thức ăn được cung cấp với tỷ lệ 2% tổng sinh khối cá trong mỗi bể. Giá trị này đã được điều chỉnh trong nửa sau của thử nghiệm, khi thức ăn được cung cấp với tỷ lệ 1%. Tôm được thả vào bể thí nghiệm với trọng lượng ban đầu là 0,96 ± 0,1g. Cá rô phi có khối lượng ban đầu 7,17 ± 3,15g trước đây được làm quen với độ mặn của thí nghiệm và sau đó được bảo quản trong các bể thí nghiệm.
2.3. Hệ thống nuôi
Hệ thống tuần hoàn biofloc-IMTA bao gồm một bể hình tròn có thể tích 10 m3 để bảo quản tôm và một bể tương tự khác có thể tích hữu ích 4 m³ được thả cá rô phi. Nước được bơm từ bể nuôi tôm sang bể nuôi cá rô phi qua ống PVC (đường kính 40mm) sử dụng máy bơm chìm (SB 2700, tốt hơn Sarlo, Brazil) và quay trở lại bể nuôi tôm bằng trọng lực, qua ống (40mm) lắp đặt 20 cm từ bề mặt của bể. Hệ thống tuần hoàn hoạt động trong 24 giờ, lưu lượng trung bình 965,6 ± 92,8 L/ giờ. Sục khí được cung cấp bởi một máy thổi 4HP được kết nối với hệ thống phân phối không khí bằng các ống có lỗ siêu nhỏ. Mỗi hệ thống tuần hoàn chứa một bể lắng hình trụ hình nón làm bằng sợi thủy tinh với thể tích hữu ích là 150L. Một tấm vải che nắng được lắp đặt trên trần nhà kính để giảm 70% độ sáng nhằm tránh thực vật phù du nở hoa và tạo điều kiện cho tính chất dị dưỡng của hệ thống.
2.4. Giám sát chất lượng nước
Nhiệt độ (°C) và oxy hòa tan (mg/ L) trong bể được theo dõi hai lần một ngày bằng máy đo oxy kỹ thuật số (model HI 9146-04, dụng cụ Hanna®), độ pH được đo hàng ngày bằng máy đo pH để bàn (Mettler Toledo, mô hình Năm-Dễ dàng). Độ mặn được kiểm tra hàng tuần bằng khúc xạ kế quang học (Atago).
Tổng amoniac (UNESCO, 1983) và nitrit (Bendschneider và Robinson, 1952) được theo dõi hàng ngày. Nitrat (UNESCO, 1983), phốt phát (Strickland và Parsons, 1972), độ kiềm (APHA, 2017) và tổng chất rắn lơ lửng (Strickland và Parsons, 1972) được đo hàng tuần.
Tổng chất rắn lơ lửng (TSS) được giữ ở mức 500 mg/ L theo (Gaona và cộng sự, 2017). Khi giá trị TSS vượt quá giới hạn này, quá trình làm sạch vật lý được thực hiện trong hệ thống bằng cách loại bỏ chất rắn lơ lửng trong tất cả các nghiệm thức (Gaona và cộng sự, 2011). Việc điều chỉnh độ pH được thực hiện để giữ giá trị trên 7,2 bằng cách bổ sung vôi ngậm nước – Ca (OH)2 – theo (Furtado và cộng sự, 2011). Độ kiềm được điều chỉnh để duy trì nồng độ trên 150 mg/ L, theo cùng một quy trình.
2.5. Hiệu suất tăng trưởng
Sự tăng trưởng của tôm (n = 40) và cá (n = 20) được theo dõi tương ứng thông qua sinh trắc học hàng tuần và 2 tuần/ lần, sử dụng cân kỹ thuật số có độ chính xác 0,01g (Mars – Model AD 2000). Thuốc gây mê được sử dụng để thao tác cá trong quá trình cân (benzocain hydrochloride, 50 mg/L). Kết thúc thí nghiệm, tất cả tôm, cá còn lại trong bể đều được đếm để xác định tỷ lệ sống và tăng trưởng. Các thông số được phân tích là: Tỷ lệ sống (%) = (số tôm cuối cùng/số tôm ban đầu) × 100; Khối lượng trung bình cuối cùng (g): khối lượng cuối cùng của con vật sống (g)/tổng số con; Tổng sinh khối (g): trọng lượng cuối cùng của tất cả động vật sống (g); Tốc độ tăng trưởng hàng tuần (g/ tuần): tăng cân (g)/số tuần; Tỷ lệ chuyển đổi thức ăn (FCR) = thức ăn được cung cấp (g)/(sinh khối cuối cùng (g) – sinh khối ban đầu (g)); Năng suất (kg/ m3): [(sinh khối cuối cùng (kg) – sinh khối ban đầu (kg)) x 1000]/thể tích bể hữu ích (L).
Các thông số được phân tích cho toàn bộ hệ thống IMTA (tôm+cá) là: năng suất hệ thống (Kg/ m3): (FBs + FBf) – (IBs + IBf)/Tổng khối lượng hữu ích (m³), trong đó FBs = tôm cuối cùng sinh khối; FBf = sinh khối cá cuối cùng; IBs = Sinh khối ban đầu của tôm; IBf = Sinh khối ban đầu của cá và Tổng thể tích hữu ích = tổng thể tích hữu ích của bể nuôi tôm và cá; FCR: (Fs + Ff)/(FBs + FBf) – (IBs – IBf), trong đó Fs = thức ăn cho tôm và Ff = thức ăn cho cá.
2.6. Phân tích thống kê
Sau khi xác minh tính quy phạm và tính đồng nhất của dữ liệu, các thông số về chất lượng nước và hiệu suất tăng trưởng đã được đưa vào thử nghiệm t để so sánh các phương tiện. Dữ liệu sinh tồn được chuyển đổi (arcsine x0.5) trước khi phân tích (Zar, 2010).
3. Kết quả
3.1. Chất lượng nước
Các thông số chất lượng nước chính được đăng ký trong nghiên cứu này được trình bày trong Bảng 1. Nhiệt độ trung bình được duy trì trên 28°C, oxy hòa tan trên 6,0 mg/ L và độ pH trên 7,5 và không có sự khác biệt đáng kể giữa các phương pháp điều trị (p > 0,05). Độ kiềm (Hình 1) cho thấy giá trị trung bình (p<0,05) cao hơn đáng kể (143,6 ± 35,2 mg / L của CaCO3) ở nghiệm thức T35 so với nghiệm thức T65 (134,9 ± 33,2 mg/ L CaCO3). Giá trị độ mặn dao động trong khoảng từ 13 đến 15 trong suốt thí nghiệm, tuy nhiên, sự khác biệt giữa các nghiệm thức là không đáng kể (p > 0,05).
Bảng 1. Các thông số chất lượng nước ở các nghiệm thức T35 (540 tôm/ m3 + 35 cá/ m3) và T65 (540 tôm/ m3 + 65 cá/ m3) trong suốt thời gian thử nghiệm (giá trị trung bình ± độ lệch chuẩn).
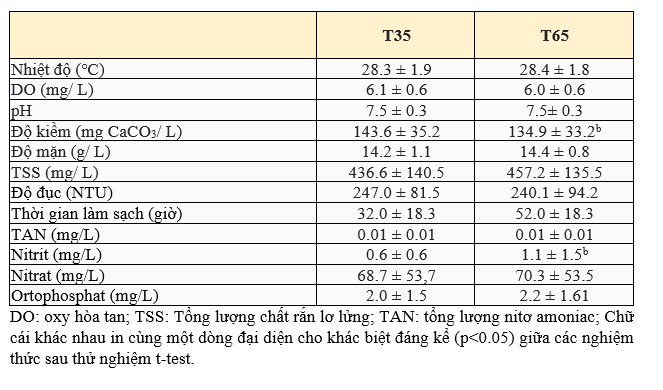
Hình 1. Nồng độ kiềm trung bình (mg/ L CaCO3) ở nghiệm thức T35 và T65 trong thời gian thử nghiệm 78 ngày. Dữ liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn.
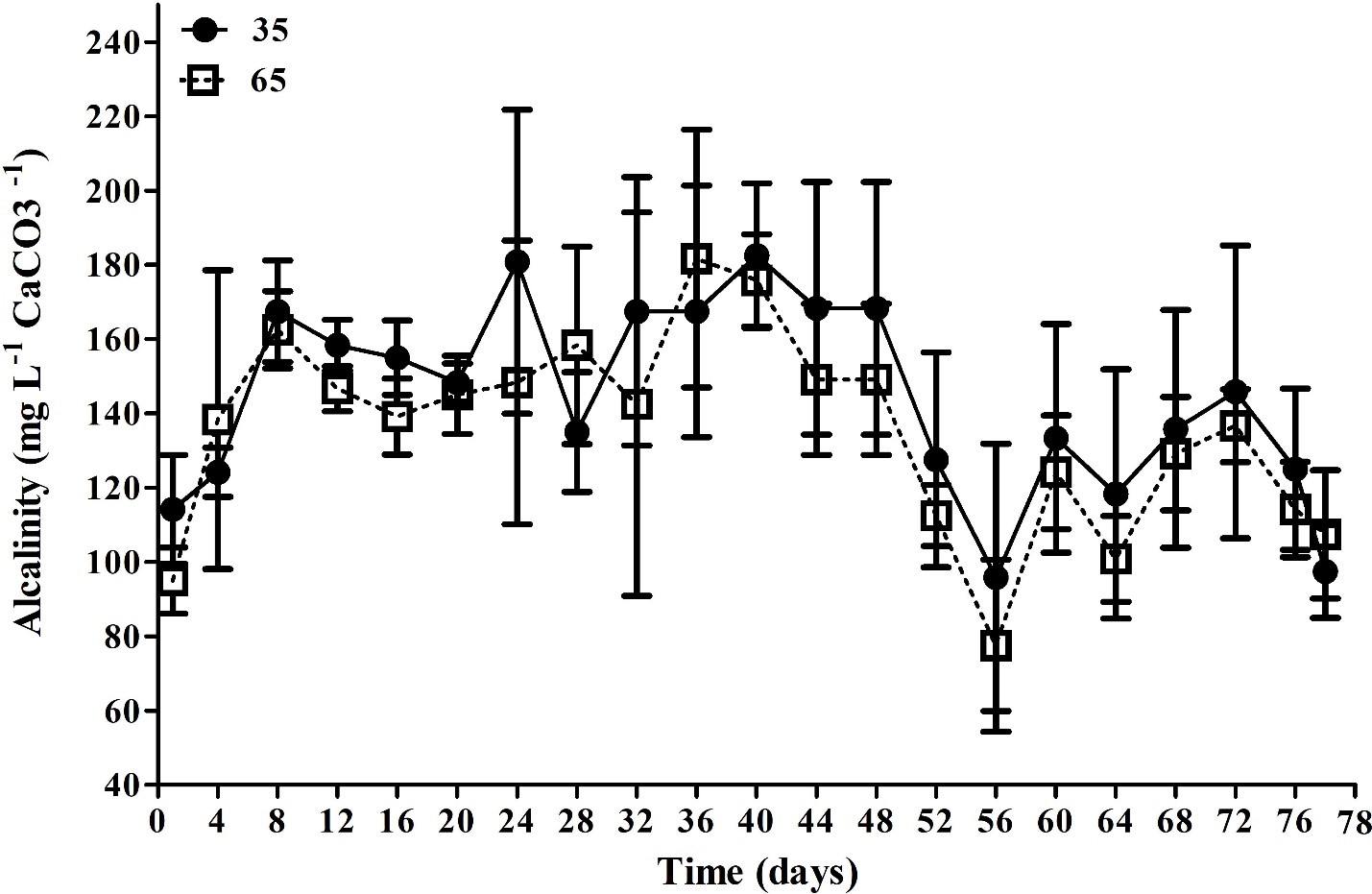
Nồng độ tổng nitơ amoniac, nitrat và orthophosphate (Hình 2) không cho thấy sự khác biệt đáng kể (p > 0,05) giữa các nghiệm thức. Mặt khác, giá trị trung bình của nitrit cao hơn đáng kể (p < 0,05) ở nghiệm thức T65 (1,1 ± 1,5 mg/ L) so với nghiệm thức T35 (0,6 ± 0,6 mg/ L).
Hình 2. Nồng độ trung bình của amoniac, nitrit, nitrat và photphat (mg/ L) trong thời gian thử nghiệm 78 ngày ở nghiệm thức T35 và T65. Dữ liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn.
3.2. Động lực học TSS
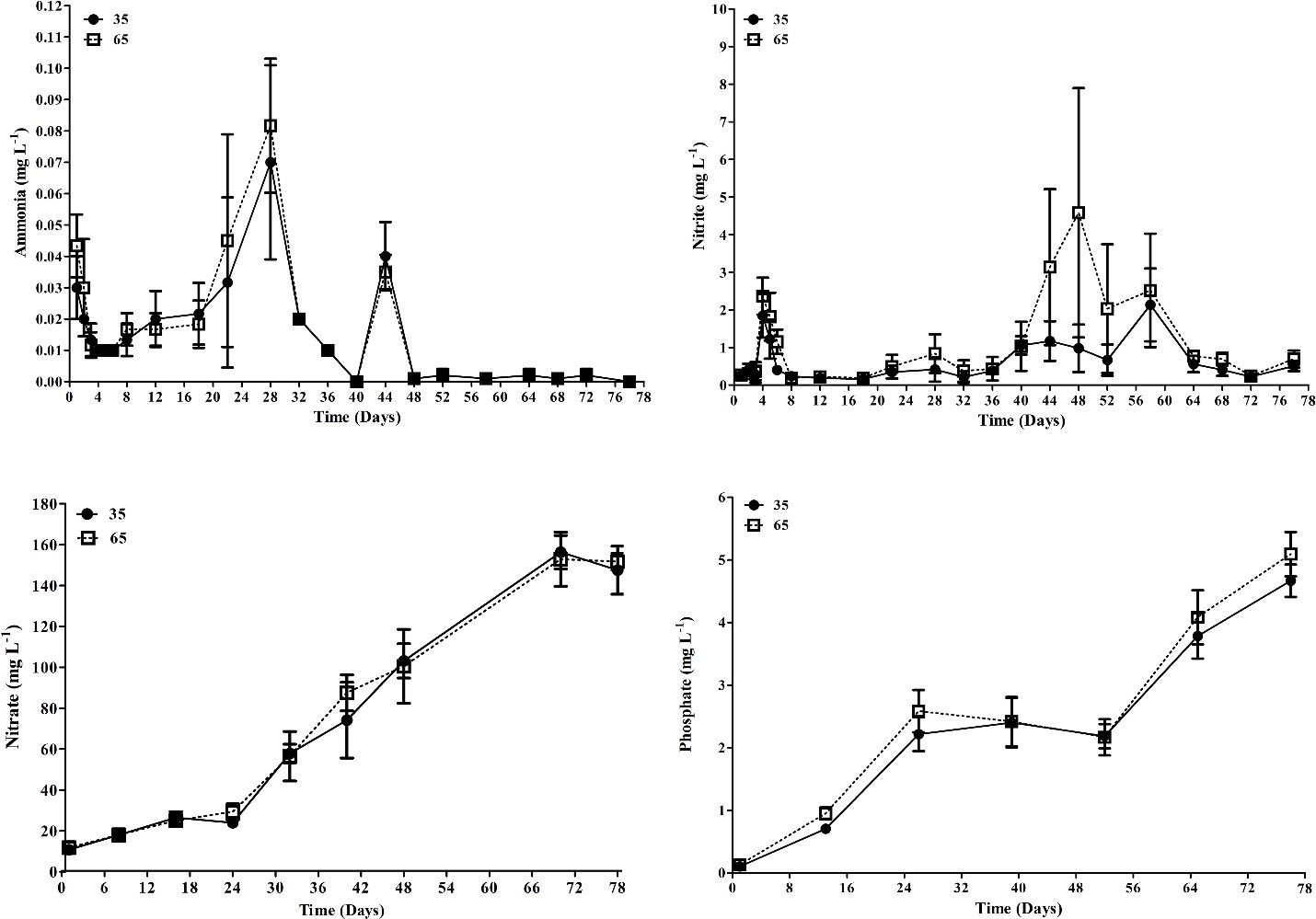
Nồng độ TSS và độ đục (Hình 3) không cho thấy sự khác biệt thống kê (p > 0,05) giữa các nghiệm thức. Việc quản lý tổng chất rắn lơ lửng (làm sạch) là cần thiết trong cả hai nghiệm thức để duy trì giá trị TSS gần 500 mg/ L. Việc làm sạch được thực hiện trong thời gian 52 ± 18,3 giờ ở T65 và trong 32 ± 18,3 giờ ở T35, trong suốt thời gian thử nghiệm (Bảng 1).
Hình 3. Nồng độ TSS (tổng chất rắn lơ lửng) trung bình (mg/ L) và độ đục (NTU) ở nghiệm thức T35 và T65 trong 78 ngày thí nghiệm. Dữ liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn.
3.3. Hiệu quả tăng trưởng
Tôm cho thấy sự tăng trưởng tương tự ở cả hai nghiệm thức (p > 0,05) trong thí nghiệm, đạt trọng lượng cuối cùng lần lượt là 10,1 ± 0,7 g và 11,5 ± 1,9 g ở nghiệm thức T65 và T35. Kết quả về hiệu suất tăng trưởng về trọng lượng trung bình cuối cùng, tỷ lệ sống, tốc độ tăng trưởng hàng ngày, tỷ lệ chuyển đổi thức ăn và năng suất cho thấy không có sự khác biệt thống kê (p > 0,05) giữa các nghiệm thức (Bảng 2).
Bảng 2. Hiệu suất của L. vannamei và O. niloticus (giá trị trung bình ± độ lệch chuẩn) trong thời gian thử nghiệm.
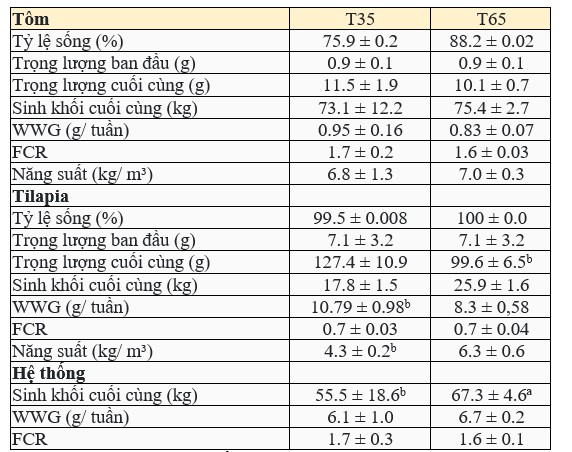
Tăng trưởng của cá cao hơn đáng kể (p < 0,05) ở nghiệm thức T35 so với nghiệm thức T65. Năng suất cao hơn ở nghiệm thức T65. Tỷ lệ sống và FCR tương tự nhau ở cả hai nghiệm thức (Bảng 2).
Đối với hệ thống IMTA (tôm + cá), tổng sinh khối cuối cùng cao hơn về mặt thống kê ở nghiệm thức T65. Tổng năng suất của toàn bộ hệ thống và FCR cho thấy không có sự khác biệt thống kê giữa các nghiệm thức (Bảng 2).
4. Thảo luận
Trong suốt thời gian thử nghiệm, các thông số vật lý và hóa học của chất lượng nước ở mức phù hợp cho cả tôm thẻ chân trắng L. vannamei (Samocha và Prangnell, 2019) và sự phát triển của cá rô phi (Atwood và cộng sự, 2001; Azim và Little, 2008). Ngay cả khi nuôi hai loài, lượng oxy hòa tan, yếu tố hạn chế đối với sinh vật nuôi, chủ yếu trong hệ thống biofloc, vẫn ở mức trên 6 mg/L, cao hơn giá trị khuyến nghị cho các loài được nuôi (Wasielesky và cộng sự, 2006; Tran- Duy và cộng sự, 2008).
Độ kiềm cho thấy sự khác biệt thống kê giữa các nghiệm thức trong thời gian thử nghiệm, tuy nhiên, giá trị trung bình được ghi nhận nằm trong mức khuyến nghị đối với L. vannamei (Furtado và cộng sự, 2014) và đối với cá rô phi (O. niloticus) (Cavalcante và cộng sự, 2009). Nghiệm thức T65 cho thấy giá trị độ kiềm trung bình thấp hơn T35, do đó, có giá trị nitrit trung bình thấp hơn (0,6 ± 0,6 mg/ L) so với T65 (1,1 ± 1,1 mg/ L). Ở nghiệm thức T65 đã đạt đỉnh mức nitrit ở thời điểm 21 ngày nghiên cứu, đạt 4,5 ± 3,31 mg/ L và điều này có thể xảy ra do sự hiện diện của cá trong hệ thống với mật độ cao, mặc dù có bổ sung vật liệu cấy biofloc trưởng thành. Ảnh hưởng của mật độ cá và sự mất cân bằng trong quá trình nitrat hóa được báo cáo bởi Holanda và cộng sự (2020) trong một nghiên cứu kết hợp tôm và cá đối (Mugil liza). Ngoài ra, có thể việc bơi lội của một lượng lớn cá có thể đã làm thay đổi kích thước và hình dạng của bioflocs, ảnh hưởng đến động lực nitrat hóa trong hệ thống biofloc (Carvalho và cộng sự, 2006; Delatolla và cộng sự, 2009).
Sự hiện diện của cá rô phi được tích hợp trong hệ thống không ảnh hưởng tiêu cực đến năng suất của tôm, bất kể mật độ cá được sử dụng. Năng suất tôm cao, khoảng 7,0 kg/ m3, đã được mong đợi trong các trại nuôi trong hệ thống biofloc và cao hơn các giá trị năng suất được báo cáo quan sát được trong các nghiên cứu đánh giá nuôi đơn canh biofloc của L. vannamei ở quy mô thí điểm (Krummenauer và cộng sự, 2011; Gaona và cộng sự, 2017). Các nhà nghiên cứu đã thu được năng suất gần 4,1 kg/ m3.
Ngay cả cá rô phi thiếu dinh dưỡng cũng cho thấy hiệu quả kỹ thuật chăn nuôi tương tự như báo cáo đối với nuôi cá rô phi trong hệ thống biofloc. Zaki và cộng sự (2020) cho thấy trọng lượng cuối cùng trung bình là 115 g đối với cá rô phi ở mật độ 60 con/ m³ trong 84 ngày, với trọng lượng ban đầu là 50g. Mặt khác, Malpartida Pasco và cộng sự (2018) quan sát năng suất 21 kg/ m3 trong bể 10m³ nuôi cá rô phi với mật độ 70 con/ m3 trong 56 ngày trong hệ thống biofloc.
FCR thu được ở tôm tương tự như các nghiên cứu khác về nuôi đơn canh L. vannamei trong hệ thống biofloc (Lara và cộng sự, 2017; Reis và cộng sự, 2019). Trong nghiên cứu này, điều đáng chú ý là giá trị FCR của cá rô phi thấp, dưới 1,0 ở cả hai nghiệm thức T65 (0,7 ± 0,04) và T35 (0,7 ± 0,03). Điều này chỉ ra rằng cá rô phi đã tiêu thụ hệ vi sinh vật tự nhiên có trong bioflocs và sử dụng nó như một phần quan trọng trong khẩu phần ăn của chúng. Tỷ lệ thức ăn thấp được cung cấp cho cá rô phi (1% sinh khối), giúp chúng tiêu thụ bioflocs mà không làm giảm sự tăng trưởng của chúng mặc dù lượng thức ăn được cung cấp thấp. Tỷ lệ thức ăn tiêu chuẩn cho cá rô phi trong hệ thống biofloc, với trọng lượng xấp xỉ 50g, chiếm 3% trọng lượng cơ thể ướt (Zaki và cộng sự, 2020). Các giá trị thu được trong nghiên cứu này không chỉ có lợi từ quan điểm môi trường mà còn có lợi về mặt kinh tế vì nó có thể giảm chi phí sản xuất do giảm lượng thức ăn sử dụng (chi phí lớn về mặt sản xuất), tạo ra hai loài ở mức cùng một lúc. Về mặt môi trường, sử dụng ít thức ăn hơn đồng nghĩa với việc tạo ra nước thải có ít khả năng gây ô nhiễm hơn, làm cho hoạt động nuôi trồng thủy sản trở nên thân thiện với môi trường và được xã hội chấp nhận (Tacon và Metian, 2008; Naylor và cộng sự, 2009). Ekasari và cộng sự (2014) cho thấy việc tiêu thụ bioflocs của cá rô phi đỏ, bất kể kích cỡ của cá. Nghiên cứu tương tự cũng cho thấy khả năng hấp thụ là 39 – 117 g TSS/kg cá. Poli và cộng sự. (2019)cũng nhận thấy giá trị FCR thấp (khoảng 0,2) đối với cá rô phi sông Nile trong nuôi kết hợp với L. vannamei , chứng tỏ cá rô phi có tiềm năng tiêu thụ chất rắn dư thừa do tôm tạo ra. Những kết quả này chỉ ra rằng cá rô phi có thể ăn biofloc và việc tích hợp hai loài này vào hệ thống IMTA có thể được thực hiện để đảm bảo một hệ thống nuôi bền vững hơn.
Ngay cả khi đưa cá vào hệ thống, cần phải loại bỏ tổng chất rắn lơ lửng dư thừa thông qua quá trình lắng. Thời gian lắng là khác nhau ở hai nghiệm thức, trong đó T65 được làm trong trong thời gian dài hơn, có thể là do tổng sinh khối trong nghiệm thức này cao. Gaona và cộng sự (2016) thực hiện làm sạch trong thời gian 58 ± 12,2 giờ trong nuôi độc canh tôm thẻ L. vannamei với mật độ 350 con/ m2, với trọng lượng ban đầu là 0,18 ± 0,06 g trong 17 tuần. Những dữ liệu này nhấn mạnh rằng cá rô phi có thể góp phần quản lý TSS, vì mật độ thả tôm được sử dụng trong nghiên cứu này cao hơn so với báo cáo trước đây của các tác giả. Trong nghiên cứu này, mật độ cá rô phi ở T35 thấp hơn đòi hỏi thời gian làm sạch ít hơn (36 ± 12 giờ), điều này chứng tỏ rằng mật độ thả cá cao hơn có thể góp phần làm dư thừa chất hữu cơ trong nước, do đó làm tăng TSS. Ngoài ra, thời gian làm rõ trong T35 ngắn hơn so với báo cáo của Gaona và cộng sự (2016) đối với độc canh L. vannamei ở mật độ thấp hơn so với nghiên cứu hiện tại. Trong nghiên cứu này, người ta nhận thấy rằng ở nghiệm thức T65 có sinh khối cá lớn hơn thì cần thời gian làm trong lâu hơn, điều này cho thấy rằng hệ thống tạo ra nhiều TSS hơn so với nghiệm thức T35. Kết quả tương tự đã được quan sát bởi Zaki và cộng sự (2020) trong việc độc canh cá rô phi trong hệ thống biofloc, cho thấy sự gia tăng khối lượng biofloc tỷ lệ thuận với sự gia tăng mật độ thả giống.
Azim và Little (2008) nhận thấy rằng rất khó để duy trì mức TSS ở mức 500 mg/ L ngay cả khi sử dụng chất làm sạch và thường mức này đạt vượt quá 1000 mg/ L TSS, nuôi cá rô phi từ 80 đến 120 g và mật độ 12 kg/ m3. Việc tiêu thụ bioflocs của cá phụ thuộc vào loài nuôi, thói quen ăn uống của cá cũng như kích thước và mật độ của bioflocs. Có thể việc tiêu thụ bioflocs của cá cũng phụ thuộc vào sự hiện diện và tỷ lệ thức ăn được thêm vào bể. Vì vậy, cần khuyến khích các nghiên cứu mới với tỷ lệ sinh khối khác nhau của tôm và cá.
Hầu hết các nghiên cứu về nuôi IMTA của L. vannamei và cá rô phi đều hiệu quả với mật độ tôm thấp (10 đến 120 con/m2) (Yuan và cộng sự, 2010; Muangkeow và cộng sự, 2011; Simão và cộng sự, 2013) và một số ít là những nghiên cứu về nuôi cấy IMTA ở mật độ siêu thâm canh. Poli và cộng sự (2019) quan sát thấy năng suất tôm lên tới 4 kg/ m3 trong nuôi kết hợp tôm, cá rô phi sông Nile và Sarcocornia ambigua ở quy mô phòng thí nghiệm. Nghiên cứu này cung cấp thông tin hữu ích để triển khai nuôi tôm và cá biofloc trong các hệ thống nuôi tích hợp, đa dạng hóa sản xuất mà không làm giảm năng suất của các loài mục tiêu, trong nghiên cứu này là tôm. Từ góc độ sản xuất, dữ liệu được trình bày ở đây tạo điều kiện phát triển thu hoạch tôm và cá rô phi tổng hợp trong hệ thống biofloc, trong các bể trên cạn.
5. Kết luận
Các kết quả thu được trong nghiên cứu này cho thấy rằng có thể nuôi tổng hợp L. vannamei và O. niloticus trong các hệ thống siêu thâm canh sử dụng biofloc, có thể giảm tỷ lệ cho cá ăn mà không ảnh hưởng tiêu cực đến sự tăng trưởng của chúng. Khi sử dụng mật độ cá rô phi cao hơn (65 con/ m3), tổng nồng độ chất rắn lơ lửng trong nước sẽ tăng lên, đồng thời tăng thời gian lọc cần thiết để giữ nồng độ này ở mức phù hợp với loài. Nghiên cứu này, ở quy mô thí điểm, chứng minh rằng hệ thống IMTA của cá rô phi với L. vannamei dựa trên bioflocs giúp đa dạng hóa sản xuất mà không ảnh hưởng đến năng suất tôm.
Theo Mariana Holanda, Elisa Ravagnan, Gabriele Lara, Gabriel Santana, Plinio Furtado, Alessandro Cardozo, Wilson Wasielesky Jr, Luis Henrique Poersch.
Nguồn: https://www.frontiersin.org/articles/10.3389/fmars.2023.1060846/full
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Biện Pháp Giúp Hạn Chế Mùi Bùn Ở Cá Rô Phi
- Tác Dụng Của Chiết Xuất Polyphenol Tự Nhiên Từ Mía (Saccharum oflcinarum) Đến Tăng Trưởng, Tỷ Lệ Sống Và Hiệu Quả Sử Dụng Thức Ăn Của Tôm Sú (Penaeus monodon) Giai Đoạn Juvenile
- Vật Chủ Liên Quan Đến Hỗn Hợp Vi Khuẩn Probiotic Gây Ra Các Enzyme Tiêu Hóa Trong Ruột Tôm Sú Penaeus monodon

 English
English