Kỹ Thuật Nuôi, Tin tức
Hiệu quả của dầu tảo như một thành phần thức ăn để phát triển khẩu phần trưởng thành cho tôm sú bố mẹ Penaeus monodon (Fabricius)
Tóm tắt
Nghiên cứu này đánh giá tác động của dầu tảo đối với khả năng sinh sản của tôm sú bố mẹ (P. monodon). Năm khẩu phần ăn (D1, D2, D3, khẩu phần ăn tham chiếu và khẩu phần ăn đối chứng) được thiết kế với hàm lượng dầu tảo lần lượt là 2,5%, 5%, 7,5%, có dầu tảo và không có dầu tảo. Kết quả cho thấy khẩu phần ăn trưởng thành thúc đẩy tần suất lột xác và rút ngắn thời gian trưởng thành hoàn toàn của buồng trứng. Tôm được bổ sung D2 có thời gian sinh sản ngắn hơn, khả năng sinh sản và hệ số thành thục cao hơn. So sánh với đối chứng, tôm ở D2 có tỷ lệ sinh sản và sự phát triển buồng trứng kém hơn. Tôm bố mẹ được cho ăn D2 thể hiện tỷ lệ hình thành trứng, thụ tinh và tỷ lệ nở cao hơn, đồng thời có hoạt động prophenoloxidase tối ưu. Mặc dù khẩu phần ăn tham chiếu tác động đến tất cả các thông số sinh sản, hiệu quả vẫn thấp hơn so với khẩu phần ăn chứa dầu tảo. Khẩu phần ăn dựa trên 5% dầu tảo được chứng minh là hiệu quả nhất trong việc thúc đẩy sinh sản thành công ở tôm sú bố mẹ. Do đó, khẩu phần ăn này có tiềm năng ứng dụng trong việc tái sử dụng đàn tôm sú bố mẹ.
Giới thiệu
Nuôi trồng thủy sản đang bùng nổ với tốc độ tăng trưởng vượt trội so với bất kỳ ngành sản xuất thực phẩm nào khác, dự kiến đạt sản lượng tăng 35% vào năm 2022. Để hiện thực hóa mục tiêu này, việc sản xuất con giống chất lượng cao đóng vai trò then chốt, và nguồn trứng là yếu tố tiên quyết. Tuy nhiên, khai thác quá mức tôm hoang dã để làm nguồn giống đang dẫn đến suy giảm nghiêm trọng quần thể cá và giáp xác trong môi trường tự nhiên. Đối với tôm sú (Penaeus monodon), hoạt động sản xuất giống chủ yếu dựa vào nguồn tôm bố mẹ đánh bắt, vốn mang tính mùa vụ cao, gây nhiều bất cập và tốn kém cho trại giống. Chi phí mua tôm giống thường chiếm hơn 50% tổng chi phí vận hành trại. Tái sử dụng tôm bố mẹ nổi lên như giải pháp tiềm năng cho bài toán khan hiếm con giống trong ngành nuôi trồng thủy sản. Việc tái sử dụng tôm bố mẹ có thể giúp giảm chi phí sản xuất, đảm bảo nguồn cung con giống ổn định và chất lượng, đồng thời góp phần bảo vệ nguồn lợi thủy sản tự nhiên.
Cắt mắt cuống mắt ở tôm sú bố mẹ P. monodon để thúc đẩy sinh sản có thể dẫn đến suy giảm khả năng sinh sản do những thay đổi đột ngột trong thành phần sinh hóa của tôm, đặc biệt là lipid và protein. Sinh sản liên tục đòi hỏi lượng dinh dưỡng cao, ảnh hưởng đến cholesterol và triacylglyceride ở tôm. Do đó, nhiều nghiên cứu tập trung vào việc xây dựng khẩu phần ăn phù hợp cho giai đoạn thành thục. Babu và cộng sự (2008) đã nghiên cứu và cho thấy khẩu phần ăn trưởng thành có bổ sung thảo dược giúp cải thiện hiệu quả sinh sản. Babu và Marian (2018) cũng đạt được kết quả tương tự khi cho tôm ăn Artemia giàu thảo dược sau khi sinh sản, giúp tăng gấp 2,5 lần hiệu suất sinh sản và chất lượng ấu trùng so với nhóm đối chứng.
Tảo được xem là nguyên liệu thức ăn thay thế tiềm năng cho nuôi trồng thủy sản. Với hàm lượng protein, lipid và carbohydrate phong phú, tảo sở hữu nhiều ưu điểm hơn so với thức ăn truyền thống. Bột tảo giàu PUFA (axit béo không no đa chuỗi) đã được chứng minh giúp nâng cao hiệu suất sinh sản của tôm thẻ chân trắng Litopenaeus vannnamei. Dầu tảo chứa axit béo Omega-3 – thành phần dinh dưỡng thiết yếu cho nhiều loài cá – cũng góp phần cải thiện dinh dưỡng cho ấu trùng và tăng tỷ lệ sống. Chiết xuất tế bào tảo từ Chlorella, Dunaliella và Spirulina đã được thương mại hóa và sử dụng rộng rãi. Lipid tảo đóng vai trò quan trọng trong việc ảnh hưởng đến chất lượng sinh sản và trứng của nhiều loài cá. Thiếu hụt axit béo không bão hòa (n-3) có thể ảnh hưởng tiêu cực đến khả năng sinh sản, thụ tinh và tỷ lệ nở.
Do đánh bắt bừa bãi, nguồn tôm bố mẹ tự nhiên khan hiếm, giá cao nên việc tái sử dụng tôm bố mẹ đã qua sử dụng để đáp ứng nhu cầu sản xuất. Mức độ lipid trong máu của tôm bố mẹ giảm sau giai đoạn sinh sản, cần bổ sung lipid để giúp chúng sinh sản với trứng chất lượng. Khẩu phần ăn giàu PUFA giúp cải thiện chất lượng trứng và khả năng sinh sản. Dầu tảo giàu PUFA là yếu tố thiết yếu cho sinh sản thành công ở tôm sú bố mẹ P. monodon. Mục tiêu chính của nghiên cứu này là xây dựng khẩu phần trưởng thành với dầu tảo giàu PUFA để sinh sản thành công ở tôm sú bố mẹ Penaeus monodon.
Chuẩn bị nghiên cứu
Các nguyên liệu thức ăn nêu trong bảng được cân và trộn đều trong một thùng chứa bằng cách thêm một lượng nước cất vừa đủ và sau đó các nguyên liệu này được nhào thành bột. Sau đó, bột được cho vào hộp đựng và đun sôi trong nồi áp suất trong 20 phút. Sau khi đun sôi, lấy bột ra khỏi hộp và sau khi nguội, thêm riêng vitamin, dầu tảo (2,5 g (%), 5 g (%) và 7,5 g (%)) và hỗn hợp khoáng chất vào bột và trộn đều. Thay vì dầu tảo, dầu cá có trọng lượng 5 g được đưa vào khẩu phần tham chiếu. Đối chứng âm tính không chứa dầu tảo hay dầu cá (Bảng 1).
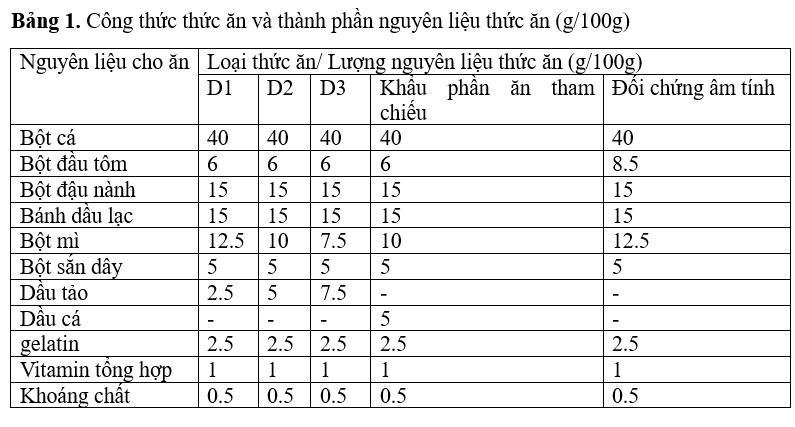
Chuẩn bị khẩu phần ăn
Bột sau đó được cho đi qua máy ép viên có đường kính lỗ thủng là 1,5 mm thuốc nhuộm. Sau đó, khẩu phần tham chiếu (Dầu cá), khẩu phần đối chứng âm tính (không có dầu tảo) cũng như khẩu phần thí nghiệm được sấy khô trong lò sấy không khí nóng ở nhiệt độ 40℃ trong 15 giờ. Các viên khô được thu thập và bảo quản trong hộp nhựa kín.
Ước tính Protein, Lipid và Carbohydrate
Thành phần protein, lipid và carbohydrate của tôm sú bố mẹ Penaeus monodon được ước tính.
Thiết kế thử nghiệm
5 khẩu phần ăn riêng biệt đã được chuẩn bị. Đó là khẩu phần tham chiếu (5 g (%) dầu cá) và khẩu phần đối chứng âm tính (không có dầu), và ba khẩu phần thí nghiệm (D1- 2,5 g (%) dầu tảo, D2- 5 g (%) dầu tảo và D3- 7,5 g (%) dầu tảo. Tôm bố mẹ (tôm đẻ trứng) thuộc ba nhóm kích thước khác nhau 150-200, 201-250 và 251-300 g đã được chọn cho nghiên cứu này (Bảng 2). Sau khi thích nghi với môi trường trại giống, tôm được cắt một cuống mắt, thí nghiệm cho ăn từ ngày thả giống vào bể trưởng thành, cho ăn theo tỷ lệ 15 -20% trọng lượng cơ thể. Tôm sinh sản cũng được cắt một cuống mắt nhưng chỉ được cho ăn khẩu phần đối chứng âm tính (không có dầu tảo kết hợp với thức ăn viên). Mỗi nghiệm thức được lặp lại 5 lần. Bể trưởng thành có hình tròn, chứa được 7 tấn nước (r = 1,5 m và h = 0,9 m).
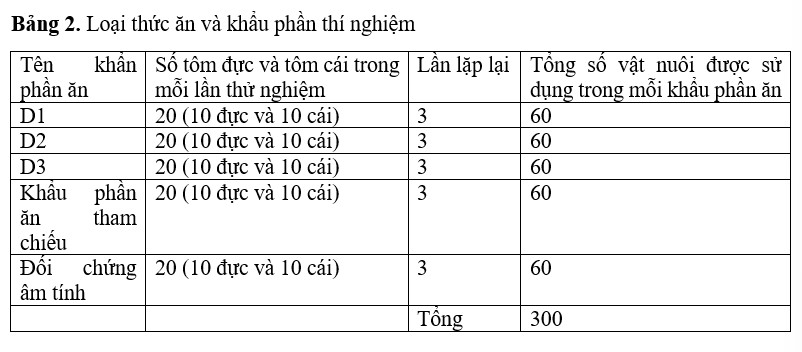
Cho ăn
Tôm bố mẹ thuộc ba nhóm kích thước (150-200, 201-250, 251-300) đã được chọn cho thí nghiệm này. Mỗi nhóm thí nghiệm bao gồm 10 con đực và 10 con cái. Tổng trọng lượng cơ thể của 20 con ban đầu được lấy để phân bổ lịch trình cho ăn. Tôm được cho ăn thức ăn trưởng thành dựa trên 15-20% trọng lượng cơ thể. Việc cho ăn được thực hiện ba lần mỗi ngày; buổi sáng sau khi thay nước (7h), buổi chiều (4h chiều) và tối (10h tối). Sự hấp thu thức ăn được tính toán trên cơ sở trọng lượng khô. Trước khi cho ăn, những con chưa được cho ăn được thu gom riêng. Tôm được cho ăn cho đến khi hơn 90% tôm sinh sản.
Tần suất lột xác
Số lần lột xác trong 30 ngày sau khi cắt mắt được tính bằng cách gắn thẻ các con tôm trong cả hai nhóm thí nghiệm và đối chứng. 4 bộ thí nghiệm với 20 con tôm đã được nghiên cứu và thí nghiệm được lặp lại 3 lần.
Ảnh hưởng của khẩu phần ăn trưởng thành bổ sung dầu tảo đối với sự phát triển của buồng trứng
Việc cho ăn khẩu phần ăn trưởng thành bằng dầu tảo được đánh giá bằng cách cho ba nhóm sinh sản đã qua sử dụng thử nghiệm ăn khẩu phần ăn trưởng thành. Thời gian phát triển của buồng trứng được xác định bằng số ngày (ngày) cần thiết để quan sát buồng trứng giai đoạn đầu sau cắt mắt. Thời gian trưởng thành được đánh giá bằng số ngày cần thiết để buồng trứng phát triển từ giai đoạn 1 đến giai đoạn 4. Việc khẩu phần ăn tham chiếu dành cho con sinh sản cũng được quan sát nhưng chỉ cho ăn bằng khẩu phần ăn đối chứng âm tính (không có dầu tảo).
Tỷ lệ trứng vón cục, đẻ trứng và khoảng trống trong buồng trứng
Tỷ lệ vón cục và tỷ lệ sinh sản được nghiên cứu bằng phương pháp được mô tả bởi Babu và cộng sự. Tính toán tỷ lệ phần trăm vón cục dựa trên tổng số trứng bị vón cục và số trứng riêng lẻ. Để nghiên cứu tỷ lệ sinh sản, trứng đẻ được thu thập riêng và cân. Những quả trứng chưa đẻ còn lại được lấy ra cùng với buồng trứng bằng một đường rạch dọc ở mặt lưng của tôm. Tách cẩn thận tất cả trứng khỏi buồng trứng và cân. Tính toán tỷ lệ sinh sản dựa trên tổng trọng lượng của trứng đã đẻ và trứng chưa đẻ. Số lượng khoảng trống trong buồng trứng được tính bằng cách cầm tôm giống trên tay và đưa chúng về phía ánh sáng. Điều này giúp có thể nhìn rõ buồng trứng để đếm số khoảng trống trong buồng trứng.
Khả năng sinh sản của tôm sau khi cắt mắt
Những con sinh sản đã qua sử dụng sau khi cắt mắt được cho ăn bằng khẩu phần trưởng thành thử nghiệm. Thu thập trứng từ bốn lần sinh sản tiếp theo vào những ngày khác nhau sau khi cắt mắt. Cho trứng vào thùng nhựa 100 lít có sục khí mạnh để giữ cho trứng lơ lửng. Sử dụng cốc thủy tinh 10 ml để thu thập năm mẫu từ các độ sâu khác nhau của thùng. Đếm số trứng thu được từ năm lần lấy mẫu và tính trung bình. Nhân trung bình với thể tích nước (100 lít) để tính tổng số trứng. Theo cách tương tự, số trứng thu được từ lần sinh sản II, III, IV được đếm và biểu thị bằng triệu.
Nghiên cứu chất lượng trứng
Trong thí nghiệm này, trứng thu được ở lần sinh sản thứ 1, thứ 2 và thứ 3 sau khi cho ăn bằng khẩu phần ăn trưởng thành được nghiên cứu về tỷ lệ phôi hình thành, tỷ lệ trứng thụ tinh và tỷ lệ phôi dị dạng. Tỷ lệ trứng hình thành được tính bằng cách quan sát sự phát triển của ấu trùng trong trứng sau 10 giờ sinh sản. Điều này sẽ được khẳng định sau khi tham chiếu sự phát triển bình thường của trứng đã thụ tinh.
Hệ số thành thục (GSI)
Để ước tính hệ số thành thục (GSI), con cái được cân riêng sau khi lau khô. Tuyến sinh dục được mổ xẻ cẩn thận và cân bằng cân điện tử. GSI được tính bằng cách sử dụng công thức.
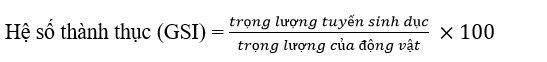
Khẩu phần ăn cho quá trình trưởng thành của dầu tảo đối với tỷ lệ sống của ấu trùng
Thí nghiệm này được tiến hành để đánh giá ảnh hưởng của chất lượng trứng đến chất lượng ấu trùng. Bằng cách quan sát ấu trùng dưới kính hiển vi cứ sau 6 giờ, tỷ lệ chuyển đổi giai đoạn đã được đánh giá. Số lượng ấu trùng biến thái sang giai đoạn ấu trùng tiếp theo được coi là 100%. Các giai đoạn phụ trong giai đoạn ấu trùng được xác định bằng quy trình chuẩn thu được từ sổ tay của Treece và Yates. Tổng số ấu trùng được đưa vào mỗi giai đoạn phụ được đánh giá và từ đó, tỷ lệ sống trong mỗi giai đoạn phụ được tính toán.
Tác dụng miễn dịch của khẩu phần ăn trưởng thành
Chuẩn bị huyền phù vi khuẩn
Nuôi cấy vi khuẩn Vibrio harveyi, Vibrio parahemolyticus và Aeromonas sp. qua đêm trong môi trường nước biển ở nhiệt độ 37℃. Tạo viên vi khuẩn từ nuôi cấy bằng cách ly tâm ở tốc độ 6000 vòng/phút trong 10 phút. Rửa viên vi khuẩn ba lần trong nước lọc (0,2 µm) và nước muối khử trùng (3%), và hòa lại trong nước muối vô trùng để đạt được nồng độ 5×106 tế bào/ml. Số lượng vi khuẩn được xác định bằng cách sử dụng máy đo huyết sắc tố vạch sáng ở 100X.
Lấy mẫu hemolymp
Hemolymp được thu thập từ phần bụng thứ hai bằng cách sử dụng 25 kim gạc và ống tiêm 1ml chứa đầy 0,2 ml dung dịch Alsever biến tính lạnh (AS;19,3 mM Na citrate, 239,8 mM NaCl, 182,5 mM glucose, 6,2 mM EDTA ( axit ethylene diamine tetraacetic): pH 7,2) làm chất chống đông máu. Điều này ngăn ngừa sự hình thành hắc tố và giữ cho các tế bào máu ở trạng thái không hoạt động. Quy trình đâm thủng đã ngăn chặn việc tách các hạt mô trong quá trình lấy mẫu hemolymp. Ngay sau khi lấy mẫu, dịch hemolymp được bảo quản trong cốc Eppendorf 5 ml và giữ trên đá cho đến khi phân tích trong vòng 1 giờ sau khi lấy mẫu. Hemolymp của khẩu phần ăn thử nghiệm, tham chiếu và đối chứng đã được thu thập.
Hoạt tính phenol oxydase
Hoạt tính pro-phenol oxydase trong các mẫu hemolymp được xác định bằng cách sử dụng Ldihydroxyphenylanine (L-DOPA) làm chất nền. 200 µl TBS đã được thêm vào cuvet thử nghiệm chứa 30 µl mẫu hemolymp. Sau đó, 60 µl dung dịch L-DOPA (1,6 mg/ml trong TBS) được thêm vào sau đó trộn ngay. Việc bổ sung 200 µl TBS làm chất pha loãng và hoạt tính enzyme được xác định bằng cách đo độ hấp thụ của dopachrome ở bước sóng 490 nm so với mẫu trắng chứa 260 µl TBS và 60 µl L-DOPA. Độ hấp thụ được đo ở thời điểm 1 và 3 phút sau khi thêm 200 µl TBS. Hoạt tính của enzyme prophenol oxidase được biểu thị bằng đơn vị, được định nghĩa là lượng enzyme làm tăng độ hấp thụ ở bước sóng 490 nm là 0,001 mỗi phút/mg/protein.
Phân tích thống kê
Phân tích thống kê đã được thực hiện cho tất cả các thử nghiệm, tuy nhiên, phân tích thống kê về các giá trị đỉnh được trình bày trong Bảng. Phân tích thống kê cho từng thí nghiệm được thực hiện bằng cách sử dụng ANOVA một chiều, sau đó là các thử nghiệm so sánh nhiều lần của Tukey với ý nghĩa thống kê được đặt ở p<0,05. Tất cả các phân tích được thực hiện với SPSS 11.5. Phần mềm Origin (phiên bản 6) được sử dụng để thể hiện dữ liệu dưới dạng Bảng.
Kết quả
Phân tích thành phần
Thành phần và công thức thức ăn được đưa ra trong Bảng 1. Cách thiết lập và cho ăn thử nghiệm được đưa ra trong Bảng 2. Tổng hàm lượng protein, lipid và carbohydrate được ước tính cho khẩu phần ăn thử nghiệm (D1, D2, D3) và khẩu phần ăn tham chiếu (Bảng 3). Dựa trên kết quả, hàm lượng protein tối đa ở D3 với mức ý nghĩa 5%, tiếp theo là các khẩu phần ăn khác. Tương tự, hàm lượng lipid cũng cao ở D2 (12±0,23) và D3 (13±0,42) với mức ý nghĩa p<0,05. Tổng hàm lượng carbohydrate cũng được ước tính cho các khẩu phần ăn được sử dụng, trong đó D1 và D2 cho thấy hàm lượng carbohydrate tối đa lần lượt là 42±0,34 và 41±0,02 với mức ý nghĩa 5%.
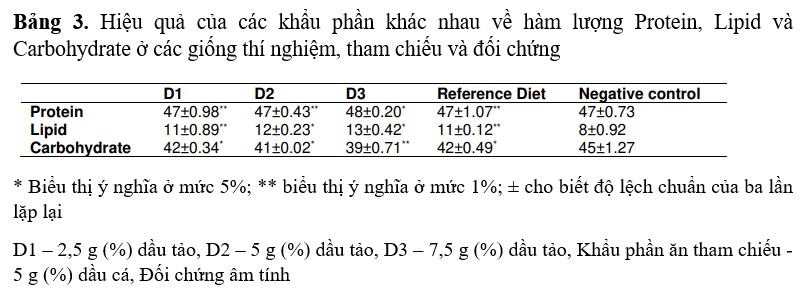
Lượng thức ăn ăn vào của tôm sinh sản
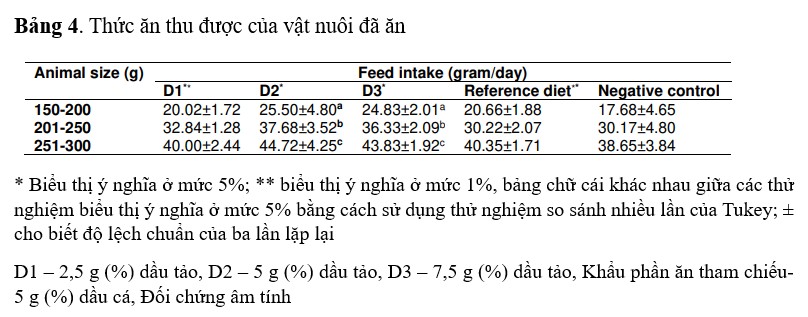
Lượng thức ăn ăn vào luôn khác nhau tùy theo kích cỡ của tôm. Mức tiêu thụ thức ăn tối đa của tất cả các tôm bố mẹ có kích thước khác nhau (150-200, 201-250 và 251-300 g) tiêu thụ tối đa lần lượt là 25,50, 37,68 và 44,72 g thức ăn/ngày. Tất cả các nhóm kích thước của tôm thí nghiệm và tôm đối chứng dương tính tiêu thụ số lượng khẩu phần trưởng thành (D1, D2 và D3) nhiều hơn so với đối chứng âm tính. Tôm được cho ăn khẩu phần tham chiếu (đối chứng dương tính) tiêu thụ lần lượt 20,66, 30,22 và 40,35 g thức ăn/ngày và tất cả các thông số được phân tích thống kê ở mức ý nghĩa được biểu thị trong Bảng 4.
Tần suất lột xác
Trong 30 ngày sau khi sinh sản tự nhiên và cắt mắt, nhóm cỡ 150-200 g lột xác 2,16 lần nhưng các nhóm cỡ 201-250 và 251-300 g lột xác lần lượt là 1,07 và 1,05 lần. Về khẩu phần ăn, nhóm cỡ 150-200 g có tỷ lệ lột xác là 1,76 lần và các nhóm cỡ khác như 201-250 g và 251-300 g lột xác lần lượt là 0,94 và 0,88 lần. Đồng thời, tôm đối chứng bị cắt mắt ở nhóm cỡ 150-200 g lột xác 1,67 lần trong vòng 30 ngày sau khi cắt mắt, nhưng nhóm cỡ khác được cho ăn khẩu phần đối chứng không lột xác. Tất cả các giá trị được phân tích thống kê (Hình 1).
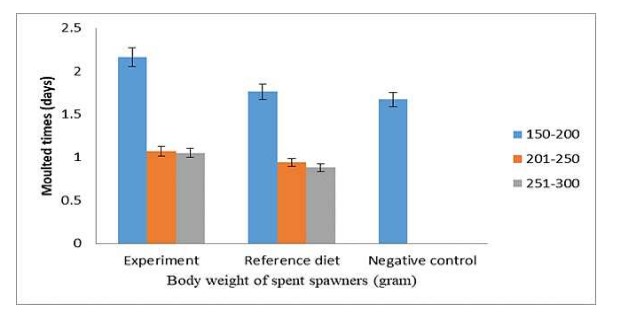
Hình 1. Ảnh hưởng của các khẩu phần khác nhau đến tần suất lột xác sau khi cắt mắt
Ảnh hưởng của khẩu phần ăn trưởng thành bổ sung dầu tảo đến thành công sinh sản
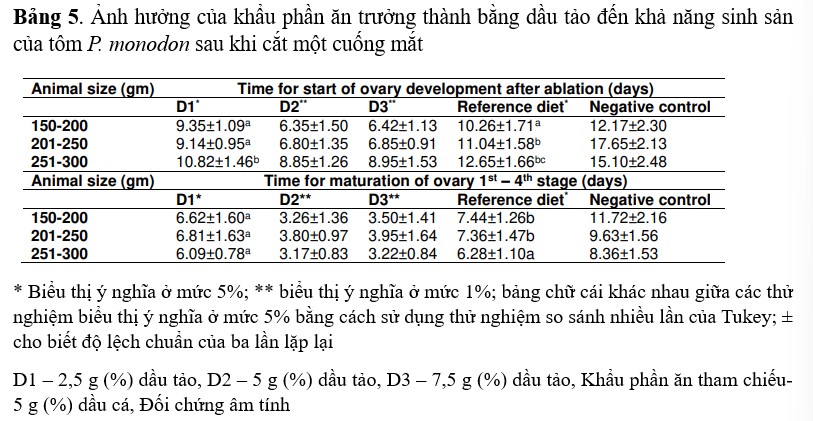
Ba nhóm kích thước của tôm bố mẹ đã cắt mắt là 150-200, 201-250 và 251-300 g đã được chọn cho nghiên cứu này. Kích thước sinh sản và khẩu phần ăn bổ sung dầu tảo (D1, D2 và D3) có tác động tổng hợp đến sự phát triển nhanh chóng của buồng trứng sau khi cắt mắt. Ở các nhóm tôm bố mẹ thí nghiệm, thời gian bắt đầu phát triển buồng trứng ở tôm cỡ 150-200, 201-250 và 251-300 g sau khi cắt mắt và cho ăn bằng khẩu phần trưởng thành dầu tảo lần lượt là 6,35, 6,80 và 8,85 ngày. Nhưng đối chứng âm tính thuộc nhóm cỡ 150-200, 201-250 và 251-300 g mất 12,17, 17,65 và 15,10 ngày để bắt đầu phát triển buồng trứng. Tôm bố mẹ được cho ăn bằng khẩu phần tham chiếu thuộc nhóm cỡ 150-200, 201-250 và 251-300 g mất 10,26, 11,04 và 12,65 ngày để bắt đầu phát triển buồng trứng. Thời gian để đạt từ giai đoạn 1 đến giai đoạn 4 cũng thay đổi tùy theo kích cỡ và khẩu phần ăn của tôm. Tôm thí nghiệm thuộc nhóm cỡ 150-200, 201-250 và 251-300 g mất 3,26, 3,80 và 3,17 ngày để đạt từ giai đoạn 1 đến giai đoạn 4. Tất cả các giá trị thí nghiệm được phân tích bằng công cụ thống kê, khẩu phần tham chiếu và khẩu phần đối chứng âm tính bằng thức ăn đối chứng của cùng nhóm kích thước mất lần lượt là 7,44, 7,36, 6,28 và 11,72, 9,63, 8,36 ngày để đạt từ giai đoạn 1 đến giai đoạn 4 (Bảng 5).
Trứng vón cục hoặc sinh sản kém
Tỷ lệ trứng vón cục (hoặc) sinh sản kém được nghiên cứu trong khẩu phần thử nghiệm (D1, D2 và D3), những con được cho ăn bằng khẩu phần tham chiếu và đối chứng đã dành thời gian sinh sản cho ba lần sinh sản tiếp theo sau lần sinh sản tự nhiên đầu tiên và tất cả các giá trị đều được phân tích thống kê. Ở nhóm tôm thí nghiệm, tỷ lệ trứng vón cục và tỷ lệ sinh sản ở lần thứ 1, 2 và 3 lần lượt là 5,61, 7,81, 10,54 và 95,4, 88,52, 85,18 và không tìm thấy khoảng trống nào trên buồng trứng của tôm. Ở tôm cho ăn thức ăn, tỷ lệ vón cục và tỷ lệ sinh sản lần lượt là 7,89, 10,23, 18,92 và 84,87, 76,88, 72,56 ở lần thứ 1, thứ 2 và thứ 3. Số lỗ trống trên buồng trứng lần lượt là 0,98, 1,32 và 1,42 ở lần thứ 1, 2 và 3. Ở nhóm tôm đối chứng âm tính, tỷ lệ vón cục và lỗ trống trên buồng trứng lần lượt là 20,72, 25,18, 30,54 và 70,68, 60,85, 53,14 ở lần thứ 1, thứ 2 và thứ 3. Số lượng khoảng trống trong buồng trứng lần lượt là 1,14, 2,17 và 2,83 ở lần thứ 1, thứ 2 và thứ 3 (Hình 2).
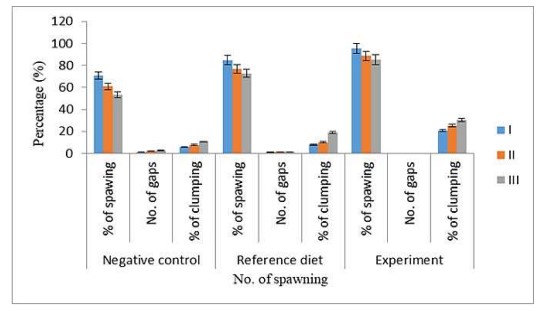
Hình 2. Ảnh hưởng của khẩu phần ăn trưởng thành đến chất lượng sinh sản
Khả năng sinh sản của tôm sau khi cắt mắt
Khoảng thời gian giữa hai lần sinh sản liền kề cũng được đánh giá ở cả khẩu phần ăn thử nghiệm, khẩu phần ăn tham chiếu và đối chứng. Sức sinh sản của tôm bố mẹ thí nghiệm được cho ăn D2 ở các lần sinh sản I, II, III và IV lần lượt là 0,93, 0,76, 0,64 và 0,57 triệu trứng. Về khẩu phần ăn, sức sinh sản của tôm ở lứa I, II, III lần lượt là 0,72, 0,43, 0,31 và 0,17. Ở nhóm đối chứng âm sinh sản bằng khẩu phần ăn, sức sinh sản ở nhóm đối chứng âm là 0,61, 0,32 và 0,17 triệu trứng và không có sinh sản IV ở nhóm đối chứng âm tính. Tổng khả năng sinh sản sau khi cắt mắt ở tôm thí nghiệm là 2,9 triệu trứng. Tổng sức sinh sản ở tôm cho ăn khẩu phần tham chiếu và khẩu phần đối chứng âm tính là 1,63 và 1,10 triệu trứng. Khoảng thời gian giữa 0&I, I&II, II&III, III &IV lần lượt là 7,47, 5,12, 4,48, 3,69 ngày trong sinh sản thử nghiệm và đối với khẩu phần ăn tham chiếu và đối chứng âm tính, khoảng thời gian lần lượt là 12,19, 7,55, 8,67 và 15,72, 9,64, 11,72 trong giai đoạn sinh sản I, II, III và mức độ có ý nghĩa giữa các thí nghiệm được đề cập ở Bảng 6.
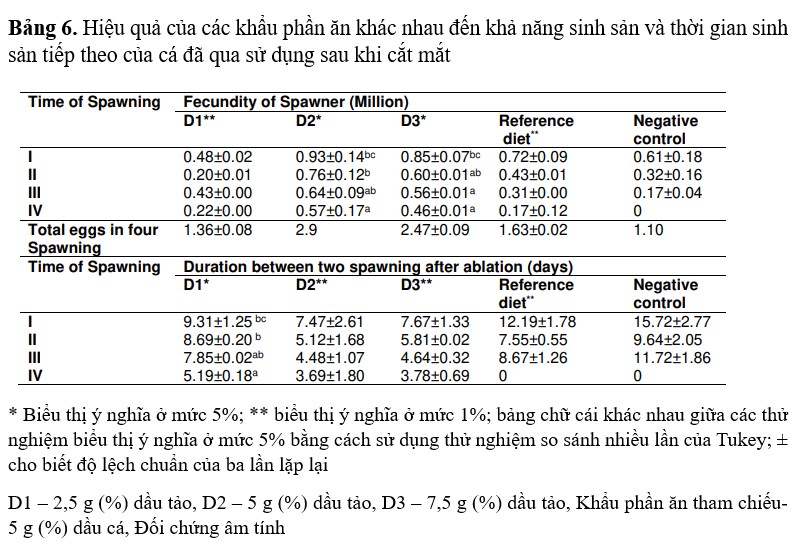
Ảnh hưởng của khẩu phần ăn trưởng thành bổ sung dầu tảo đối với chất lượng trứng
Ở khẩu phần thí nghiệm (D2), tỷ lệ trứng hình thành thu được ở lần sinh sản I, II và III lần lượt là 94,17, 87,40 và 85,18 ở mức ý nghĩa 5%. Về khẩu phần thí nghiệm, tỷ lệ trứng hình thành ở lứa I, II và III lần lượt là 72, 67,33 và 58,33. Ở nhóm tôm đối chứng âm tính, tỷ lệ trứng hình thành ở lần sinh sản I, II và III lần lượt là 65,68, 42,14 và 33,10 %. Tỷ lệ trứng thụ tinh ở khẩu phần thí nghiệm (D2) cho tôm sinh sản lần lượt là 92,60, 80,05, 76,54 ở lứa I, II và III. Nhưng về khẩu phần thí nghiệm và đối chứng âm tính, tỷ lệ trứng hình thành ở lần sinh sản I, II và III lần lượt là 75,67 và 63,66, 44,67 và 65,84, 56,13 và 41,65 với giá trị ý nghĩa p< 0,05. Tỷ lệ nở trong khẩu phần thí nghiệm (D2) của tôm cho ăn đạt tối đa (92,36) ở lứa đầu tiên, tiếp theo là 85,60 và 82,48 ở lứa II và III. Về khẩu phần thí nghiệm, tỷ lệ nở tối đa (75,83) được quan sát ở lứa I, tiếp theo là 68,67, 60,83 ở lứa II và III. Trong đối chứng âm tính, tỷ lệ nở tối đa (62,89) được quan sát thấy ở lần I, tiếp theo là 40,45 % ở lần II và 30,84 % ở lần III (Bảng 7).
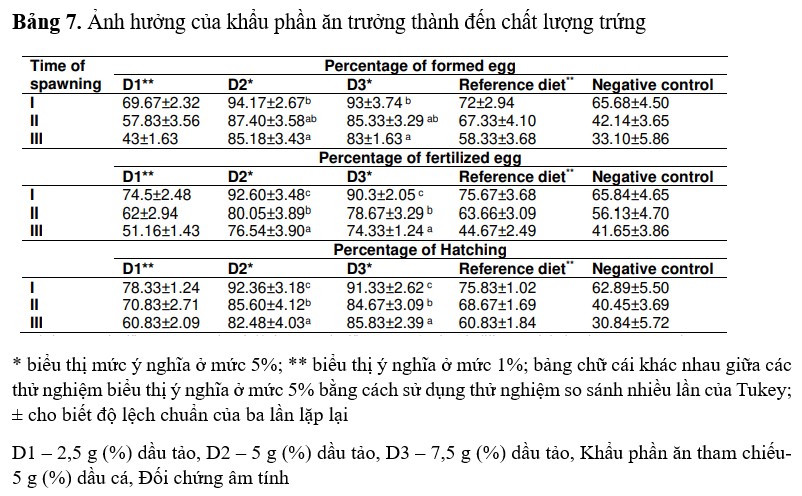
Hệ số thành thục (%)
Hệ số thành thục ở tôm thí nghiệm lần lượt là 6,84, 5,76 và 5,27% ở lần I, II và III. Mặc dù xu hướng giảm tương tự cũng được quan sát thấy ở những lần sinh sản tiếp theo, nhưng các chỉ số này được nhận thấy là thấp hơn so với tôm thí nghiệm. GSI trong khẩu phần tham chiếu và đối chứng âm tính lần lượt là 6,32, 5,08, 4,86 và 5,26, 3,48, 2,54 ở lần I, II và III (Hình 3).
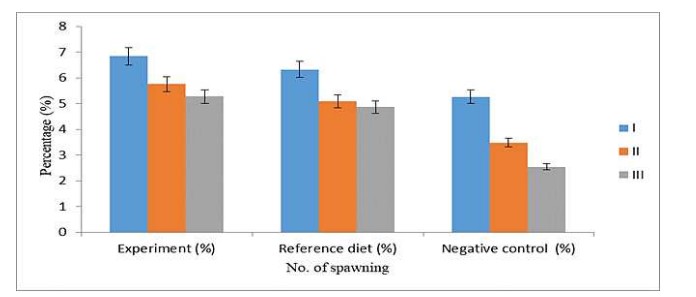
Hình 3. Ảnh hưởng của các khẩu phần ăn khác nhau đến hệ số thành thục (%)
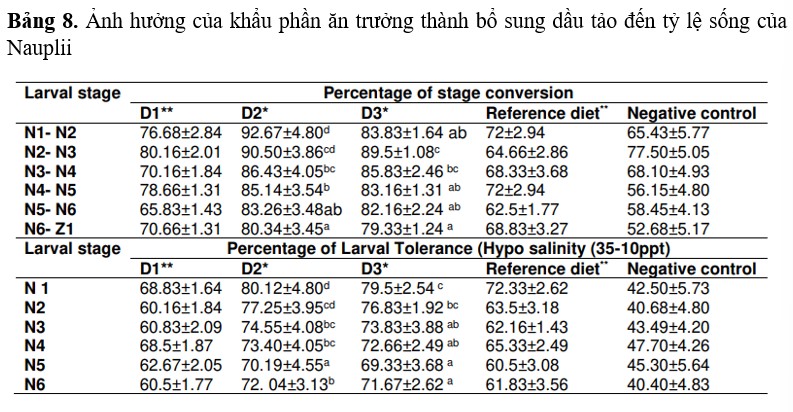
Ảnh hưởng của khẩu phần ăn trưởng thành bổ sung dầu tảo đến tỷ lệ sống của Nauplii
Tôm được cho ăn bằng khẩu phần nuôi dưỡng bằng dầu tảo có tỷ lệ biến thái từ N6-Z1 cao hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Tỷ lệ biến thái cao nhất (80,34%) được ghi nhận ở tôm được cho ăn bằng khẩu phần D2. Tỷ lệ biến thái thấp nhất (52,68%) được ghi nhận ở tôm đối chứng âm tính. Ấu trùng được thu thập từ tôm bố mẹ được cho ăn bằng khẩu phần D2 có khả năng chịu đựng stress cao hơn so với ấu trùng được thu thập từ tôm bố mẹ được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Khả năng chịu đựng stress cao nhất (80,12%) được ghi nhận ở ấu trùng N1 được thu thập từ tôm bố mẹ được cho ăn bằng khẩu phần D2. Khả năng chịu đựng stress thấp nhất (70,19%) được ghi nhận ở ấu trùng N5 được thu thập từ tôm bố mẹ đối chứng âm tính. (Bảng 8).
Ước tính lipid
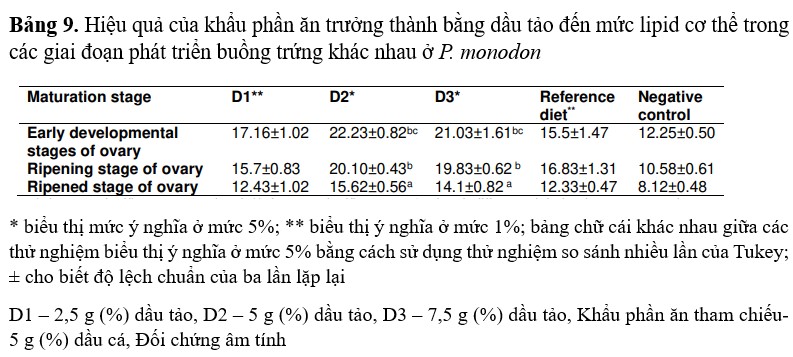
Tôm được cho ăn bằng khẩu phần thử nghiệm (D2) có mức lipid trong cơ thể cao hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Mức lipid cao nhất (22,23%) được ghi nhận ở giai đoạn đầu của quá trình phát triển buồng trứng ở tôm được cho ăn bằng khẩu phần D2. Mức lipid thấp nhất (15,62%) được ghi nhận ở giai đoạn thành thục của quá trình phát triển buồng trứng ở tôm đối chứng. (Bảng 9).
Xét nghiệm hoạt tính Prophenol Oxidase
Các vi khuẩn Aeromonas sp., Vibrio harveyi và Vibrio parahaemolyticus được tiêm vào hemolymp của tôm có kích thước nhóm 251-300 g. Xét nghiệm enzyme prophenol được tiến hành trong hemolymp ở các khoảng thời gian khác nhau từ 10 phút đến 60 phút. Độ hấp thụ quang phổ của phenoloxidase trong hemolymp được thực hiện cứ sau 10 giây. Kết quả cho thấy hoạt tính enzyme tăng dần đối với tất cả các tác nhân gây bệnh khi tăng thời gian tiêm. Sau 1 giờ tiêm, Vibrio harveyi cho thấy hoạt tính enzyme prophenoloxidase cao nhất (0,1085±0,046), tiếp theo là Vibrio parahaemolyticus (0,0952±0,068) và Aeromonas sp. (0,0864±0,078). Ở tôm được cho ăn theo khẩu phần ăn tham chiếu, hoạt tính enzyme prophenoloxidase cao nhất đối với Vibrio harveyi là 0,1076±0,058, tiếp theo là Vibrio parahaemolyticus (0,0891±0,075) và Aeromonas sp. (0,0859±0,078). Ở tôm đối chứng âm tính, hoạt tính enzyme prophenoloxidase thấp nhất đối với Vibrio harveyi là 0,0242±0,036, tiếp theo là Vibrio parahaemolyticus (0,0212±0,021) và Aeromonas sp. (0,0181±0,028).
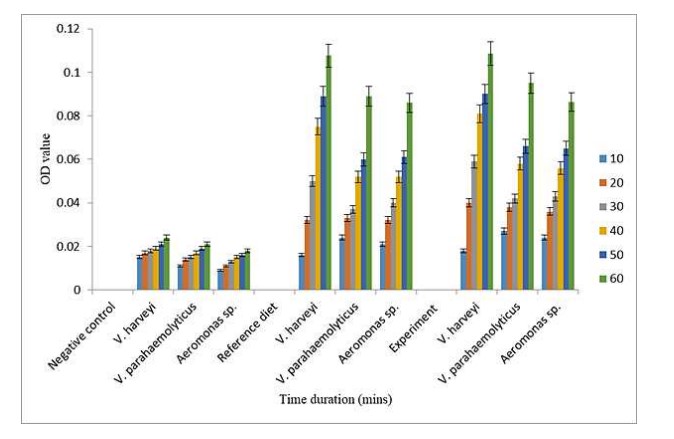
Hình 4. Hoạt tính prophenol oxidase trong hemolymp của P. monodan sau khi cảm nhiễm với vi khuẩn gây bệnh
Thảo luận
Tôm được cho ăn bằng khẩu phần thử nghiệm có lượng thức ăn ăn vào cao hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Điều này chứng tỏ hiệu quả của khẩu phần thử nghiệm trong việc kích thích tôm ăn nhiều hơn. Tần suất lột xác ở tôm được cho ăn bằng khẩu phần thử nghiệm cao hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Điều này chứng tỏ khẩu phần thử nghiệm có ảnh hưởng đến tần suất lột xác của tôm, bất kể kích thước của tôm. Hormon chịu trách nhiệm cho quá trình lột xác có thể được kích hoạt do ảnh hưởng của các yếu tố trong dầu tảo.
Tôm được cho ăn bằng khẩu phần thử nghiệm có thời gian phát triển buồng trứng ngắn hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Kích thước của tôm cũng ảnh hưởng đến thời gian phát triển buồng trứng, với những con tôm lớn hơn có thời gian phát triển ngắn hơn. Tôm được cho ăn bằng khẩu phần thử nghiệm có thời gian trưởng thành của buồng trứng ngắn hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Kích thước của tôm cũng ảnh hưởng đến thời gian trưởng thành của buồng trứng, với những con tôm lớn hơn có thời gian trưởng thành ngắn hơn. Tôm được cho ăn bằng khẩu phần thử nghiệm có tỷ lệ vón cục thấp hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Tỷ lệ vón cục tăng theo lần sinh sản, nhưng vẫn thấp hơn ở tôm được cho ăn bằng khẩu phần thử nghiệm so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng.
Tổng số trứng trong một khẩu phần thí nghiệm là 2,9 triệu, nhưng đối với khẩu phần tham chiếu và đối chứng âm tính, tổng số trứng chỉ lần lượt là 1,63 và 1,10 triệu. Tôm được cho ăn bằng khẩu phần thử nghiệm có thể sinh sản 4 lần sau khi cắt mắt, trong khi tôm được cho ăn bằng khẩu phần tham chiếu và đối chứng chỉ có thể sinh sản 3 lần. Khoảng cách thời gian giữa hai lần sinh sản liền kề ở tôm được cho ăn bằng khẩu phần thử nghiệm ngắn hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng.
Chất lượng trứng của tôm được cho ăn bằng khẩu phần thử nghiệm tốt hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Tỷ lệ ấu trùng dị dạng ở tôm được cho ăn bằng khẩu phần thử nghiệm thấp hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Tỷ lệ thụ tinh và tỷ lệ nở ở tôm được cho ăn bằng khẩu phần thử nghiệm cao hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng.
Hệ số thành thục ở tômcao được cho ăn bằng khẩu phần thử nghiệm so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Chỉ số này giảm ở lần sinh sản tiếp theo, nhưng vẫn cao hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng.Tỷ lệ chuyển đổi giai đoạn ở ấu trùng thu được từ tômđược cho ăn bằng khẩu phần thử nghiệm cao hơn so với ấu trùng thu được từ tômđược cho ăn bằng khẩu phần tham chiếu hoặc đối chứng.
Một cách khác để xác định khả năng sinh sản thành công của bất kỳ khẩu phần ăn thành thục nào là nghiên cứu chất lượng ấu trùng thu được từ tôm bố mẹ, được cho ăn bằng khẩu phần ăn trưởng thành và bằng tỷ lệ chuyển đổi giai đoạn (N1-Z1). Chất lượng ấu trùng thu được từ tôm được cho ăn bằng khẩu phần thử nghiệm cao hơn so với ấu trùng thu được từ tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Tỷ lệ sống của ấu trùng thu được từ tôm được cho ăn bằng khẩu phần thử nghiệm cao hơn so với ấu trùng thu được từ tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng.
Tỷ lệ sinh sản (hoặc) tỷ lệ phóng trứng ra khỏi buồng trứng phụ thuộc vào tình trạng thể chất, mức độ căng thẳng của tôm, tính chất của môi trường sinh sản cũng như mức độ lipid trong cơ thể. Khẩu phần thí nghiệm này làm tăng tỷ lệ sinh sản so với khẩu phần đối chứng và khẩu phần đối chứng âm tính. Khoảng trống trong buồng trứng là một loại vấn đề quan trọng khác được quan sát thấy ở tôm. Tôm được cho ăn bằng khẩu phần thử nghiệm có số lượng khoảng trống trong buồng trứng ít hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng.
Mức lipid trong cơ thể ở động vật thí nghiệm, khẩu phần tham chiếu và động vật đối chứng âm tính trong các giai đoạn phát triển khác nhau của buồng trứng đã được nghiên cứu. Tôm được cho ăn bằng khẩu phần thử nghiệm có mức lipid trong cơ thể cao hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng.
Tôm được cho ăn bằng khẩu phần thử nghiệm có hoạt tính prophenoloxidase cao hơn so với tôm được cho ăn bằng khẩu phần tham chiếu hoặc đối chứng. Dầu tảo chứa hàm lượng LC-PUFA cao (axit docosahexaenoic và axit arachidonic) sẽ cải thiện đáng kể các thông số miễn dịch như tổng số lượng tế bào máu, hoạt tính phenoloxidase, hoạt tính superoxide dismutase và hoạt tính diệt khuẩn ở giai đoạn tôm post Litopenaeus vannamei, do đó dẫn đến tỷ lệ sống được cải thiện trước tình trạng nhiễm V. harveyi.
Kết luận
Nghiên cứu này cho thấy khẩu phần ăn trưởng thành bổ sung dầu tảo giúp cải thiện sức khỏe tôm bố mẹ, nâng cao khả năng sinh sản thành công. Nhờ vậy, số lượng tôm bố mẹ cần thiết trong trại sản xuất giống có thể giảm thiểu, giúp tiết kiệm chi phí hoạt động. Việc sử dụng khẩu phần ăn này cũng góp phần bảo vệ nguồn lợi tôm tự nhiên bằng cách giảm nhu cầu khai thác tôm bố mẹ hoang dã. Ngoài ra, nghiên cứu còn chứng minh rằng khẩu phần ăn trưởng thành bổ sung dầu tảo giúp đáp ứng nhu cầu năng lượng cao của tôm bố mẹ trong quá trình sinh sản. Do đó, đây là một giải pháp hiệu quả để phát triển tôm giống thành công trong trại giống tôm.
Theo Selvaraj Soniya, Michaelbabu Serine Michael, Thavasimuthuchinakan Mahesh, Thavasimuthu Citarasu, Anantharajan, Mary Josaphinepunitha, Thangaswamy Selvaraj, Mariavincent Michaelbabu
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Một Tập Hợp Bộ Gen Cấp Độ Nhiễm Sắc Thể Mới Của Tôm Thẻ Chân Trắng
- Ảnh Hưởng Của Vỏ Chanh Lên Men Như Một Chất Phụ Gia Thức Ăn Chức Năng Lên Sự Tăng Trưởng, Đáp Ứng Miễn Dịch Không Đặc Hiệu Và Khả Năng Kháng Vibrio alginolyticus Ở Tôm Chân Trắng Litopenaeus vannamei
- Ảnh Hưởng Của Oxy Hòa Tan Siêu Bão Hòa Đến Sự Biểu Hiện Gen Liên Quan Đến Tăng Trưởng, Tỷ Lệ Sống Và Miễn Dịch Của Tôm Thẻ Chân Trắng (Litopenaeus vannamei)

 English
English