Kỹ Thuật Nuôi, Tin tức
Ảnh Hưởng Của Mật Độ Thả Giống Khác Nhau Của Ấu Trùng Tôm Biển Litopeneaus Vannamei Đến Chất Lượng Nước Sử Dụng Công Nghệ Biofloc
TÓM TẮT
Cần phải phát triển khẩu phần ăn cho tôm nuôi ở Ai Cập trong các hệ thống nuôi khác nhau để cung cấp đủ protein cho sản xuất tôm đồng thời giảm thiểu lượng nitơ đưa vào môi trường nuôi. Công nghệ Biofloc (BFT) là ứng dụng mới trong việc duy trì chất lượng nước tốt và hiệu suất tăng trưởng của tôm nuôi. Một nghiên cứu đã được thực hiện để nghiên cứu ảnh hưởng của ba mật độ thả khác nhau và nguồn carbon (bã mía) với biofloc và hệ thống đối chứng (khẩu phần thương mại 38% CP) ở tôm thẻ chân trắng Litopeneaus vannamei đến chất lượng nước. Tôm được thả với các mật độ khác nhau trong 18 bể với tỷ lệ (12, 14 và 16 ấu trùng/L) với thể tích nước 150 L trong 90 ngày. 3 nhóm tôm (0,002 g) được cho ăn 3 lần/ ngày với tỷ lệ 14% trọng lượng cơ thể và điều chỉnh dần đến 5% khi kết thúc thí nghiệm. Kết quả nghiên cứu cho thấy, các thông số chất lượng nước (nhiệt độ, độ mặn, PH, tổng nitơ amoniac (TAN), nitrit (NO2), nitrat (NO3), phốt phát (PO4), tổng chất rắn lơ lửng (TSS) và khối lượng biofloc (BFV)) đều phù hợp cho nuôi cấy L. vannamei ở các mật độ thả khác nhau trong nghiệm thức đối chứng và biofloc. TSS và BFV cao hơn đáng kể ở nghiệm thức biofloc so với đối chứng và đặc biệt ở mật độ thả thứ ba (16 ấu trùng BF/L). Việc bổ sung bã mía làm nguồn carbon vào nuôi cấy L. vannamei có thể làm tăng hiệu quả hoạt động của vi khuẩn chu trình nitơ, có thể làm giảm hàm lượng nitơ vô cơ và tăng dần cả TSS và BFV.
GIỚI THIỆU
Nuôi trồng thủy sản vẫn đang dẫn đầu trong việc ứng dụng công nghệ thâm canh nhằm tăng sản lượng, đáp ứng nhu cầu protein của người dân. Tuy nhiên, mô hình này cũng gây ra những tác động tiêu cực đến môi trường, như làm giảm chất lượng nước, gia tăng dịch bệnh và giảm năng suất. Vì vậy, các công nghệ giảm thiểu tác động đến môi trường và tỷ lệ mắc bệnh là rất cần thiết. Việc sử dụng các sản phẩm tự nhiên khác nhau trong nuôi trồng thủy sản làm chất kích thích miễn dịch đã được báo cáo là có hiệu quả trong việc giảm các triệu chứng bệnh tật và tăng sản lượng trong nuôi cá và tôm (Manoppo và cộng sự 2015; Sharawy và cộng sự 2020). Nhiều nghiên cứu cũng tập trung vào việc sử dụng các cây thuốc và gia vị để ngăn ngừa bệnh tật và thúc đẩy tăng trưởng như gừng, tỏi, v.v. (Nya và Austin 2009; Manoppo và cộng sự 2016; và Payung và cộng sự 2017). Ứng dụng biofloc là một giải pháp thay thế đầy hứa hẹn khác và vẫn đang được phát triển. Hệ thống biofloc được sử dụng ở Indonesia để nuôi cá da trơn, cá rô phi và tôm, đặc biệt là tôm thẻ chân trắng Litopenaeus vannamei với mật độ cao (Azim và Little. 2008; Ekasari 2009; và Hermawan và cộng sự 2014).
Một số chuyên gia đã đưa ra một số định nghĩa về khái niệm công nghệ biofloc. Crab và cộng sự (2012) cho rằng công nghệ biofloc là kỹ thuật cải thiện chất lượng nước cho hoạt động nuôi trồng thủy sản bằng cách bổ sung nguồn carbohydrate từ bên ngoài thông qua thức ăn. Theo Aiyushirota (2009), biofloc là một phương pháp xử lý nước thải sinh học kích hoạt bùn, trong khi Ekasari (2009) cho rằng công nghệ biofloc là sự chuyển đổi nitơ vô cơ, đặc biệt là amoniac, thành sinh khối vi sinh vật bởi vi khuẩn dị dưỡng, sau đó có thể được tiêu thụ bởi các sinh vật nuôi. Biofloc xử lý chất liên tục được tạo ra từ các hoạt động nuôi trồng thủy sản có hàm lượng dinh dưỡng cao, có khả năng gây hại cho hệ sinh thái (Riani và cộng sự 2012).
Một số yếu tố giúp hệ thống biofloc hiệu quả hơn so với các hệ thống thông thường bao gồm giảm sử dụng thức ăn, ngăn ngừa lây lan dịch bệnh bằng cách giảm thiểu thay nước thân thiện với môi trường. Biofloc rất quan trọng trong việc cải thiện chất lượng nước và ngăn ngừa tỷ lệ mắc bệnh (Choo và Caipang 2015; Nurhatijah và cộng sự 2016). Cadiz và cộng sự (2016) nhận thấy rằng việc sử dụng biofloc có thể kiểm soát sự hiện diện của Vibrio sp. và Vibrio parahaemolyticus trong nuôi thâm canh tôm thẻ chân trắng L. vannamei. Vì vậy, biofloc có thể được áp dụng ở nuôi trồng thủy sản với mật độ cao (Hargreaves 2013). Nhìn chung, protein chỉ được tiêu thụ khoảng 20-25% trong thức ăn cho cá, phần còn lại sẽ được bài tiết qua chất thải và thức ăn thừa có chứa amoniac và nitơ hữu cơ. Để kích thích sự phát triển của vi khuẩn dị dưỡng và biến nitơ vô cơ thành protein vi sinh vật, cần phải điều chỉnh tỷ lệ C:N trong môi trường nuôi trồng thủy sản (Avnimelech 1999).
Về mặt lý thuyết, việc bổ sung các nguồn carbon với sự gia tăng tỷ lệ C:N có thể làm tăng quá trình chuyển đổi các loại nitơ vô cơ độc hại thành sinh khối vi sinh vật có sẵn làm thức ăn cho vật nuôi. Tỷ lệ C:N tối ưu trong hệ thống nuôi trồng thủy sản có thể được duy trì bằng cách bổ sung nhiều nguồn carbon rẻ tiền hoặc giảm hàm lượng protein trong thức ăn (Avnimelech 1999; Hargreaves 2006). Việc sử dụng biofloc là rất cần thiết để sản xuất nuôi trồng thủy sản thân thiện với môi trường.
Mục tiêu chính của dự án là đánh giá ảnh hưởng của các mật độ thả ấu trùng tôm biển khác nhau đến chất lượng nước theo công nghệ biofloc.
NGUYÊN LIỆU VÀ PHƯƠNG PHÁP
Ấu trùng L.vannamei được lấy từ một trại giống tôm thương mại ở Burj Al-Arab, Alexandria, Ai Cập. Tôm được vận chuyển trong túi polythene hai lớp có oxy. Khi tôm đến phòng thí nghiệm, chúng được chuyển vào bể thích nghi chứa đầy nước biển (độ mặn 32 ppt). Mẫu ban đầu được lấy ngay sau khi ấu trùng được lấy từ trại giống và mẫu cuối cùng được lấy từ mỗi bể khi kết thúc thí nghiệm để phân tích hóa học. Trước khi bắt đầu thí nghiệm, tôm được thích nghi với điều kiện phòng thí nghiệm trong hai tuần và cho ăn 2 lần mỗi ngày bằng thức ăn thương mại (38% Protein thô, 10% Lipid, 3,1% Chất xơ, 19% carbohydrate).
Thí nghiệm được thực hiện trên 18 bể có thể tích nước 150 L trong phòng thí nghiệm động vật không xương sống, Viện Hải dương học và Thủy sản Quốc gia (NIOF), Suez, Ai Cập. Các bể chứa đầy nước biển sau khi được lọc bằng lưới sinh vật phù du (50µm) để ngăn chặn sự xâm nhập của các vật liệu không mong muốn và các hạt lơ lửng vào bể và được pha loãng với nước ngọt để đạt độ mặn (32 ppt). Tất cả các bể đều được cung cấp hệ thống khuếch tán 4 ống dẫn khí bằng đá được lắp vào máy thổi khí (220w). Sục khí được cung cấp 24 giờ trong suốt thí nghiệm để đảm bảo quá trình kết tụ sinh học tốt hơn. Biofloc được sản xuất trong một bể (200 L) sử dụng nước từ ao nuôi tôm làm chất cấy và sử dụng bã mía (SB) làm nguồn carbon theo Avnimelech, (1999). Huyền phù được ủ trong hai tuần để phát triển cộng đồng vi sinh vật. Thành phần gần đúng và hàm lượng carbon hữu cơ trong bã mía được xác định theo AOAC (1995) và Jackson (1967) tương ứng như trong Bảng (1).
Bảng (1): Phân tích thành phần hóa học % trong bã mía.

Tất cả các bể luôn được che bằng tấm nhựa để giảm tôm thoát ra ngoài. Trong các bể đại diện cho hệ thống đối chứng, nước được thay 2 lần/ tuần. Trong khi bể biofloc được duy trì trong 90 ngày mà không thay nước (không thay nước), ngoại trừ để bù cho sự bốc hơi.
Sau hai tuần, tất cả các bể đều được thả ấu trùng tôm với ba mật độ thả tôm khác nhau (12, 14 và 16 Ấu trùng/L) trong mỗi bể (x3). Trước khi thả tôm, chúng tôi cân tôm và trọng lượng cơ thể ban đầu (Trung bình 0,002g). Tôm được cho ăn khẩu phần thí nghiệm ở mức 14% trọng lượng cơ thể và điều chỉnh giảm dần xuống 5% khi kết thúc thí nghiệm. Khẩu phần ăn hàng ngày cho mỗi nghiệm thức được tính toán và điều chỉnh bằng cách ước tính sinh khối trung bình được lấy mẫu 2 tuần/ lần. Khẩu phần được chia làm 3 lần/ngày và SB đã cân trước được trộn hoàn toàn vào cốc thủy tinh chứa mẫu nước bể và rải đều lên bề mặt bể. Trong các nghiệm thức xử lý bằng biofloc, tỷ lệ C:N được duy trì ở mức 16:1 để kích hoạt sự phát triển của vi khuẩn, tuy nhiên, tỷ lệ này được tính toán gần đúng dựa trên hàm lượng carbon và nitơ trong thức ăn đầu vào hàng ngày và nguồn carbon bổ sung trong bể biofloc.
Để duy trì chất lượng nước ở mức tối ưu cho tôm, các thông số sau đây đã được theo dõi trong quá trình thí nghiệm để theo dõi tác động của hệ thống biofloc và so sánh với hệ thống đối chứng.
Các thông số hàng ngày: nhiệt độ nước (°C) được đo hàng ngày vào lúc 13h00, độ mặn và pH được đo hàng ngày vào lúc 10h00 bằng máy phân tích đa thông số.
Các thông số được đo 2 tuần/ lần: mẫu nước (100ml) được lấy từ mỗi bể và lọc qua giấy lọc để phân tích tổng nitơ amoni (TAN), tổng chất rắn lơ lửng (TSS), nitrit-N (NO2-N), nitrat-N (NO3-N). ) và photphat-P (PO4-P) bằng mô hình máy quang phổ (JENWAY 6100). Khối lượng biofloc được ước tính hàng tuần bằng cách sử dụng nón Imhoff, đo thể tích biofloc trong 1000 mL nước bể sau 15-20 phút lắng (Avnimelech và Kochba, 2009).
Tất cả các biến được đo ở các thông số chất lượng nước để xác định ảnh hưởng của mật độ thả khác nhau (12, 14 và 16 ấu trùng/L) đến hiệu suất tăng trưởng và ảnh hưởng của nguồn carbon (bã mía) trong hệ thống biofloc. Phân tích ANOVA được thực hiện bằng chương trình SAS v9.0.0 (2004). ANOVA được theo sau bởi thử nghiệm Duncan (1955) ở mức có ý nghĩa P <0, 05.
KẾT QUẢ VÀ THẢO LUẬN
Các thông số chất lượng nước hàng ngày như nhiệt độ, độ mặn và độ pH được theo dõi trong thời gian thử nghiệm được trình bày trong Bảng (2). Nhiệt độ, độ mặn và pH đều ở khoảng tối ưu cho tôm thẻ chân trắng Litopenaeus vannamei. Chúng được thể hiện trong Hình (1), (2) và (3).
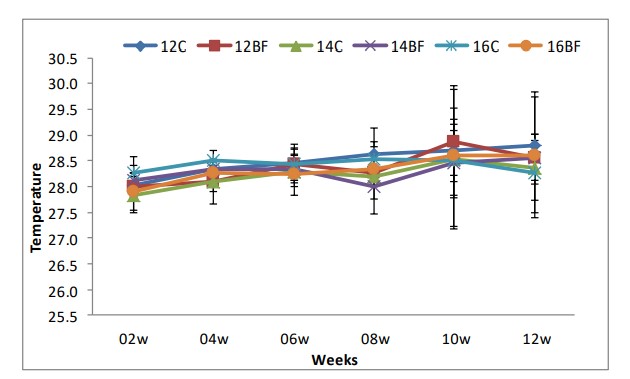
Hình (1): Ảnh hưởng của công nghệ biofloc đến nhiệt độ trong bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
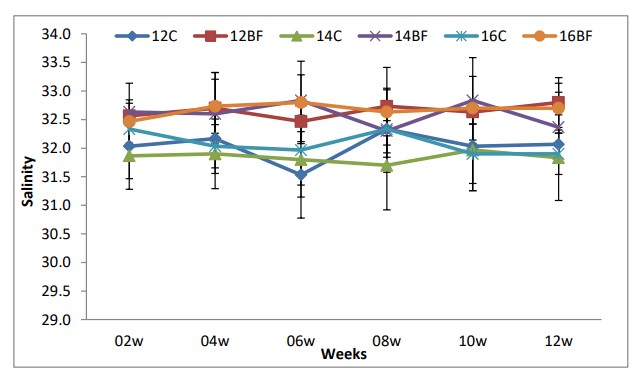
Hình (2): Ảnh hưởng của công nghệ biofloc đến độ mặn trong bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
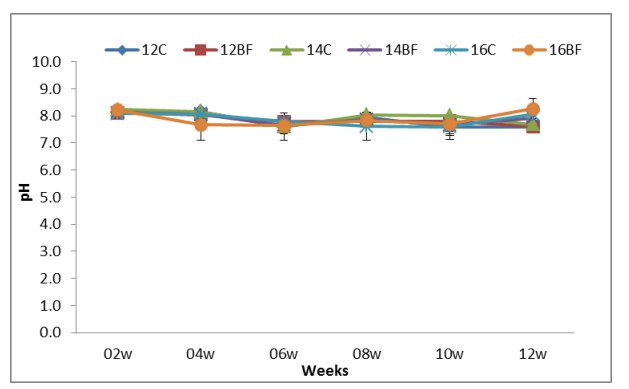
Hình (3): Ảnh hưởng của công nghệ biofloc đến PH trong bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
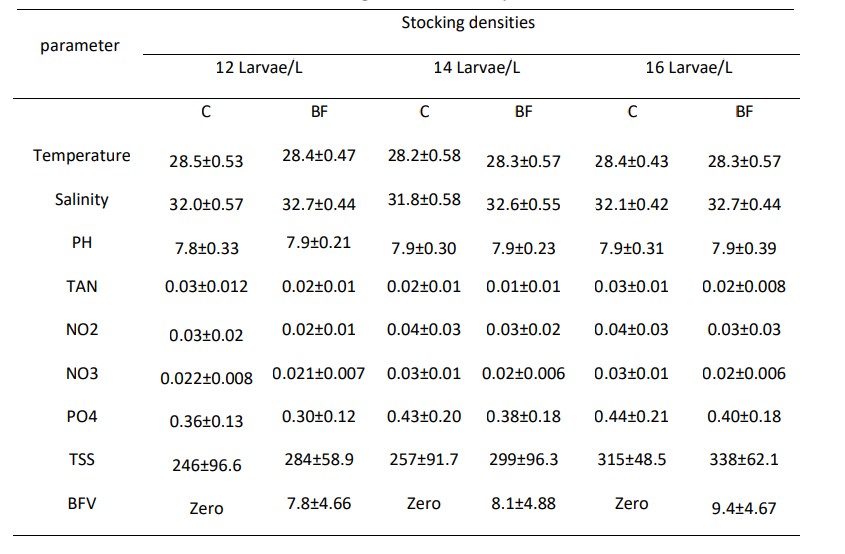
Các thông số chất lượng nước hai tuần một lần; TAN, nitrite-N, nitrat-N, Phosphate, Tổng chất rắn lơ lửng (TSS) và khối lượng Biofloc (BFV) được thể hiện trong Bảng (2). Sự phát triển biofloc về TSS và BFV trong thời gian thử nghiệm (90 ngày) được thể hiện tương ứng trong Hình (8) và (9). Biofloc được quan sát thấy có màu nâu sau tuần thứ ba trong tất cả các nghiệm thức bằng biofloc và bao gồm các hạt hữu cơ lơ lửng ở dạng hạt floc, được một số vi khuẩn dị dưỡng, vi tảo và động vật nguyên sinh xâm chiếm. Trong các phương pháp xử lý bằng biofloc, BFV và TSS dao động lần lượt từ 7,8±4,66 đến 9,4±4,67 ml/L và 284±58,9 đến 338±62,1 mg/L. Hiệu quả của việc bổ sung các nguồn carbon trong khẩu phần thí nghiệm làm giảm tổng lượng nitơ amoniac (TAN), nitrit-N (NO2), nitrat-N (NO3) và Phốt phát (PO4) lần lượt trong khoảng từ 0.01±0.01 đến 0.02±0.01, 0.02±0.01 đến 0.03±0.03, 0.021±0.007 đến 0.02±0.006 và 0.30±0.12 đến 0.40±0.18 trong tất cả các nghiệm thức bằng biofloc. Kết quả về nồng độ tổng nitơ amoniac (TAN), nitrit-N (NO2), nitrat-N (NO3) và Phosphate (PO4) lần lượt được thể hiện ở Hình (4), (5), (6) và (7).
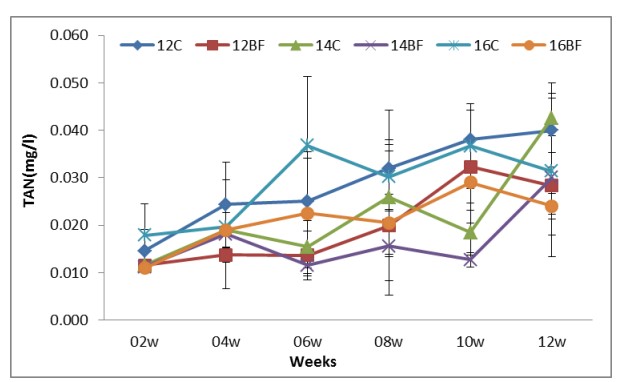
Hình (4): Ảnh hưởng của công nghệ biofloc đến TAN trong các bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
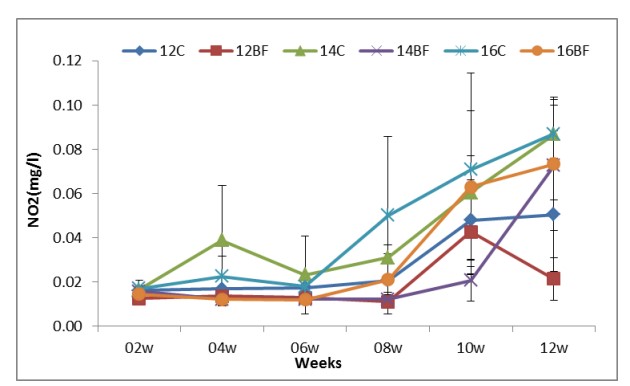
Hình (5): Ảnh hưởng của công nghệ biofloc đến NO2 trong bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
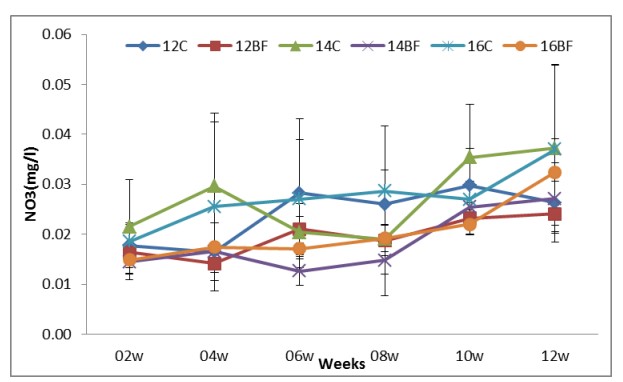
Hình (6): Ảnh hưởng của công nghệ biofloc đến NO3 trong các bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
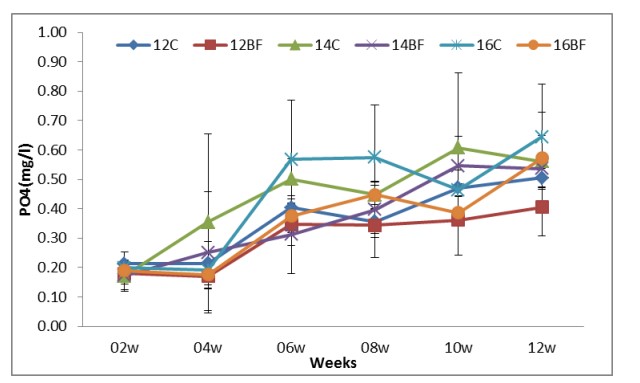
Hình (7): Ảnh hưởng của công nghệ biofloc đến PO4 trong các bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
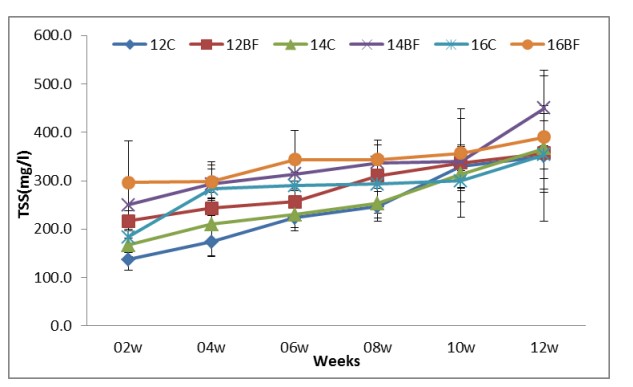
Hình (8): Ảnh hưởng của công nghệ biofloc đến sự phát triển TSS trong các bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
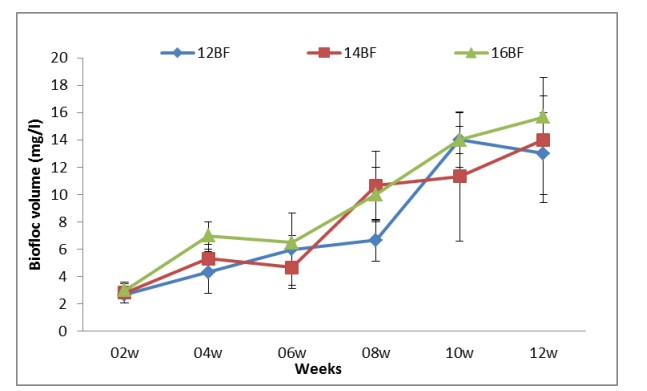
Hình (9): Ảnh hưởng của công nghệ biofloc đến sự phát triển của BFV trong bể thí nghiệm của L. vannamei ở các mật độ thả khác nhau trong 90 ngày.
Bảng (2): Ảnh hưởng của công nghệ biofloc đến chất lượng nước (Trung bình±SD) trong các bể thí nghiệm nuôi tôm thẻ chân trắng L. vannamei với mật độ thả khác nhau trong 90 ngày.
Công nghệ bioflocs nhằm mục đích cải thiện chất lượng nước trong các hệ thống nuôi trồng thủy sản bằng cách kết hợp cẩn thận carbon và nitơ. Trong nghiên cứu này, tác động của công nghệ biofloc đối với tôm thẻ chân trắng (L. vannamei) ở các mật độ bảo quản khác nhau (12, 14 và 16 ấu trùng/L) và một nguồn carbon (bã mía) đã được nghiên cứu. Trong thời gian thử nghiệm (90 ngày), không có sự khác biệt đáng kể về nhiệt độ và độ mặn giữa nghiệm thức đối chứng và nghiệm thức biofloc và ở phạm vi tối ưu cho tôm thẻ chân trắng L. vannamei. Ở vùng khí hậu ôn đới và cận nhiệt đới, quần thể L. vannamei bị ảnh hưởng nặng nề bởi nhiệt độ thấp. Nhiệt độ thấp có thể hạn chế sự phát triển của tôm và gây chết tôm trong những tháng lạnh nhất (Peixoto và cộng sự 2003). Trong quá trình xử lý bioflocs, độ pH trong quá trình xử lý biofloc thấp hơn một chút so với phạm vi được coi là tối ưu và sau đó được điều chỉnh nhiều lần. Trong nghiên cứu hiện tại, giá trị pH của tôm He nằm trong phạm vi ưu tiên. Việc tăng tỷ lệ C:N trong xử lý biofloc đã dẫn đến giảm độ pH trong các nghiệm thức này do tăng sản xuất CO2 do sinh khối vi khuẩn dị dưỡng cao hơn (Xu và cộng sự, 2016).
Kết quả của chúng tôi được hỗ trợ bởi Hussain và cộng sự (2015) đã phát hiện ra rằng mức độ ngày càng tăng của tỷ lệ C:N (16:1) trong bể biofloc đã ảnh hưởng đáng kể đến giá trị pH trong thời gian nuôi bằng cách giữ chúng ít nhiều không đổi. Điều này có thể liên quan đến sự hiện diện của vi khuẩn dị dưỡng tiêu thụ chất hữu cơ và làm tăng hàm lượng cacbon vô cơ trong nước (CO2) và làm giảm giá trị pH. Tuy nhiên, độ pH thường giảm khi thế oxy hóa khử giảm do hoạt động của vi sinh vật (Ritvo và cộng sự, 1998). Ebeling và cộng sự (2006) cho rằng sự hấp thụ nitơ bằng quá trình dị dưỡng có khả năng chiếm ưu thế trong hệ thống BFT tiêu thụ độ kiềm bằng một nửa so với quá trình nitrat hóa (3,57g độ kiềm/g NH4+-N). Họ cũng kết luận rằng vì nồng độ kiềm liên quan đến khả năng đệm của nước, nên ảnh hưởng của nồng độ CO2 cao do sinh vật nuôi cấy và hô hấp của vi sinh vật lên độ pH của nước có thể được đệm đầy đủ trong hệ thống BFT.
Avnimelech và cộng sự (2012) đã báo cáo rằng thể tích hạt floc (FV) và tổng chất rắn lơ lửng (TSS) là những chỉ số thực sự của sự hình thành biofloc. Trong nghiên cứu này, sự phát triển của biofloc về khối lượng biofloc (BFV) và tổng chất rắn lơ lửng (TSS) trong thời gian thử nghiệm được giữ trong phạm vi chấp nhận được và các nghiệm thức biofloc ghi nhận BFV và TSS cao hơn đáng kể so với đối chứng. Bã mía có nhiều chất xơ và ít hòa tan nên hiệu quả kém trong biofloc.
Các kết quả này tương tự như kết quả của Rajkumar và cộng sự (2016) nghiên cứu đã phát hiện ra rằng TSS nằm trong mức khuyến nghị <500 mg/L đối với tôm He (Samocha và cộng sự, 2007). Một số tác giả đã chỉ ra rằng xu hướng nồng độ TSS tương tự có lợi cho tôm và sự ổn định của hệ thống (De Schryver và cộng sự2008; Baloia và cộng sự, 2013).
Sự hình thành và phát triển của biofloc trong nước xử lý BFT có thể liên quan đến sự đồng hóa trực tiếp các chất nitơ hòa tan (đặc biệt là amoniac-nitơ) từ khẩu phần ăn và bài tiết của tôm bởi vi khuẩn dị dưỡng (Avnimelech, 1999; Schneider và cộng sự, 2005; Ebeling và cộng sự, 2006), đồng thời, chất lượng nước, đặc biệt là hàm lượng TAN và NO2-N thấp, có thể được duy trì trong phạm vi khuyến nghị cho nuôi tôm do bổ sung nguồn carbon (Xu và cộng sự, 2012).
Trong kết quả của chúng tôi, nồng độ TAN và NO2 ở nghiệm thức biofloc thấp hơn so với đối chứng (p<0,05), điều này cũng được các nhà nghiên cứu khác như Gaona và cộng sự (2011) xác nhận. Các nghiên cứu đã chỉ ra rằng việc bổ sung carbohydrate vào hệ thống nuôi tôm không thay nước có thể làm tăng hiệu quả hoạt động của vi khuẩn chu trình nitơ, do đó có thể làm giảm mức nitơ vô cơ.
Bằng cách thêm carbohydrate vào nước và điều chỉnh tỷ lệ C:N, sự đồng hóa chất dinh dưỡng của vi khuẩn dị dưỡng và sự hình thành biofloc có thể được tối ưu hóa, từ đó dẫn đến việc loại bỏ TAN và NO2 (Avnimelech, 1999). Nguồn carbon hữu cơ được lựa chọn sẽ quyết định phần lớn thành phần của khối được tạo ra, xem xét loại và lượng polyme lưu trữ (De Schryver và cộng sự 2008), và những phát hiện này phù hợp với kết quả của chúng tôi.
Cấu trúc cộng đồng của biofloc và sự phát triển của nó ảnh hưởng đến quá trình đồng hóa chất chuyển hóa và chu trình dinh dưỡng của vi sinh vật, tạo ra các động lực chất lượng nước khác nhau trong hệ thống nuôi. Trong nghiên cứu này, tác dụng của việc bổ sung nguồn carbon vào khẩu phần thí nghiệm là làm giảm đáng kể tổng nitơ amoniac (TAN) và nitrit (NO2) trong tất cả các nghiệm thức biofloc. Nồng độ TAN cao hơn đáng kể (P<0,05) ở nhóm đối chứng. Kết quả của chúng tôi được hỗ trợ bởi Wasielesky và cộng sự (2013), người đã phát hiện ra rằng nồng độ tổng amoniac được duy trì ở mức thấp trong suốt thí nghiệm, điều này rất có thể là do sự phát triển của cộng đồng vi sinh vật được thiết lập trong nước nuôi.
Kết quả của chúng tôi cho thấy TAN và NO2-N trong nghiệm thức không có biofloc (đối chứng) ở phạm vi tối ưu cho tôm thẻ chân trắng L. vannamei, do thay nước 2 lần/ tuần trong thời gian thử nghiệm. Những kết quả này cho thấy rằng một khi cộng đồng biofloc trưởng thành được thiết lập trong nước nuôi, nồng độ TAN và NO2-N có thể được kiểm soát một cách hiệu quả bằng quá trình đồng hóa dị dưỡng (ví dụ, đồng hóa TAN thành nitrit và sau đó thành nitrat), duy trì chúng ở phạm vi chấp nhận được đối với nuôi tôm.
Kết quả hiện tại về nồng độ TAN và NO2 ở nghiệm thức biofloc thấp hơn so với đối chứng (P<0,05), điều này cũng được các nhà nghiên cứu khác (Gaona và cộng sự, 2011; Kuhn và cộng sự, 2009; Wasielesky và cộng sự, 2013) đã quan sát thấy rằng việc bổ sung carbon đã nâng cao tỷ lệ loại bỏ TAN ở mức 26% mỗi giờ so với 1% mỗi giờ trong hệ thống đối chứng.
Hussain và cộng sự (2015) nhận thấy rằng nồng độ amoniac và nitrit trong bể biofloc giảm khi tỷ lệ C:N (16:1) tăng lên. Kết quả này cho thấy rằng việc bổ sung nguồn carbon có tác động rõ rệt đến việc giảm nitơ vô cơ thông qua việc kích thích sự phát triển của vi khuẩn.
Nhìn chung, các thông số chất lượng nước, đặc biệt là amoniac, nitrit và tổng lượng nitơ amoniac là những yếu tố hạn chế chính đối với tỷ lệ sống của tôm (Santacruz Reyes và Chien, 2012). Tăng trưởng và tỷ lệ sống tốt hơn có thể là do giảm sản xuất các chất chuyển hóa độc hại thông qua kết tủa sinh học trong hệ thống không thay nước hoặc với tỷ lệ thấp, do bổ sung nguồn carbon hữu cơ vào hệ thống. Vì vậy, việc bổ sung bã mía làm giảm đáng kể tổng lượng nitơ amoniac so với đối chứng.
Theo Mervat A. M. Ali, H. M. Khuraiba, Nourhan E. G. Elsayed1 and Zaki Z. Sharawy.
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
Xem thêm:
- Tổ Chức Đối Tác Nghề Cá Bền Vững Mong Muốn Giảm Thiểu Tác Động Từ Các Trang Trại Nuôi Tôm Ở Ấn Độ
- Ảnh Hưởng Của Probiotic Loài Bacillus (Bacillus subtilis Và B. licheniformis) Đến Chất Lượng Nước, Phản Ứng Miễn Dịch Và Sức Đề Kháng Của Tôm Chân Trắng (Litopenaeus vannamei) Chống Lại Nhiễm Nấm Fusarium solani
- Sự Phát Triển Trong Việc Sử Dụng Chế Phẩm Sinh Học Để Kiểm Soát Dịch Bệnh Trong Nuôi Trồng Thủy Sản

 English
English