Kỹ Thuật Nuôi, Tin tức
Ảnh Hưởng Của Độ Mặn Lên Sự Lây Nhiễm EHP Trên Tôm Thẻ Chân Trắng Trong Điều Kiện Thí Nghiệm
Tóm tắt
Tổng quan: Enterocytozoon hepatopenaei (EHP) là một mầm bệnh đường ruột ảnh hưởng đến tôm thẻ Penaeus vannamei và Tôm sú Penaeus monodon ở nhiều nước Đông Nam Á. Ở bán cầu tây, EHP lần đầu tiên được báo cáo ở 2016 ở tôm thẻ chân trắng nuôi ở Venezuela. Bằng chứng cho thấy EHP phổ biến trong những ao nuôi thương phẩm có độ mặn cao (> 15 ppt) hơn là những ao nuôi thương phẩm có độ mặn thấp (< 5 ppt). Xét rằng P. vannamei là loài euryhaline (loài sống được ở nhiều mức độ mặn khác nhau), chúng tôi muốn biết liệu EHP có thể sinh sôi trên P. vannamei ở độ mặn thấp hay không.
Kết quả: Trong nghiên cứu này, chúng tôi đã mô tả sự lây nhiễm qua thực nghiệm bằng cách sử dụng các chuỗi phân tôm làm nguồn cấy. P. vannamei sạch bệnh (SPF) được nuôi ở ba độ mặn khác nhau (2 ppt, 15 ppt và 30 ppt), được cảm nhiễm liên tục trong khoảng 3 tuần với phân từ P. vannamei đã nhiễm EHP. Chuỗi phân (được sử dụng làm nguồn cấy EHP trong các thí nghiệm cảm nhiễm) được bổ sung đủ để gây lây nhiễm cho tôm ở ba độ mặn khác nhau. Sự lây nhiễm của EHP trong tôm nuôi ở độ mặn 2 ppt, 15 ppt và 30 ppt đã được kiểm tra bởi PCR và mô bệnh học. Tỷ lệ hiện mắc và mức độ nghiêm trọng của nhiễm trùng EHP cao hơn ở 30 ppt so với 2 ppt và 15 ppt.
Kết luận: Dữ liệu cho thấy rằng các chuỗi phân là nguồn cấy EHP đáng tin cậy để tiến hành thí nghiệm cảm nhiễm qua đường phân-miệng. Nhiễm trùng EHP có thể xảy ra ở độ mặn thấp tới 2 ppt, tuy nhiên, tỷ lệ hiện mắc và mức độ nghiêm trọng của nhiễm trùng EHP cao hơn ở độ mặn 30 ppt.
Từ khóa: Enterocytozoon hepatopenaei, EHP, Độ mặn, Penaeus vannamei
Tổng quan
Bệnh vi bào tử trùng trên gan tụy (HPM) do Enterocytozoon hepatopenaei (EHP) là một bệnh đã được báo cáo ở một số tôm He bao gồm P. monodon và P. vannamei [1, 2]. EHP đã được báo cáo ở các khu vực khác nhau bao gồm các nước Châu Á như Trung Quốc, Indonesia, Malaysia, Việt Nam, Thái Lan và Ấn Độ [3–6]. Gần đây, EHP cũng đã được báo cáo ở bán cầu tây Venezuela [7].
Các dấu hiệu chẩn đoán chính của EHP là chậm phát triển [2, 8] dẫn đến gia tăng sự biến đổi kích thước. Các dây phân trắng nổi trên mặt ao và đường tiêu hóa (đường GI) của tôm có màu trắng cũng liên quan đến EHP [3, 9]. Trong các giai đoạn bệnh nặng hơn, tôm nhiễm EHP thường có biểu hiện mềm vỏ, lờ đờ, giảm lượng thức ăn ăn vào, ruột giữa trống, và gây chết mãn tính.
EHP là một vi bào tử trùng (microsporidium) nội bào gây ra các tổn thương ở các tế bào biểu mô gan tụy (hepatopancreas) (HP). EHP sinh sôi trong tế bào chất của các tế bào bị ảnh hưởng. Mô học của tôm bị nhiễm EHP cho thấy các thể bạch cầu ái kiềm (basophilic inclusion bodies) không thường xuyên hoặc thường xuyên có hoặc không có sự hiện diện của bào tử trong tế bào chất (cytoclasm). Các tổn thương mô học như biểu mô ống tế bào bong tróc từ nhẹ đến nặng thường có sự hiện diện của bào tử trưởng thành. Hơn thế nữa, các bào tử cũng được quan sát thấy trong lòng của ống HP và đường tiêu hóa [2, 9]
Ở các quốc gia nơi EHP đã được báo cáo, chẳng hạn như Ấn Độ, Trung Quốc, Việt Nam và Venezuela, nuôi tôm được thực hiện trong một loạt các điều kiện môi trường bao gồm các vùng biển ven bờ, vùng cửa sông và vùng đất liền. Ví dụ, ở một số bang ở phía đông của Ấn Độ chẳng hạn như Andhra Pradesh, các ao chứa đầy nước giếng khoan lẫn với nước cửa sông, dẫn đến độ mặn của các ao nuôi thương phẩm dao động từ 0 và 30 ppt với độ mặn trung bình khoảng 10 ppt. Ngược lại, ở các bang nằm ở phía tây của nước này, chẳng hạn như Gujarat, độ mặn trong nước ao có thể thay đổi giữa 30 và 44 ppt [10, 11]. Ở bán cầu tây Venezuela, các trang trại nuôi tôm nằm ở hai khu vực. Một trong những khu vực này là hồ Maracaibo nơi độ mặn dao động từ 2 đến 5 ppt. Cái khác khu vực nằm ở phía bắc của đất nước, nơi trang trại nuôi tôm nằm trong môi trường biển có độ mặn từ 20 đến 40 ppt [12].
Xây chuỗi các dữ liệu lại với nhau cho thấy trong cả môi trường có độ mặn cao và thấp, EHP đều hiện diện. Ở những nước này, tỷ lệ mắc EHP dường như cao hơn trong môi trường có độ mặn cao, nhưng không có nghiên cứu nào thể hiện mối quan hệ có thể có giữa độ mặn và sự hiện diện của EHP. Do đó, mục tiêu của nghiên cứu này là so sánh tính ảnh hưởng của EHP bằng cách sử dụng các chuỗi phân làm chất cấy trong ba các độ mặn khác nhau ở các điều kiện thí nghiệm.
Kết quả
Tỉ lệ sống
Tỉ lệ sống cuối cùng cao khi kết thúc cảm nhiễm EHP, dao động từ 90 đến 100%, ở ba độ mặn trong mỗi thử nghiệm cảm nhiễm độc lập (Bảng 1). Tỷ lệ sống trong các nghiệm thức đối chứng là 100% ở tất cả các độ mặn trong hai thí nghiệm thử thách độc lập. Chúng tôi không quan sát thấy bất kỳ dấu hiệu lâm sàng nào ở tôm tiếp xúc với EHP ở 3 độ mặn khác nhau.
|
Thử nghiệm cảm nhiễm |
Thời gian | Tỉ lệ sống cuối (%) | |||||
|
Nghiệm thức EHP 2ppt |
Nghiệm thức đối chứng 2ppt | Nghiệm thức EHP 15ppt | Nghiệm thức đối chứng 15ppt | Nghiệm thức EHP 30ppt |
Nghiệm thức đối chứng 30ppt |
||
|
1 |
20 ngày | 95±7 | 100±0 | 100±0 | 100±0 | 100±0 |
100±0 |
| 2 | 26 ngày | 90±0 | 100±0 | 100±0 | 100±0 | 90±7 |
100±0 |
Bảng 1. Tỉ lệ sống cuối của Tôm thẻ chân trắng được cảm nhiễm với phân có chứa EHP trong hai thử nghiệm cảm nhiễm độc lập ở ba mức độ mặn khác nhau. Dữ liệu được trình bày theo Trung bình (Mean) ± Độ lệch chuẩn (SD)
Định lượng EHP trên các chuỗi phân bằng qPCR.
Các chuỗi phân được thu thập hàng ngày từ các bể nhiễm EHP. Các mẫu chuỗi phân hàng ngày được kiểm tra dương tính với EHP trong cả hai thí nghiệm cảm nhiễm. Trọng lượng trung bình của các chuỗi phân được thêm vào mỗi bể là 1,17 ± 0,52 g và 0,32 ± 0,24 g tương ứng với cảm nhiễm # 1 và # 2.
Số bản sao EHP trong các chuỗi phân được sử dụng như chất cấy cao hơn đáng kể ở cảm nhiễm số 2 (p < 0,05). Số bản sao EHP trong chuỗi phân trong cảm nhiễm #1 là 1,6 × 103 ± 2,1 × 103 bản sao/ ng DNA so với 1,1 × 106 ± 2,0 × 106 bản sao/ ng DNA trong chất cấy của cảm nhiễm #2 (Hình 1)
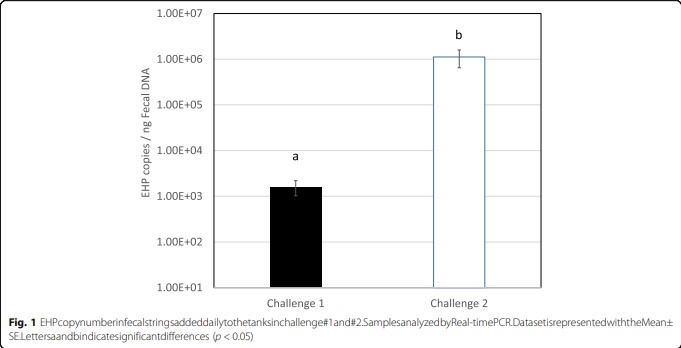
Hình 1. Số lượng bản sao EHP trong chuỗi phân được thêm vào các bể TN#1 và #2. Mẫu được phân tích bằng PCR thời gian thực. Dữ liệu được thể hiện theo Trung bình ± Độ lệch chuẩn.
Kiểm tra mức độ hiện mắc của EHP bằng mô bệnh học
Mức độ hiện mắc và mức độ nghiêm trọng của EHP trên tôm sử dụng dây phân làm chất cấy trong hai thử nghiệm độc lập được đánh giá bằng phương pháp mô học H&E.
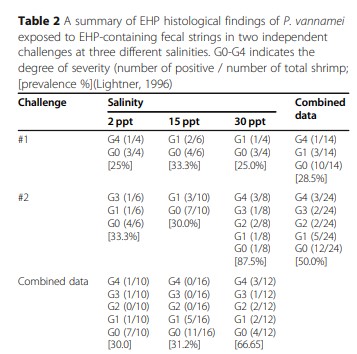
Trong cả hai thử nghiệm, các chuỗi phân được sử dụng như chất cấy có thể gây bệnh ở tôm SPF. Tỷ lệ nhiễm EHP là 28,5% trong TN# 1 so với 50,0% trong TN# 2. Dữ liệu cho thấy chuỗi phân là nguồn chất cấy đáng tin cậy để thực nghiệm lây nhiễm EHP. Tỷ lệ nhiễm EHP ở mức 2 ppt, 15 ppt và 30 ppt trong TN#1 lần lượt là 25, 33,3 và 25%. Trong TN#2, tỷ lệ nhiễm EHP ở 2 ppt, 15 ppt và 30 ppt lần lượt là 33,3, 30,0 và 87,5%. Mức độ nghiêm trọng cao hơn ở độ mặn 30 ppt trong thí nghiệm 2 (Bảng 2).
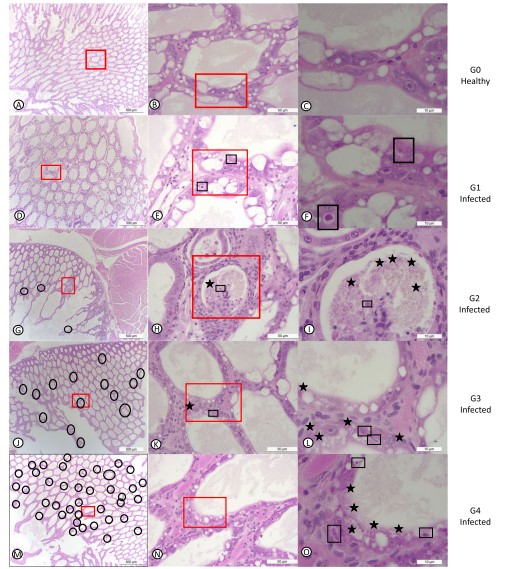
Trong thử nghiệm 2, 50% quần thể bị nhiễm EHP ở 30 ppt bị tổn thương mức G3 (trung bình đến nặng) và G4 (nặng) do nhiễm trùng EHP. Mối liên hệ chặt chẽ giữa độ mặn và tôm nhiễm EHP đã được chứng minh với tỷ lệ OR là 4,3 (p = 0,037). Mức độ hiện mắc của EHP ở tôm tiếp xúc với độ mặn cao (30 ppt) cao hơn so với tôm tiếp xúc với độ mặn thấp (2 ppt và 15 ppt kết hợp). Các mức độ nghiêm trọng khác nhau trong nghiên cứu này được trình bày trong Hình 2. Hình 2 – bảng A, B, và C hiển thị các phần mô của HP ở mức phóng đại thấp, trung bình và cao của tôm khỏe mạnh từ đối chứng mà không có bất kỳ tổn thương mô học nào do EHP hoặc bất kỳ tác nhân gây bệnh đã biết nào khác. Ngược lại, bảng D, E, và F hiển thị các phần mô HP cấp nhiễm G1. Một vùng tiêu điểm trong HP được quan sát (Hình 2d). Các ống bị ảnh hưởng cho thấy các thể vùi bào chất riêng biệt trong tế bào chất của các tế bào ống biểu mô bị ảnh hưởng tương ứng với giai đoạn meront đơn nhân (Hình 2e -f). Hình 2 – bảng G, H, và I cho thấy mức độ nhiễm G2 (thấp đến trung bình). Sự hiện diện tiêu điểm của nhiễm trùng EHP trong một số tế bào biểu mô ống HP bị ảnh hưởng đã được quan sát thấy. Cả hai giai đoạn meront và bào tử giải phóng vào lumen được quan sát (Hình 2i). Hình 2 bảng J, K và L cho thấy mức độ G3 điển hìn. Tổn thương đa diện ở tế bào biểu mô ống HP được quan sát thấy (Hình 2j). Trong các ống bị ảnh hưởng, thường xuyên có sự hiện diện của cả plasmodium đa nhân và các bào tử trong tế bào chất của các tế bào biểu mô dạng hạt (Hình 2l). Hình 2 bảng M, N và O cho thấy cấp độ nhiễm G4 với các ống đa tiêu điểm (multifocal tubules) chứa các tế bào HP bị nhiễm (Hình 2m). Plasmodium đa nhân và các bào tử trong tế bào chất của các tế bào bị ảnh hưởng cũng như các bào tử trong ống lumen được quan sát (Hình 2o)
Bảng 2. Tóm tắt những kết quả mô học của thẻ chân trắng cảm nhiễm với các chuỗi phân có chứa EHP trong hai thử nghiệm độc lập ở các độ mặn khác nhau. G0-G4 cho biết mức độ nhiễm (số lượng dương tính/tổng số tôm); % tỉ lệ mắc (Lightner, 1996)
Hình 2. Nhuộm H&E mô tế bào gan tụy của thẻ cho thấy sự hiện diện của bào tử các giai đoạn khác nhau a-c: G0; d-f:G1, g-i:G2; j-l: G3; m-o: G4. Các bào tử trưởng thành được đánh dấu bằng hình ngôi sao xanh. Những ô chữ nhật đen cho thấy các giai đoạn plasmodium không thường xuyên-thường xuyên. Những vòng tròng đen cho thấy khu vực có EHP. Hình vuông đỏ được phóng đại từ những độ phóng đại thấp hơn. Các thanh đo được đặt ở góc phải mỗi hình.
Phát hiện EHP trên gan tụy bằng PCR
Gan tụy của tôm SPF cảm nhiễm với phân thu được từ tôm dương tính EHP cho kết quả dương tính với EHP. Kết quả này có được từ phương pháp nested-PCR với tất cả các bể tại ba độ mặn khác nhau. Điều này xác nhận sự hiện diện của EHP trong các bể nghiệm thức cảm nhiễm #1 và #2. Ở cả ba độ mặn (2 ppt, 15 ppt và 30 ppt) đã phát hiện thấy EHP. Cũng sử dụng phương pháp nested-PCR với nhóm đối chứng âm tính, mô gan tụy lấy từ các nhóm này ở độ mặn 2 ppt, 15 ppt và 30 ppt cho kết quả âm tính với EHP.
Thảo luận
Kể từ năm 2009, bệnh HPM do EHP gây ra đã nổi lên như một bệnh quan trọng về mặt sinh thái phổ biến ở một số nước sản xuất tôm chính ở Đông Nam Á và gần đây là ở bán cầu tây Venezuela [7]. Ở các nước Đông Nam Á, cùng với bệnh đốm trắng (WSD) và hoại tử gan tụy cấp tính (AHPND), HPM vẫn là một mối đe dọa lớn gây thiệt hại kinh tế đáng kể trong các ao nuôi thương phẩm. Penaeus vannamei là một loài euryhaline có thể nuôi được trong nhiều điều kiện, bao gồm độ mặn cao (30 ppt), môi trường cửa sông (10–20 ppt), và độ mặn thấp (2 ppt) [13].
Trong nghiên cứu này, chúng tôi đã điều tra mức độ hiện mắc và mức độ nghiêm trọng của EHP ở ba độ mặn, cao (30 ppt), trung bình (15 ppt) và thấp (2 ppt), trong phòng thí nghiệm điều kiện cảm nhiễm. Các chuỗi phân, được sử dụng như một nguồn cấy chủng EHP, được bổ sung đủ để gây bệnh cho tôm ở các mức độ mặn khác nhau và được xác định bằng phương pháp mô bệnh học cũng như PCR. Các kết quả từ nghiên cứu này chứng minh một hình thức nhiễm EHP mới thông qua phân dựa trên đường phân – miệng.
Các nghiên cứu trước đây đã chỉ ra một số con đường lây nhiễm như: sống chung (cohabitation) [14, 15], phương pháp reverse gavage và tiêm trực tiếp vào gan tụy chất cấy có EHP [15]. Trong nghiên cứu này, lần đầu tiên chúng tôi báo cáo rằng phân có thể là một con đường truyền nhiễm. Do tập tính ăn nhau và các thức ăn chưa tiêu hóa được lẫn trong phân (khoảng 25–30%) [16], tôm trong các bể nghiệm thức ăn phải những nguồn này cùng với các bào tử EHP, dẫn đến sự lây nhiễm theo phương ngang được quan sát ở cấp trại nuôi.
Những tổn thương do EHP, bao gồm sự hiện diện của plasmodium trong tế bào chất của các tế bào bị nhiễm bệnh và các bào tử trưởng thành trong tế bào chất hoặc bào tử được giải phóng trong ống lumen, được tìm thấy bằng mô bệnh học ở tôm cảm nhiễm EHP được nuôi ở độ mặn khác nhau. Điều này xác nhận rõ ràng EHP là có thể gây nhiễm trùng ở nhiều độ mặn thay đổi từ 2 ppt đến 30 ppt. Khi lượng chất cấy ban đầu được sử dụng trong thử nghiệm thấp (tức là 1 × 103 bản sao EHP / ng của tổng số DNA trong phân), tỷ lệ hiện mắc HPM tương tự nhau (tức là 25%), không phân biệt độ mặn (Xem Bảng 1). Tuy nhiên, sự lây nhiễm của EHP tăng lên ở độ mặn 30 ppt (tỷ lệ mắc 87,5%), so với 15 ppt (tỷ lệ mắc 30,0%) và độ mặn 2 ppt (Tỷ lệ mắc là 33,3%), khi mức chất cấy tăng từ 1 × 103 đến 1 × 106 bản sao EHP / ng của tổng số DNA phân trong cảm nhiễm (tức là TN # 2).
Thử nghiệm cảm nhiễm phụ thuộc vào liều lượng đã được nghiên cứu đối với các mầm bệnh tôm khác như AHPND và Hepatobacter penaei [9, 17]. Trong cảm nhiễm AHPND, liều lây nhiễm 2,0 × 106 CFU / ml gây ra tỷ lệ chết cao (> 90%) trong phương pháp ngâm. Ngược lại, liều thấp hơn (2,0 × 104 CFU / ml) không gây tử vong cũng như tổn thương mô [9]. Trong nghiên cứu này, chất cấy với số lượng bản sao thấp (1,6 × 103 bản sao của EHP / ng của tổng số DNA trong phân) được sử dụng trong TN# 1 gây ra nhiễm trùng nhẹ ở tô. Tuy nhiên, nhiễm trùng nặng (Lớp G3 đến G4) và tỷ lệ mắc cao hơn đã xảy ra trong TN#2 khi số lượng bản sao EHP cao hơn (1,1 × 106 bản sao của EHP / ng của tổng số ADN phân). Các tổn thương mô học ở tôm ở mức 30 ppt thì nghiêm trọng hơn. Mức độ nhiễm trung bình – nghiêm trọng (G3-G4) được tìm thấy ở 50% số tôm bị nhiễm bệnh. Ngược lại, chỉ có 16% tôm ở độ mặn 2 ppt cho thấy mức độ nhiễm cấp G3 và 0% trong số tôm nuôi ở độ mặn 15 ppt cho thấy cấp G2-G, theo thang điểm của Lightner [18].
Sự khác biệt về mức độ nghiêm trọng của nhiễm EHP ở ba độ mặn khác nhau có lẽ là do ảnh hưởng khác nhau của độ mặn đối với sự nảy mầm của bào tử. Một trong những giai đoạn quan trọng trong sự nảy mầm của bào tử là sự gia tăng của áp suất thẩm thấu nội bào tử. Sự khác biệt về độ mặn dẫn đến môi trường nhược trương ở 2 ppt và 15 ppt so với môi trường ưu trương ở 30 ppt. Có thể thấy rằng dung dịch ưu trương làm tăng sự nẩy mầm của bào tử bằng cách tăng quá trình hoạt hóa bào tử. quá trình. He và cộng sự. [19] nhận thấy sự khác biệt của vòi phân cực trong các môi trường thẩm thấu khác nhau ở Encephalitozoon gutis, một microsporidium nội bào bắt buộc gây bệnh đường tiêu hóa ở người, làm suy giảm miễn dịch.
Sự khác biệt trong sự nảy mầm của vòi phân cực liên quan đến những thay đổi về độ mặn cũng đã được báo cáo bởi những nhà nghiên cứu khác. De Graff và cộng sự. cho thấy sự gia tăng nảy mầm của bào tử Nosema apis ở nồng độ NaCl 0,5 N [20]. Tương tự, sự gia tăng của nảy mầm bào tử Nosema algerae ở nồng độ 0,1 M NaCl so với NaCl 0,05 M đã được báo cáo bởi các nhà nghiên cứu khác [21].
Trong nghiên cứu của chúng tôi, nồng độ NaCl là khoảng 0,5 M, Theo suy đoán là 0,2 M và 0,03 M NaCl ở 30 ppt, 15 ppt và 2 ppt. Sự khác biệt về nồng độ NaCl có lẽ giải thích một phần ảnh hưởng đến sự nảy mầm bào tử EHP và mức độ mắc bệnh.
Độ cứng là một biến số khác trong ba độ mặn được sử dụng trong nghiên cứu này và có thể là yếu tố ảnh hưởng đến sự nảy mầm của bào tử. Độ cứng ở độ mặn thấp (2 ppt) khoảng 240 mg / L (Thành phố Túc Sơn ), so với nước biển nhân tạo được chuẩn bị ở 15 ppt và 30 ppt khoảng 787 và 1575 mg / L (Crystal Sea, Marinex). Nó cho thấy canxi là một sứ giả quan trọng kích hoạt nhiều sự kiện tế bào và dòng chảy canxi có thể chịu trách nhiệm một phần cho việc kích hoạt phóng bào tử microsporidian ở độ mặn cao hơn [21].
Trong các ao nuôi thương phẩm của một số khu vực có EHP ở Châu Á, điều kiện độ mặn được tìm thấy rất khác nhau. Ví dụ, ở Ấn Độ có một số các khu vực nuôi tôm có độ mặn cao và thấp, và mức độ mắc EHP dường như thấp hơn ở độ mặn thấp hơn (dưới 5 ppt), như được quan sát trong một cuộc khảo sát dịch bệnh trên tôm ở Andhra Pradesh vào năm 2019 (Aranguren và cộng sự, dữ liệu chưa được công bố). Các điều kiện tương tự đã được ghi nhận ở hai khu vực canh tác tôm chính ở Venezuela, tức là hồ Maracaibo, nơi độ mặn khoảng 4–6 ppt và ở Falcon, nơi độ mặn thay đổi từ 36 đến 40 ppt. Ở Venezuela, nuôi tôm chưa được tích hợp đầy đủ. Việc vận chuyển nauplii và tôm post giữa Falcon và khu vực hồ Maracaibo là một thực tế phổ biến. Có nhiều ý kiến cho rằng PL và / hoặc tôm bố mẹ bị nhiễm EHP đã được di chuyển giữa hai khu vực này. Tuy nhiên, EHP chỉ được phát hiện trong khu vực Falcon nơi có độ mặn cao. Trong hồ Maracaibo, nơi có độ mặn thấp, EHP chưa được báo cáo. Một khả năng hạn chế sự lây lan của EHP có thể là sự khác biệt trong độ mặn của nước.
Kết luận
Nghiên cứu này đã chứng minh rằng các chuỗi phân từ tôm nhiễm EHP có thể được sử dụng như một nguồn chất cấy đáng tin cậy để tiến hành các ca thử nghiệm lây nhiễm EHP thông qua đường phân – miệng. Nhiễm trùng EHP có thể xảy ra ở độ mặn thấp (tức là 2 ppt) mặc dù tỷ lệ mắc và mức độ nhiễm bệnh cao hơn ở độ mặn 30 ppt. Những phát hiện này có ý nghĩa trong việc quản lý bệnh ở các khu vực có dịch EHP.
Các phương pháp
Tôm
Penaeus vannamei sạch bệnh (SPF) là thu được từ một nhà cung cấp thương mại ở Florida, Hoa Kỳ. Các Quần thể SPF đã được kiểm tra trong 2 năm qua tại UA-APL mà không có bất kỳ mầm bệnh nào trong danh sách của OIE và các bệnh không được liệt kê bao gồm EHP. Các xét nghiệm sinh học được thực hiện trong phòng thí nghiệm bệnh lý nuôi trồng thủy sản (UA-APL) của Đại học Arizona. Các hướng dẫn của Hiệp hội Y tế Thú y Hoa Kỳ (AVMA) đã được tuân thủ khi xử lý tôm theo phân tích mô bệnh học và gây chết nhân đạo bằng nước muối / ướp đá sau khi kết thúc thí nghiệm.
Thử nghiệm sinh học EHP
Phân lập EHP được sử dụng trong nghiên cứu này được lấy từ một quần thể P. vannamei có nguồn gốc ở Thái Lan. Hai cảm nhiễm EHP độc lập đã được tiến hành. Ở cả hai thử nghiệm, tôm được nuôi ở ba mức tương ứng khác nhau là 2 ppt, 15 ppt và 30 ppt. Đối với mỗi thử nghiệm, sáu bể chứa 90-L nước biển nhân tạo (Crystal Sea Marinex, Baltimore, Maryland) tương ứng với ba mức độ mặn với hai lặp lại cho mỗi nghiệm thức độ mặn. Nhiệt độ được điều chỉnh ở 25 ° C (± 0,6) với các phép đo mỗi lần, đo bằng nhiệt kế NIST. pH được đo bằng dải chỉ thị pH (Baxter®) mỗi tuần một lần với phạm vi 7,5–8,0. Độ mặn được điều chỉnh bằng cách thay 3 phần của độ mặn mỗi giờ từ 25 ppt (độ mặn ban đầu của quần thể P. Vannamei SPF) xuống còn 5 ppt. Để đạt được độ mặn 2 ppt từ 5 ppt, độ mặn được thay đổi sau mỗi 2 giờ. Sau khi thiết lập, độ mặn được đo bằng máy đo khúc xạ muối (Sper Scientific®) một lần trong suốt thời gian cảm nhiễm. Mười (10) con thẻ SPF (trọng lượng: 2,0–2,1 g) được thả trong mỗi bể thử nghiệm. Ba bể đối chứng 90-Lđược thiết lập cho mỗi độ mặn là nghiệm thức đối chứng âm.
Chuẩn bị chất cấy
Trong suốt hai thử nghiệm, tôm nhiễm EHP được cho ăn hàng ngày ở mức 5% tổng sinh khối. Các chuỗi phân được thu thập hàng ngày bằng siphon từ các bể bị nhiễm EHP vào một ống chứa sau khi cho ăn 1h. Để chuẩn bị chất cấy cho TN#1, các chuỗi phân bị nhiễm EHP được gộp lại từ mỗi ba bể nuôi với 5 con tôm/bể (trọng lượng trung bình 12,5 g).
Đối với TN#2, chất cấy EHP được chuẩn bị bằng cách gộp chung chuỗi phân từ một bể 1000 L chứa 60 con tôm bị nhiễm EHP (trọng lượng trung bình 9,0 g). Độ mặn của các bể nhiễm EHP được sử dụng làm nguồn nuôi cấy đều phù hợp với cả hai thử nghiệm ở 25 ppt (± 1,0). Sau khi hút các chuỗi phân từ bể chứa, nó được cân và được phân chia thành bảy phần bằng nhau. Sáu mẫu được sử dụng làm chất cấy cho sự lây nhiễm trong mỗi bể nghiệm thức. Mỗi phần được thêm vào bể nghiệm bằng cách trộn lượng trong ống vào nước của bể. Phần mẫu còn lại được bảo quản trong 95% ethanol để chạy PCR nhằm kiểm tra EHP theo một nghiên cứu đã công bố trước đây [4].
Bắt đầu 1 giờ sau khi cấy, tôm được cho ăn mỗi ngày một lần với tỷ lệ 2% tổng sinh khối bằng thức ăn viên thương mại (Rangen 35%, Buhl, Idaho). Đây quy trình buộc tôm phải ăn chất cấy chứa các chuỗi phân lây nhiễm EHP trước tiên. Tỉ lệ sống còn được ghi nhận hàng ngày kể từ khi bắt đầu cảm nhiễm. Ở cuối thí nghiệm, mẫu tôm từ TN#1 và # 2 ở mỗi bể nghiệm thức được cố định trong phương pháp cố định Davidson (AFA) [22]. Chi tiết về số lượng mẫu cho H&E dao động từ 4 đến 6 trong TN#1 và từ 6 đến 10 trong # 2. Các chi tiết về số lượng mẫu được mô tả trong Bảng 2. Mô gan tụy gộp từ 3 đến 4 con tôm được thu thập từ mỗi bể trong TN#1 và # 2 với tổng số 6 bể.
Các mẫu được bảo quản trong etanol 95% để phát hiện EHP bằng PCR. Thời gian của các thử nghiệm cảm nhiễm là 20 ngày và 26 ngày tương ứng cho # 1 và # 2.
Mô bệnh học
Mẫu được cố định bằng dung dịch Davidson (AFA) được xử lý, nhúng trong parafin, và cắt lớp (dày 5 μm) theo các phương pháp tiêu chuẩn [18, 22]. Sau khi nhuộm bằng H&E, các phần được phân tích bằng kính hiển vi. Mức độ nghiêm trọng của nhiễm trùng / tổn thương EHP dao động từ G0-G4 theo Lightner (1996) với G0 là không có bệnh và G4 đang ở mức độ nặng tổn thương và phá hủy mô nặng.
PCR thông thường và định lượng trong việc phát hiện và định lượng EHP
Hai phương pháp PCR khác nhau đã được sử dụng trong nghiên cứu này: nested-PCR thông thường để phát hiện EHP và PCR thời gian thực để định lượng tải lượng EHP.
Kiểm tra sự hiện diện của EHP bằng nested- PCR thông thường để hướng đến gen Spore Wall Protein 1 (SWP1). Các cặp mồi cho bước đầu tiên là: SWP 1F / 1R (1F: 5′-TTG CAG AGT GTT GTT AAG GGT TT-3, 1R: 5′-CAC GAT GTG TCT TTG CAA TTT TC-3 ′). Bộ gen mồi sản sinh 514 bp amplicon. Các đoạn mồi cho bước lồng ghép là: SWP 2F / 2R (2F: 5′-TTG GCG GCA CAA TTC TCA AAC A-3 ′, 2R: 5′-GCT GTT TGT CTC CAA CTG TAT TTG A 3 ′) tạo ra một amplicon 148 bp. PCR cho phản ứng PCR đầu tiên bao gồm biến tính 5 phút ban đầu ở 95 ° C, sau đó là 30 chu kỳ biến tính trong 30 giây ở 95 ° C, ủ trong 30 giây ở 58 ° C và kéo dài trong 45 giây ở 68 ° C với bước kéo dài 5 phút cuối cùng ở 68 ° C. Đối với bước nested-PCR thứ hai, mẫu bao gồm 1 μl dung dịch phản ứng cuối cùng từ bước PCR đầu tiên. Giao thức PCR cho phản ứng PCR thứ hai, phản ứng bao gồm một biến tính ban đầu ở 95 ° C trong 5 phút, sau đó là 20 chu kỳ của 30 giây biến tính ở 95 ° C, 30 giây ủ ở 64 ° C và kéo dài 20 giây ở 68 ° C với thời gian kéo dài cuối cùng trong 5 phút ở 68 ° C [23].
Để định lượng EHP bằng PCR thời gian thực, mồi F: 157 (5′-AGT AAA CTA TGC CGA CAA-3 ′) và R: 157 (5′-T TAA GCA GCA CAA TCC-3 ′), và Đầu dò TaqMan (5-FAM-TCC TGG TAG TGT CCT TCC GT-TAMRA-3 ′) đã được sử dụng. PCR thời gian thực giao thực bao gồm một biến tính ban đầu trong 20 s ở 95 ° C, tiếp theo là 40 chu kỳ biến tính trong 1 s ở 95 ° C và ủ / kéo dài trong 20 s ở 60 ° C, theo một phương pháp đã được công bố trước đây với những sửa đổi nhỏ [24].
Phân tích thống kê
Số bản sao EHP thu được từ quá trình phân tích định lượng đã được chuyển đổi thành giá trị log cơ số 10 trước khi thực hiện phân tích thống kê bằng SPSS v16.0. Phương pháp ANOVA một bước với so sánh Tukey được thực hiện và giá trị P <0,05 được coi là có ý nghĩa thống kê. Mối liên hệ giữa độ mặn và E. hepatopenaei được xác định bằng cách tính tỷ lệ OR và ý nghĩa thống kê ở mức α = 0,05 (n = 38) (Dean và cộng sự 2013)
Nhóm tác giả: L. F. Aranguren Caro, F. Alghamdi, K. De Belder, J. Lin, H. N. Mai, J. Millabas, Y. Alrehaili, A. Alazwari, S. Algetham and A. K. Dhar.
Biên dịch: Thùy Linh – Công ty TNHH PTTS Bình Minh.
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Các Nhà Nghiên Cứu Ở Úc Lập Bản Đồ Bộ Gen Của Tôm Sú
- Thức ăn thay thế Artemia được ra mắt ở Ấn Độ
- Liệu Những Đột Phá Về Gen Có Thổi Luồng Sinh Khí Mới Vào Nghề Nuôi Sú Và Tôm Càng Xanh Hay Không?

 English
English