Kỹ Thuật Nuôi, Tin tức
Thông Số Tăng Trưởng Của Tôm Thẻ Chân Trắng Litopenaeus vannamei Và Rong Đỏ Gracilaria corticata Trong Phương Pháp Nuôi Tổng Hợp Trong Hệ Thống Không Thay Nước
Tóm tắt
Nghiên cứu này được tiến hành theo thiết kế thí nghiệm nhân tố 2×3, nhằm đánh giá ảnh hưởng của mật độ tôm và tảo đỏ đến chất lượng nước trong hệ thống nuôi tôm thẻ chân trắng (Litopenaeus vannamei) kết hợp tảo đỏ Gracilaria corticata. Thí nghiệm kéo dài 45 ngày, sử dụng 18 bể tròn dung tích 1 m³, với hai mức mật độ tôm (25 và 50 con/m²) và ba mức mật độ tảo đỏ (0, 200 và 400 g/m²). Các chỉ tiêu nhiệt độ nước, oxy hòa tan (DO), pH và độ mặn được theo dõi 3 ngày/lần. Kết quả cho thấy, mật độ tôm ảnh hưởng đáng kể đến pH và DO cả vào buổi sáng lẫn buổi chiều, trong khi mật độ tảo không gây ra sự khác biệt có ý nghĩa thống kê đối với hai chỉ tiêu này (p > 0,05). Trong suốt thời gian nghiên cứu, thức ăn được xác định là nguồn cung cấp nitơ và phốt pho chính cho hệ thống nuôi. Bên cạnh đó, mật độ tôm và tảo đỏ có tác động đáng kể đến nồng độ các hợp chất dinh dưỡng như tổng amoniac, nitrit, nitrat và phốt phát trong nước. Khi mật độ tôm tăng, nồng độ các hợp chất này cũng tăng theo, trong khi mật độ tảo cao lại giúp giảm đáng kể các hợp chất này. Đáng chú ý, việc tăng mật độ tảo G. corticata trong các nghiệm thức không chỉ giúp nâng cao sinh khối tôm thu hoạch, mà còn giảm lượng nitơ và phốt pho trong cả nước và trầm tích, qua đó cải thiện rõ rệt chất lượng môi trường nước trong hệ thống nuôi tôm thẻ chân trắng (L. vannamei).
Giới thiệu
Nuôi tôm bán thâm canh và thâm canh ở Iran đã tăng lên trong những năm gần đây. Việc nuôi tôm bắt đầu vào năm 1992 ở Iran với loài tôm Penaeus indicus; tuy nhiên, do thiệt hại kinh tế do hội chứng đốm trắng (WSS), Tổ chức Thủy sản Iran đã quyết định thay thế bằng tôm thẻ chân trắng Litopenaeus vannamei. Loài mới này đã cho kết quả tốt ở Iran, các địa điểm nuôi tôm lớn ở Iran nằm ở các tỉnh phía Nam bao gồm: Sistan và Baluchestan (500 ha), Bushehr (1500 ha), Hormozgan (1000 ha) và Khuzestan (300 ha) với tổng sản lượng là 7900 tấn (Baghaei và Sudagar, 2013; Kalbassi và cộng sự, 2013). Các mật độ thả khác nhau (20, 30 và 50 PL/m2) đã được thử nghiệm để đưa tôm thẻ chân trắng L. vannamei vào Iran và kết quả chỉ ra rằng sản lượng tôm tăng tuyến tính khi mật độ thả giống tăng (Afsharnasab và cộng sự, 2008). Một số người nuôi tôm ở Iran có xu hướng thả tôm với mật độ cao trong trang trại (Sareban và cộng sự, 2012). Hiện tại, chưa có dữ liệu về lượng chất dinh dưỡng được thải ra môi trường qua nước thải từ các hệ thống nuôi tôm ở Iran. Đồng thời, chi phí hóa chất cho các hệ thống nuôi bán thâm canh và thâm canh cũng chưa được thống kê đầy đủ.
Nuôi tôm tạo ra một lượng lớn chất thải vô cơ, bao gồm thức ăn thừa và các sản phẩm bài tiết. Hơn 70% lượng chất thải này được thải ra môi trường tự nhiên (Porter và cộng sự, 1987). Thức ăn thừa từ tôm được bài tiết dưới dạng chất thải trao đổi chất, làm tăng đáng kể hàm lượng chất dinh dưỡng vô cơ và chất hữu cơ trong nước và trầm tích (Attasat và cộng sự, 2013).
Thức ăn thừa thải ra môi trường tự nhiên dẫn đến hiện tượng phú dưỡng môi trường (Neori và cộng sự, 1991) và gây độc cấp tính cho động vật thủy sinh (Troell và cộng sự, 1999; Neori và cộng sự, 2000). Trong các ao nuôi tôm (P. monodon) mật độ cao hơn ở Thái Lan và Alabama, nguồn nitơ chính (76–92%) và phốt pho (51–89%) là từ thức ăn (Briggs và Funge-Smith, 1994; Couch, 1998). Trong các ao nuôi tôm (L. vannamei) nằm ở vùng hồ Tai của Trung Quốc, thức ăn đóng góp trung bình lần lượt là 61,24% và 81,01% tổng lượng nitơ và phốt pho tăng được trong các ao nuôi P. vannanmei (Xia và cộng sự, 2004). Trong môi trường nuôi tổng hợp tôm (L. vannamei) và cà chua (Lycopersicon esculentum) trong nước ngầm có độ mặn thấp, hầu hết N (43,6%) và P (98,8%) được đưa vào hệ thống dưới dạng thức ăn cho tôm (Mariscal-Lagarda và Páez -Osuna, 2014).
Phương pháp truyền thống để duy trì chất lượng nước ao nuôi là thay nước thường xuyên nhưng điều này dẫn đến nguồn nước tiếp nhận bị ô nhiễm cao. Tác động môi trường của nước thải chưa qua xử lý đã làm dấy lên mối lo ngại về tính bền vững của nghề nuôi tôm. Việc giảm tỷ lệ trao đổi nước đã được nghiên cứu trên toàn thế giới nhằm hạn chế xuất khẩu chất thải và giảm tác động đến môi trường ven biển (Hopkins và cộng sự, 1995; Sandifer và Hopkins, 1996; Fourooghifard và cộng sự, 2017). Một phương pháp kinh tế và khả thi đã được nghiên cứu trong những năm gần đây là sử dụng tảo lớn để loại bỏ amoni và nitơ nhằm duy trì chất lượng nước tốt.
Rong biển có tiềm năng to lớn trong việc xử lý nước thải trong nuôi trồng thủy sản. Việc sử dụng rong biển Gracilaria như bộ lọc sinh học trong hệ thống nuôi cá hồi và tôm. Nuôi chung rong biển Gracilaria với cá hồi trong hệ thống bể giúp tăng đáng kể tỷ lệ sản xuất (Troell và cộng sự, 1999). Rong biển có khả năng loại bỏ amoni, nitơ và các chất dinh dưỡng khác từ nước thải. Ví dụ, rong biển Gracilaria có thể loại bỏ 50% lượng amoni hòa tan do cá hồi thải ra vào mùa đông (Troell và cộng sự, 1999) và rong biển G. manilaensis giúp giảm chất thải nitơ vô cơ trong nuôi tôm (Shukri và Surif, 2011). Khả năng lọc sinh học của G. manilaensisi đã được thử nghiệm để giảm chất thải Nitơ vô cơ trong nuôi tôm. Nuôi chung rong biển với tôm giúp nâng cao chất lượng nước và giảm ô nhiễm nước thải do nuôi tôm (Shukri và Surif, 2011). Ví dụ, một nghiên cứu cho thấy 24% lượng nitơ ban đầu được giữ lại dưới dạng sinh khối trong hệ thống nuôi trồng thủy sản tôm-cá-rong biển (Attasat và cộng sự, 2013). Nghiên cứu này chỉ ra rằng trong các thí nghiệm ngắn hạn (7-18 ngày), rong biển G. tikvahia có khả năng hấp thu chất dinh dưỡng và thúc đẩy tăng trưởng tốt cho tôm. Gần 35% lượng nitơ ban đầu được giữ lại trong sinh khối tôm và rong biển, cho thấy tiềm năng phục hồi dinh dưỡng cao của hệ thống (Samocha và cộng sự, 2015).
Rong biển đóng vai trò quan trọng trong ẩm thực và công nghiệp ở nhiều quốc gia, đặc biệt là ở khu vực châu Á. Rong biển thường được sử dụng làm rau ăn trực tiếp hoặc chế biến thành các món ăn đa dạng. Rong đỏ đặc biệt là các loài thuộc chi Gelidium và Gracilaria, đóng vai trò quan trọng trong ngành công nghiệp thực phẩm và sản xuất các chất phụ gia thực phẩm. Agar và carrageenan – hai chất phụ gia phổ biến được chiết xuất từ rong đỏ – có nhiều ứng dụng trong chế biến thực phẩm, dược phẩm và mỹ phẩm (McHugh, 2003). Tại Iran, rong biển G. corticata là nguyên liệu chính để sản xuất agar. Ngành công nghiệp agar tại đây có tiềm năng phát triển mạnh mẽ nhưng đang gặp phải thách thức do thiếu hụt nguyên liệu thô. Nghiên cứu này nhằm đánh giá hiệu quả nuôi tôm thẻ chân trắng (L. vannamei) kết hợp với rong biển G. corticata dưới các mật độ khác nhau của tôm và tảo trong hệ thống không thay nước.
Vật liệu và phương pháp
Thiết kế thử nghiệm
Nghiên cứu này được thực hiện tại trại Ba Tư thuộc Viện Nghiên cứu Sinh thái Biển Vùng Vịnh và Oman (PGOSERI) trong khoảng thời gian 45 ngày, từ tháng 8 đến tháng 10 năm 2013. Thời gian thực hiện dựa trên chu kỳ nuôi cấy 6-7 tuần của rong biển G. corticata tại Iran (Akbari và cộng sự, 2004; Abkenar, 2007). Thí nghiệm sử dụng thiết kế 2 x 3 với hai mức mật độ tôm (S1 và S2 với mật độ lần lượt là 25 và 50 con/m2 theo mật độ thả tôm ở một số trang trại ở Iran). Ba mức mật độ rong biển được sử dụng: A1 (0 g/m2), A2 (200 g/m2) và A3 (400 g/m2). Các nghiệm thức xử lý được viết tắt là S1A1, S1A2, S1A3 (25 con tôm với mật độ tảo 0, 200 và 400g tảo/m2) và S2A1, S2A2, S2A3 (50 con tôm với mật độ tảo 0, 200 và 400g tảo/m2). Tổng cộng có 18 bể thí nghiệm, mỗi bể có diện tích 1m2. Mỗi bể được chứa đầy 750L nước biển đã lọc và được sục khí liên tục bằng hai mảnh đá khí hình trụ 1″ với công suất 5 L/phút. Ánh sáng cho tảo phát triển được cung cấp bởi đèn huỳnh quang compact 40W, với chu kỳ quang trung tính 12 giờ sáng và 12 giờ tối (12:12, L:D) (Yarish và cộng sự, 2012). Mỗi thí nghiệm được lặp lại 3 lần.
Nuôi tôm và rong biển
Tảo đỏ G. corticata được thu hoạch từ khu vực ven biển Bandar-e Lengeh (26°33′29″B 54°52′50″E) thuộc Iran. Sau khi thu hoạch, rong biển được rửa sạch bằng nước biển đã lọc trong phòng thí nghiệm và loại bỏ cẩn thận các sinh vật bám dính. G. corticata được nuôi trên lưới cố định vào khung tròn polyetylen. Mỗi lưới có khoảng 50 điểm giao nhau, tại đó giống Gracilaria được buộc bằng sợi nhựa mềm (Juanich, 1988). Các khung được thiết kế với 3 kén để giữ lưới cách đáy bể 20 cm. Gracilaria được tách thành 10 g cây con, 20 cây con được buộc vào mỗi lưới để xử lý mật độ tảo 200 g và 40 cây con để xử lý mật độ tảo 400 g. Tôm post L. vannamei (5,82±0,11 g) được mua từ một trại nuôi tôm tại khu vực Tiab, Iran. Chiều dài và trọng lượng của tôm được đo và tính toán sinh khối trước khi thả vào bể. Tôm được thả với mật độ 25 và 50 con/m2 và được cho ăn thức ăn viên thương mại bốn lần mỗi ngày (06:00, 12:00, 18:00 và 22:00). Thức ăn được phân tán trực tiếp vào từng bể. Thức ăn sử dụng là thức ăn dành cho tôm nuôi tại đập Hormoz số 2, chứa 5,6% nitơ và 0,78% phốt pho. Trong suốt thí nghiệm, không thay nước, không sử dụng phân bón và không loại bỏ thức ăn thừa hoặc chất thải ra khỏi bể.
Thông số đo
Nhiệt độ nước, nồng độ oxy hòa tan (DO), pH và độ mặn được đo 3 lần mỗi tuần trong suốt thời gian nuôi tại vị trí cách mặt nước 20 cm. Nhiệt độ nước và lượng oxy hòa tan được đo bằng máy đo cầm tay (WTW, OXI 330i) với độ chính xác lần lượt là 0,1°C và 0,1 mg/L. Độ pH của nước được đo bằng máy đo pH cầm tay (WTW, pH 330i) với độ chính xác 0,01 đơn vị pH. Độ mặn được đo bằng Khúc xạ kế cầm tay Atago (model: S/Mill-E) với độ chính xác 0,5 PPT. Mẫu nước để phân tích chất dinh dưỡng được thu thập mỗi tuần từ mỗi bể và lọc ngay lập tức bằng bộ lọc màng Sartorius (cỡ lỗ 0,45 μm). Mẫu được bảo quản trong tủ lạnh cho đến khi phân tích. Tổng amoniac, nitrit, nitrat và phốt phát được đo bằng phương pháp đo quang phổ (Máy quang phổ Cecil 3041) với độ chính xác 1μg/L (Strickland và Parsons, 1972). Kết thúc thời gian nuôi, toàn bộ tôm được thu hoạch, cân riêng và bảo quản trong tủ đông. Tảo thu hoạch được cân với độ chính xác 1 g và sấy khô trong lò (ở 70°C trong 48 giờ) (Motsara và Roy, 2008) và được bảo quản trong tủ đông. Trầm tích được thu thập từ mỗi bể bằng cách hút, cân và sấy khô trong tủ sấy (ở nhiệt độ 70°C trong 48 giờ) và được giữ trong tủ đông cho đến khi được phân tích. Tổng nitơ trong tôm, mô rong biển và trầm tích được đo bằng phương pháp Kjeldahl với độ chính xác 0,01g N trong 1g mẫu (SEAFDEC, 2001). Phốt pho trong tôm, mô rong biển và trầm tích được đo bằng phương pháp quang phổ vanadi phosphomolybdate với độ chính xác 1μg trong 1g mẫu (Motsara và Roy, 2008).
Tôm, tảo đỏ và thức ăn được sử dụng trong thí nghiệm lần lượt chứa 3,07, 0,32 và 5,65% nitơ và 0,22, 0,03 và 0,78% phốt pho. Tổng N và P trong trầm tích được tính như sau: Tổng hàm lượng N và P trong trầm tích = nồng độ N và P trong 1g trầm tích × tổng khối lượng trầm tích. Tổng lượng nitơ và phốt pho (N và P) đưa vào hệ thống được tính toán dựa trên lượng N và P trong sinh khối nước, tôm và rong biển vào ngày đầu tiên thả giống và lượng thức ăn cung cấp trong suốt thời gian nuôi. Tổng lượng hấp thu và tích lũy nitơ và phốt pho (N và P) được tính toán dựa trên sinh khối tôm thu hoạch, tảo biển thu hoạch và chất tan trong nước và trầm tích vào cuối giai đoạn nuôi. Các công thức sau đây được sử dụng để tính toán các thông số tăng trưởng của tôm và rong biển (Ricker, 1975; Árnason và cộng sự, 2009). Tốc độ tăng trưởng riêng (SGR) (%/ngày) =100 (lnW2 − lnW1)/(t2 − t1), trong đó W1 và W2 là trọng lượng của tôm và rong biển đo tại thời điểm t1 và t2. Trọng lượng tăng thêm (WG) (%)=100(W2 –W1)/W1, trong đó W1 và W2 lần lượt là sinh khối ban đầu và sinh khối cuối cùng. Tỷ lệ chuyển đổi thức ăn (FCR)=Tổng lượng ăn vào/tổng tăng trọng của tôm trong giai đoạn tăng trưởng.
Phân tích thống kê
Tất cả dữ liệu được phân tích bằng phần mềm SPSS 22.0 bằng phân tích phương sai hai chiều (ANOVA), với mật độ tôm và tảo là yếu tố cố định và các thông số về sản lượng và tăng trưởng của tôm, nhiệt độ, oxy, pH vào buổi sáng và buổi chiều và dữ liệu nitơ và phốt pho là các biến phụ thuộc. Sự khác biệt đáng kể giữa các nghiệm thức được so sánh bằng thử nghiệm của Duncan. Sự khác biệt được coi là có ý nghĩa ở mức p<0,05.
Kết quả
Thông số hóa lý nước
Trong thời gian nuôi tôm thẻ chân trắng L. vannamei với tảo đỏ G. corticata, nhiệt độ nước dao động từ 30,4 – 35,8°C vào buổi sáng và từ 30,4 – 35,8°C vào buổi chiều. DO dao động từ 5,1 đến 6,36 mg/L vào buổi sáng và từ 5,63 đến 6,56 mg/L vào buổi chiều. Sự dao động tối đa và tối thiểu của pH (7,9-8,3 và 7,3-8,7) lần lượt được tìm thấy ở nghiệm thức S2A3 và S1A3. Không có sự khác biệt đáng kể giữa nhiệt độ nước và độ pH vào buổi sáng và buổi chiều. Sự khác biệt đáng kể đã được quan sát thấy giữa pH và DO trong các nghiệm thức khác nhau. Mật độ nuôi tôm có ảnh hưởng đáng kể đến pH và DO vào buổi sáng và buổi chiều. Mật độ tảo không có ảnh hưởng đáng kể đến pH và DO trong bể nuôi (Bảng 1).
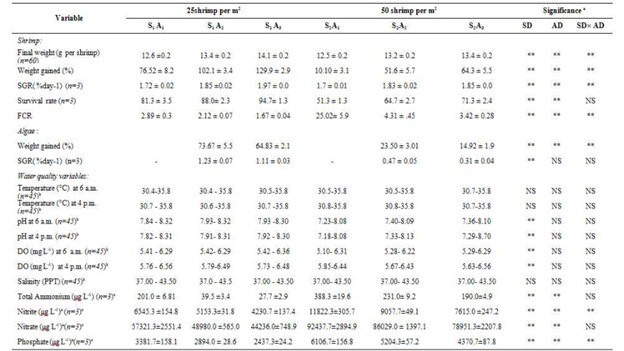
a Kết quả từ ANOVA hai chiều; SD = Mật độ tôm; AD = Mật độ tảo; SD × AD = Mật độ tôm × Mật độ tảo tương tác
b Trong thời gian nuôi
c Kết thúc thời kỳ nuôi
Nồng độ tổng amoniac nitrit, nitrat và phốt phát trong nước
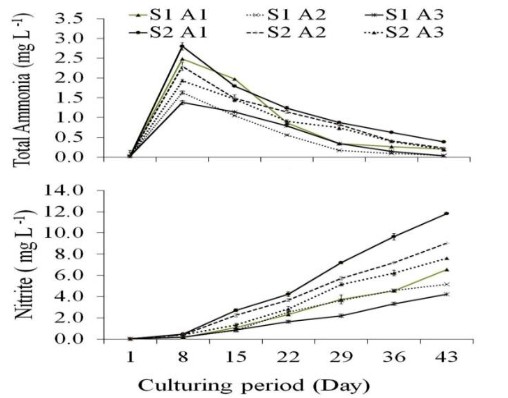
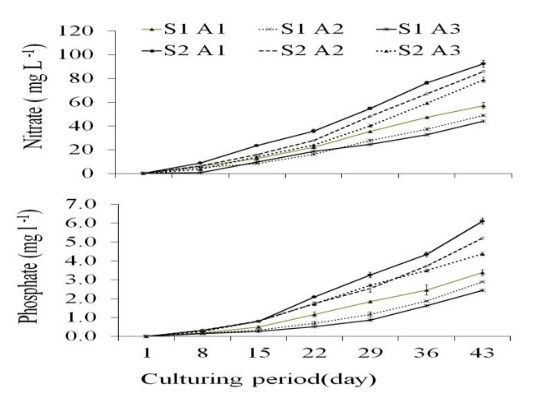
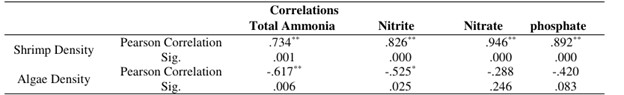
Tổng nồng độ amoniac ban đầu tăng trong tuần đầu tiên nhưng giảm dần ở tất cả các nghiệm thức trong thời gian nghiên cứu (Hình 1). Nồng độ nitrit, nitrat và photphat tăng dần trong thời gian nghiên cứu (Hình 1, 2) Có sự khác biệt đáng kể giữa nồng độ nitrit, nitrat và photphat ở tất cả các nghiệm thức (p<0,05). Kết quả cho thấy mối tương quan tích cực đáng kể giữa mật độ tôm và nồng độ tổng Amoniac, nitrit, nitrat và phốt phát trong nước bể (p<0,01). Một mối tương quan nghịch đáng kể đã được tìm thấy giữa mật độ tảo và nồng độ tổng amoniac và nitrit (p<0,05) (Bảng 2).
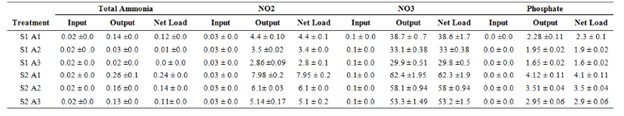
Mật độ tôm và tảo ảnh hưởng đáng kể đến nồng độ tổng amoniac, nitrit, nitrat và phốt phát trong nước (p<0,05). Mật độ tôm tăng dẫn đến tăng các hợp chất này, trong khi mật độ tảo tăng dẫn đến giảm các hợp chất này (Bảng 1). Nồng độ tối đa và tối thiểu của tổng amoniac (0,24±0,0 và 0,0 g/ m2), nitrit (7,95±0,2 và 2,8±0,1 g/ m2), nitrat (62,3±1,9 và 29,8±0,5 g/ m2) và phốt phát (4,1± 0,11 và 1,6±0,02 g/ m2) trên mỗi diện tích nuôi cấy được tìm thấy ở các nghiệm thức S2A1 và S1A3 (Bảng 3).
**. Tương quan có ý nghĩa ở mức 0,01
*. Tương quan có ý nghĩa ở mức 0,05 (n= 18)
Tăng trưởng và sản xuất tôm và rong biển
SGR tối đa và tối thiểu (1,97±0,0 và 1,7±0,01 %/ngày), tỷ lệ sống (94,7±1,3 và 51,3±1,3 %) và tăng trọng (129,9±2,9 và 10,10±3,1%) của L. vanamei đã được tìm thấy ở nghiệm thức S1A3 và S2A1. SGR tối đa và tối thiểu (1,23±0,07 và 0,31±0,04 %/ ngày) và trọng lượng tăng lên (73,67±5,5 và 14,92±1,9%) của G. corticata lần lượt có liên quan đến nghiệm thức S1A2 và S2A3. Kết quả chỉ ra rằng mật độ tôm ảnh hưởng đáng kể đến trọng lượng cuối cùng, tăng trọng, SGR và tỷ lệ sống của L.vannamei. Mật độ tôm ảnh hưởng đáng kể đến tăng trọng và SGR của G. corticata. Sự tương tác đáng kể giữa tôm và mật độ tảo đã được quan sát thấy trên các thông số tăng trưởng của L.vannamei và G. corticata trong thời gian nuôi 45 ngày (Bảng 1).
Nguồn cung nitơ
Nguồn cung cấp nitơ chính vào bể trong thời gian nuôi 45 ngày là từ thức ăn (17,79 g/m2 ở nghiệm thức với 25 con tôm/ m2 và 35,59 g/m2 ở nghiệm thức với 50 con tôm/ m2). Đầu vào nitơ một phần do thức ăn tôm cung cấp trong các nghiệm thức lần lượt là 79,8±0,0, 77,5±0,0, 75,4±0,0, 79,8±0,0, 78,7±0,0 và 77,6±0,0% đối với các nghiệm thức S1A1, S1A2, S1A3, S2A1, S2A2 và S2A3 (Bảng 4). Nồng độ nitơ tối đa và tối thiểu trong nước (16,7±0,4 và 7,63±0/m) lần lượt được tìm thấy ở các nghiệm thức S2A1 và S1A3. Hàm lượng nitơ tối đa và tối thiểu trong trầm tích (4,46±0,06 và 1,3±0,02 g/ m) lần lượt được tìm thấy ở nghiệm thức S2A1 và S1A2. Vào cuối giai đoạn nuôi, nitơ một phần trong sinh khối tôm là 35,1±0,9, 39,6±0,3, 41,9±0,5, 21,7±1,6, 28,0±1,5 và 31,0±1,3% ở các nghiệm thức S1A1, S1A2, S1A3, S2A1, S2A2 và S2A3. Nitơ một phần trong sinh khối rong biển lần lượt là 0,0, 4,7±1,0, 9,4±0,6, 0,0, 1,8±1,3 và 3,4±0,6% ở các nghiệm thức S1A1, S1A2, S1A3, S2A1, S2A2 và S2A3. Có sự khác biệt đáng kể giữa tổng lượng nitơ đầu vào và tổng lượng nitơ đầu ra ở tất cả các nghiệm thức (p<0,05), sự khác biệt giữa lượng nitơ đầu vào và đầu ra có thể đã được thải vào khí quyển (Bảng 4).
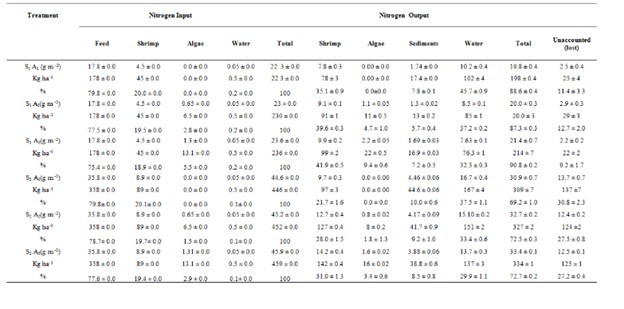
Nguồn cung phốt pho
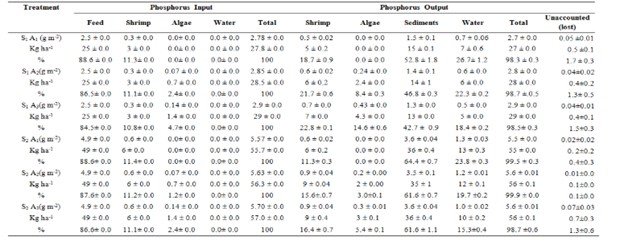
Nguồn phốt pho chính được đưa vào bể trong thời gian nuôi 45 ngày là từ thức ăn cho tôm (2,47 g/m2 ở nghiệm thức với 25 con tôm/ m2 và 4,93 g/m2 ở nghiệm thức với 50 con tôm/m2). Một phần phốt pho được cung cấp bởi thức ăn cho tôm trong các nghiệm thức lần lượt là 88,6, 86,5, 84,5, 88,6, 87,6 và 86,5% đối với các nghiệm thức S1A1, S1A2, S1A3, S2A1, S2A2 và S2A3 (Hình 2). Vào cuối thời kỳ nuôi, hàm lượng phốt pho đầu vào đạt tối đa trong trầm tích ở tất cả các nghiệm thức. Hàm lượng lân trong trầm tích lần lượt là 52,8±1,8, 46,8±0,3, 42,7±0,9, 64,4±0,7, 61,6±0,7 và 61,6±1,1% ở các nghiệm thức S1A1, S1A2, S1A3, S2A1, S2A2 và S2A3 (Bảng 5). Không có sự khác biệt đáng kể giữa tổng lượng phốt pho đầu vào và đầu ra ở các nghiệm thức (p>0,05).
Thảo luận
Việc giảm tỷ lệ trao đổi nước giúp hạn chế lượng chất thải thải ra môi trường, góp phần bảo vệ môi trường ven biển. Theo kết quả của nghiên cứu này, việc lựa chọn mật độ thả thích hợp tảo đỏ G. corticata và L. vannamei trong hệ thống không thay nước đã giúp cải thiện chất lượng nước và tăng sản lượng tảo và tôm. Hệ thống không thay nước kết hợp mật độ thả phù hợp (25 tôm/m² và 400g tảo/m²) giúp tăng sản lượng cả tôm và tảo. Nồng độ amoniac, nitrit và nitrat thấp hơn đáng kể trong hệ thống có tảo so với hệ thống không có tảo. L. vannamei đạt hiệu quả tốt nhất (tỷ lệ sống, SGR, WG cao, FCR thấp) khi nuôi với mật độ 25 tôm/m² và 400g tảo/m². Mật độ tôm ảnh hưởng đáng kể đến độ pH, DO và lượng chất dinh dưỡng trong nước. Theo dõi nước đầu vào và đầu ra của ao nuôi tôm bán thâm canh (L. vannamei) cho thấy độ pH của nước đầu vào và đầu ra dao động trong khoảng 7,7 đến 8,5 (Casillas-Hernández và cộng sự, 2007). Một nghiên cứu khác về cân bằng khối lượng dinh dưỡng trong ao nuôi tôm thâm canh (L. vannamei) chỉ ra rằng độ pH của nước dao động trong khoảng 7,8±0,2 và 8,0±0,3 lúc 7:30 và 14:00 giờ (Van Nguyen và Maeda, 2015).
Trong nghiên cứu này, nguồn nitơ chính là 75,4-79,8% đối với nghiệm thức với 25 con tôm/m2 và 77,6±0,0 – 79,8± 0,0% đối với nghiệm thức với mật độ 50 con/m2. Thức ăn là nguồn phốt pho chính (84,5-8,6% đối với nghiệm thức với 25 con tôm/m2 và 86,6±0,0-88,6±0,0% đối với nghiệm thức với 50 con tôm/m2). Khoảng 0,1- 0,2% tổng lượng nitơ đầu vào và 0,0% lượng phốt pho đầu vào là từ lượng nước vào. Kết quả tương tự cũng được tìm thấy ở các ao nuôi tôm (Penaeus monodon) mật độ cao hơn ở Thái Lan và Alabama, nơi nguồn nitơ chính (76–92%) và phốt pho (51–89%) là từ thức ăn (Briggs và Funge-Smith, 1994; Đi văng, 1998).
Trong các ao nuôi tôm (L. vannamei) nằm ở vùng hồ Tai của Trung Quốc, thức ăn đóng góp trung bình 193,81 kg/ ha (61,24%) và 45,20±2,12 kg/ ha (81,01%) trong tổng lượng nitơ và phốt pho tăng thêm trong ao L. vannanmei. Nước bơm vào ao mang lại trung bình 83,57 kg/ ha (26,96%) và 8,48±0,57 kg/ ha (15,20%) tổng lượng nitơ và phốt pho đầu vào tương ứng (Xia và cộng sự, 2004). Trong một trang trại nuôi tôm bán thâm canh ở Tây Bắc Mexico, thức ăn chiếm lần lượt 76,0% và 83,4% lượng nitơ và phốt pho đầu vào (PáezOsuna và cộng sự, 1997).
Trong môi trường nuôi tổng hợp tôm (L. vannamei) và cà chua (L. esculentum) với nước ngầm có độ mặn thấp, hầu hết N (43,6%) và P (98,8%) xâm nhập vào hệ thống dưới dạng thức ăn cho tôm (Mariscal-Lagarda & Páez -Osuna, 2014).
Ngược lại, trong các ao nuôi tôm bán thâm canh (L. vannamei) ở Honduras, việc thay nước chiếm phần lớn lượng nitơ và phốt pho thu được trong ao; lượng nước đóng góp 63%, trong khi thức ăn đóng góp 36% lượng nitơ. Mặt khác, lượng phốt pho đầu vào chính chủ yếu là từ nước (51%) và thức ăn chăn nuôi (47%) (TeichertCoddington và cộng sự, 2000).
Trong nghiên cứu này, sản lượng tôm P. vannanmei ở các nghiệm thức với 25 con/m2 chứa trung bình 7,8±0,3, 9,1±0,1 và 9,9±0,2 g/ m2 (tương đương 78±3, 91±1 và 99±2 kg/ ha) tổng lượng nitơ đầu vào. Năng suất tôm ở các nghiệm thức với mật độ 50 con/m2 (S2A1, S2A2 và S2A3), chứa trung bình 9,7±0,3, 12,7±0,4 và 14,2±0,4g/ m2 (bằng 97±3, 127±4, và 142±4 kg/ ha) tổng lượng nitơ đầu vào. Trong thời gian nuôi 112 ngày, ở vùng hồ Tai của Trung Quốc, sản phẩm tôm của ao L. vannanmei chứa trung bình 102,81 kg/ ha, tương đương 32,94% tổng lượng nitơ đầu vào (Xia và cộng sự, 2004).
Trong mô hình nuôi kết hợp tôm (L. vannamei) và cà chua (L. esculentum), ở Mexico, trong thời gian 133 ngày, khoảng 15,2% lượng N đầu vào và 8,9% lượng P đầu vào được chuyển đổi sang tôm thu hoạch. và khoảng 13,4% lượng N đầu vào không được tính đến và được cho là bị thất thoát vào khí quyển thông qua quá trình khử nitrat và bay hơi (Mariscal-Lagarda và Páez-Osuna, 2014).
Ngược lại, ở Thái Lan, nguồn nitơ và phốt pho cho một loạt ao nuôi tôm thâm canh được xác định qua hai hoặc ba chu kỳ nuôi. Kết quả chỉ ra rằng tôm (P. monodon) chuyển đổi 24% nitơ thức ăn và 13% phốt pho thức ăn thành thịt (Briggs và Funge-Smith, 1994). Trong các trang trại nuôi tôm bán thâm canh ở Honduras, nguồn hóa chất một phần đã chứng minh rằng các ao thương mại thả 7-10 con tôm/ m2 giữ lại 6,5% nitơ và 31% phốt pho thu được thông qua thức ăn, phân bón và nước (TeichertCoddington và cộng sự, 2000).
Trong nghiên cứu này, do không có sự thay nước nên không tìm thấy sự khác biệt đáng kể giữa tổng lượng phốt pho đầu vào và tổng lượng phốt pho đầu ra (Bảng 5). Khoảng 46,8±0,3 đến 64,4±0,7% tổng lượng phốt pho đầu vào được tìm thấy trong trầm tích. Trong các ao nuôi tôm (L. vannamei) ở vùng hồ Tai của Trung Quốc, khoảng 74,37% tổng lượng phốt pho đầu vào được tìm thấy trong trầm tích (Xia và cộng sự, 2004).
Mặc dù không thay nước nhưng trong thời gian nuôi, có sự khác biệt đáng kể giữa tổng lượng nitơ đầu vào và tổng lượng nitơ thu được từ tôm và tảo, hòa tan trong nước và tích lũy trong trầm tích. Nitơ có thể bị mất thông qua quá trình khử nitrat hoặc bay hơi amoniac (Teichert-Coddington và cộng sự, 2000). Quá trình khử nitrat liên quan đến việc khử nitrat thông qua nitrit và oxit nitric thành oxit nitơ hoặc khí nitơ (Zumft, 1997).
Trong nghiên cứu này, khoảng 9,2±1,7 – 30,8±2,3% tổng lượng nitơ đầu vào bị thất thoát do bay hơi (Bảng 4). Để so sánh, trong nuôi kết hợp tôm (L. vannamei) và cà chua (L. esculentum) ở Mexico, khoảng 13,4% tổng lượng nitơ đầu vào bị mất do bay hơi (MariscalLagarda và Páez-Osuna, 2014). Ngược lại, trong các ao nuôi tôm (L. vannamei) ở vùng hồ Tai của Trung Quốc, khoảng 54,86% tổng lượng nitơ đầu vào bị mất do bay hơi, khử nitrat và tích tụ (Xia và cộng sự, 2004).
Kết quả của nghiên cứu này đã chứng minh rằng việc tăng mật độ G. corticata trong tất cả các nghiệm thức, dẫn đến tăng sinh khối tôm thu hoạch (Bảng 1), do đó dẫn đến tăng khả năng hấp thu nitơ và phốt pho của tôm. Năng suất của các loài trong hệ thống nuôi hỗn hợp phụ thuộc vào hiệu suất tăng trưởng của cả hai loài trong hệ thống (Qian và cộng sự, 1996). Trong nghiên cứu này, tốc độ tăng trưởng tốt nhất của G. corticata được tìm thấy ở nghiệm thức S1A2 và S1A3 (với 25 con tôm/ m2) (Bảng 1). Mật độ nuôi tôm tăng có thể làm tăng độ đục và giảm cường độ ánh sáng, từ đó hạn chế sự phát triển của tảo. Nuôi trồng tổng hợp tảo đỏ Kappuphycus alvarezii và trai ngọc Pinctada martensi cho thấy mối quan hệ chặt chẽ giữa sự phát triển của tảo và sự hấp thu chất thải nitơ trong phạm vi được thử nghiệm, điều này chứng tỏ rằng tảo có thể loại bỏ chất thải nitơ một cách hiệu quả khi có điều kiện (ví dụ: ánh sáng, nhiệt độ, độ đục) thích hợp cho tảo phát triển mạnh (Qian và cộng sự, 1996).
Từ kết quả của nghiên cứu này, trong thời gian nuôi, nồng độ nitrit, nitrat và phốt phát tối đa và tối thiểu được tìm thấy ở các nghiệm thức S2A1 (mật độ tôm cao không có tảo) và S1A3 (mật độ tôm thấp và mật độ tảo cao) (Hình 1, 2). Việc nuôi trồng tổng hợp Salmonids và G. chilensis chỉ ra rằng sự phát triển của Gracilaria sử dụng nước thải bể cá cho phép đa dạng hóa sản xuất do hiệu quả lọc sinh học của Gracilaria trong việc loại bỏ nitơ và phốt pho (Buschmann và cộng sự, 1996a). Kết quả đã chứng minh mối tương quan ngược đáng kể giữa mật độ rong biển và nồng độ tổng amoniac, nitrit và phốt phát trong nước (Bảng 2). Những kết quả này xác nhận giả thuyết đã được chấp nhận rằng rong biển trong hệ thống nuôi cấy tích hợp sẽ chuyển đổi chất thải trao đổi chất của động vật thành sinh khối tảo dẫn đến tốc độ tăng trưởng cao (Harlin và cộng sự, 1979). Năng suất của cả Gracilaria spp. và cua tăng lên khi chúng được nuôi trong cùng một ao (Trono 1989). Nghiên cứu về khả năng lọc sinh học của rong biển trong việc giảm nitơ vô cơ trong ao nuôi tôm cho thấy G. manilaensis có khả năng giảm tới 83,65% NH4+, 33,33% NO2– và 68,42% NO3– sau 24 giờ. Về vấn đề này, việc đồng nuôi G. manilaensis cùng với tôm là cần thiết để nâng cao chất lượng nước và giảm ô nhiễm chất thải do tôm thải ra (Shukri và Surif, 2011). Trong nghiên cứu này, SGR tối đa (1,22±0,07%/ ngày) của G. corticata đã được quan sát thấy ở nghiệm thức S1A2. Tương tự, rong đỏ Kappaphycus alvarezii nuôi kết hợp với tôm thẻ chân trắng L. vannamei trong lồng nổi (Lombardi và cộng sự, 2006) tảo đỏ G. corticata là nguyên liệu chính cho tốc độ tăng trưởng 1,11%/ngày để cung cấp agarr ở Iran, nơi ngành công nghiệp thạch có khả năng phát triển đáng chú ý. Tuy nhiên, ngành này đang phải đối mặt với tình trạng thiếu nguyên liệu thô. (Akbari và cộng sự, 2004; Foroughifard và cộng sự, 2005). Nghiên cứu này chứng minh rằng việc nuôi cấy đồng thời L. vannamei và G. corticata trong hệ thống không thay nước, có thể nâng cao tổng sản lượng L. vannamei, giảm lượng nitơ và phốt pho cả trong nước và trầm tích và do đó cải thiện chất lượng nước. Tuy nhiên, sự gia tăng sinh khối rong biển có thể nâng cao sản lượng sinh khối tôm và tổng lượng nitơ hấp thụ của tôm. Ngoài ra, mật độ tôm tăng có thể dẫn đến giảm sản lượng tôm và tăng độ đục, do đó sẽ làm giảm sản lượng G.corticata. Từ kết quả của nghiên cứu này, mật độ 400 g rong biển/ m2 và 25 con tôm/ m2 có thể phù hợp cho nuôi kết hợp L. vannamei và G. corticata trong hệ thống không thay nước.
Theo Fourooghifard H.; Matinfar A.; Mortazavi M. S.; Roohani Ghadikolaee K.; Mirbakhsh M.
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Hiệu Ứng Tích Lũy Và Điều Hòa Từ Hỗn Hợp Kim Loại Zn, Pb Và Cd Trong Tôm Nhiệt Đới Penaeus vannamei
- Cách Mạng Hóa Nuôi Trồng Thủy Sản: Các Giải Pháp Ưu Việt Về Tấm Lót Trại Giống, Tấm Lót Bể Và Tấm Che Nhà Kính Của Reef Industries
- Dầu Cọ Thay Thế Dầu Cá Trong Thức Ăn Cho Cá Rô Phi

 English
English