Kỹ Thuật Nuôi, Tin tức
Ủ Chua Phụ Phẩm Sau Chế Biến Của Cá Rô Phi (TPWS): Một Nguyên Liệu Thay Thế Cho Khẩu Phần Ăn Của Tôm Thẻ Chân Trắng Litopenaeus vannamei (Boone, 1931) Trong Các Hệ Thống Biofloc Và Nước Sạch
Tóm tắt
Mục đích của nghiên cứu này là đánh giá hiệu suất tăng trưởng của tôm con Litopenaeus vannamei được nuôi trong điều kiện biofloc và nước sạch với mức khác nhau của khẩu phần ăn dựa trên thức ăn có nguồn gốc từ hỗn hợp phụ phẩm chế biến cá rô phi ủ chua (TPWS). Thí nghiệm được thực hiện trong hai hệ thống riêng lẻ: biofloc (BS) và hệ thống nước sạch (CWS). Thử nghiệm đã sử dụng 40 thùng nhựa hình chữ nhật 40L (20 mỗi hệ thống) với mật độ 63 con/ m2. Các con non được bố trí trong một thiết kế thí nghiệm hoàn toàn ngẫu nhiên. Các nghiệm thức dựa trên tỷ lệ bao gồm thức ăn ủ chua (đối chứng hoặc 0, 1,5%, 3,0%, 4,5% và 6,0%) trong BS hoặc CWS, tổng cộng là 10 nghiệm thức và 4 lần lặp lại. Tỷ lệ sống là trên 80% trong tất cả các nghiệm thức và không bị ảnh hưởng bởi cả hệ thống và khẩu phần ăn. Trọng lượng cuối cùng của tôm và SGR bị ảnh hưởng thống kê bởi hệ thống (P < 0,05) nhưng không phải bởi khẩu phần ăn; và thể hiện các giá trị cao trong BS. Việc đưa TPWS vào khẩu phần ăn tôm thẻ chân trắng không ảnh hưởng đến hiệu suất của tôm. Ngoài ra, tôm nuôi trong BS cho thấy hiệu suất tăng trưởng tốt hơn so với CWS.
1. Giới thiệu
Trong những năm gần đây, các nghiên cứu tiếp cận sản xuất tôm thẻ chân trắng Litopenaeus vannamei trong hệ thống biofloc đã thu hút nhiều sự chú ý (Avnimelech, 2015; Lobato, Ribeiro, Miranda-Baeza, & Emerenciano, 2019). Dịch bệnh bùng phát gần đây và năng suất thấp khiến các nhà khoa học phải tìm kiếm các hệ thống thay thế để cải thiện hiệu quả tốc độ tăng trưởng của tôm và đáp ứng nhu cầu thị trường (Emerenciano, Ballester, Cavalli, & Wasielesky, 2012a; Vargas-Albores và cộng sự, 2019).
Hệ thống biofloc, còn được gọi là công nghệ biofloc (BFT), có lợi thế là sản xuất một lượng lớn tôm trên một diện tích hoặc khối lượng mà hạn chế hoặc không cần thay nước. Công nghệ này cung cấp an toàn sinh học tốt hơn cho sản xuất, đặc biệt nếu trang trại nằm gần các khu vực tập trung nhiều người nuôi trồng thủy sản sử dụng cùng một nguồn nước. BFT đã trở nên phổ biến vì nó cung cấp một giải pháp thiết thực để duy trì chất lượng nước và đồng thời tái chế chất dinh dưỡng của thức ăn (Xu & Pan, 2012). Một ưu điểm khác của hệ thống biofloc là khả năng sử dụng các lựa chọn thay thế khẩu phần ăn ít protein, từ đó giảm chi phí sản xuất (Ballester và cộng sự, 2010; Scopel và cộng sự, 2011; Xu & Pan, 2014); chủ yếu là do nguồn thức ăn tự nhiên luôn sẵn có ở dạng vi sinh vật sống (Azim & Little, 2008; Decamp, Conquest, Forster, & Tacon, 2002; Ray và cộng sự, 2010).
Bột cá không bền vững và là một trong những thành phần đắt tiền nhất được sử dụng trong khẩu phần ăn nuôi trồng thủy sản (Naylor và cộng sự, 2009). Do đó, việc thay thế hoặc giảm lượng bột cá đang là mối quan tâm hàng đầu của ngành nuôi trồng thủy sản. Mặt khác, các vấn đề liên quan đến việc thay thế bột cá bằng các nguyên liệu thay thế đã được xác định, chẳng hạn như thiếu hụt một số axit amin thiết yếu, sự hiện diện của các yếu tố kháng dinh dưỡng, mùi vị và khả năng tiêu hóa (Forster, Dominy, Obaldo, & Tacon, 2003; Naylor và cộng sự, 2009). Mặc dù vẫn tồn tại nhiều vấn đề, nhưng nhiều trường hợp thành công đã được báo cáo trong khẩu phần ăn của L. vannamei (Amaya, Davis, & Rouse, 2007; Bauer, Prentice-Hernandez, Tesser, Wasielesky, & Poersch, 2012; Cruz-Suárez và cộng sự, 2007; Davis & Arnold, 2000; Forster và cộng sự, 2003; Hernández, Olvera-Novoa, Aguilar-Vejar, González-Rodríguez, & Parra, 2008; Samocha, Davis, Saoud, & DeBault, 2004; Suarez và cộng sự, 2009), bao gồm cả việc thay thế bột cá bằng nguồn protein thực vật (Moreno-Arias và cộng sự, 2018) cũng được hỗ trợ bằng cách bổ sung khoáng chất có liên quan (Huang, Wang, Zhang, & Song, 2017).
Hỗn hợp phụ phẩm cá ủ chua có thể được sản xuất bằng cách sử dụng phụ phẩm chế biến thủy sản và nuôi trồng thủy sản. Hỗn hợp phụ phẩm cá ủ chua là một nguồn protein thay thế cho bột cá (Vidotti, Viegas, & Carneiro, 2003) và sở hữu một phương pháp sản xuất dễ dàng hơn và rẻ hơn (Gallardo và cộng sự, 2012). Hơn nữa, việc sử dụng phụ phẩm cá ủ chua để thay thế cho các thành phần protein trong thức ăn nuôi trồng thủy sản nổi lên như một giải pháp thay thế để giải quyết các vấn đề về môi trường và vệ sinh do thiếu sử dụng và/ hoặc xử lý chất thải từ cá không đúng cách. Bên cạnh đó, đây cũng là một cách để giảm chi phí thức ăn, và do đó, chi phí sản xuất từ khi cho ăn chiếm khoảng 60% tổng chi phí (Arruda, Borghesi, & Oetterer, 2007).
Về vấn đề này, cá rô phi là một loài quan trọng trên toàn thế giới đối với ngành nuôi trồng thủy sản và đã cho thấy kết quả tích cực khi phụ phẩm cá ủ chua được đưa vào khẩu phần ăn (Carvalho, Pires, Veloso, Silva, & Carvalho, 2006; Fernandes , Bueno, Rodrigues, Fabregat, & Sakomura, 2007) do chất lượng dinh dưỡng (Oliveira, Pimenta, Camargo, Fiorini, & Pimenta, 2006). Vì vậy, mục đích của nghiên cứu này là để đánh giá việc đưa phụ phẩm cá rô phi ủ chua (TPWS) vào khẩu phần ăn cho tôm giống L. vannamei được nuôi trong điều kiện nước sạch và biofloc.
2. Vật liệu và phương pháp
2.1. Thiết kế thí nghiệm và điều kiện nuôi cấy
Nghiên cứu được thực hiện trong Lĩnh vực Nuôi trồng Thủy sản, Khoa Khoa học Động vật, Đại học Liên bang Nông thôn do Semi-Árido (UFERSA), RN, Brazil. Tôm post L. vannamei (PL20) được cung cấp bởi một trại sản xuất giống thương mại tại địa phương.
Trước khi thí nghiệm, tôm giống được thả trong bể hình tròn bằng sợi thủy tinh 15 m3 (được gọi là “macrocosm”) nhằm mục đích thuần tôm và hình thành biofloc trước đó. Nước được sục khí mạnh bằng cách sử dụng một bộ khuếch tán không khí (gồm ống nhựa PVC ¾” có nhiều lỗ 1 mm) nằm ở trung tâm của bể macrocosm. Để duy trì môi trường nuôi biofloc, tôm được thả với mật độ 200 con/ m2 vì nguồn carbon được bổ sung hàng ngày sau khi bổ sung thức ăn để duy trì tỷ lệ C:N cao (20:1) (Avnimelech, 1999) nhằm đảm bảo vi khuẩn dị dưỡng phát triển tối ưu (Crab, Kochva, Verstraete, & Avnimelech, 2009) và duy trì đến hết thời gian thí nghiệm. Việc cho tôm ăn được thực hiện vào lúc 08:00 sáng và 6:00 chiều, với thức ăn công nghiệp 35% protein thô (Aquabalance 35, Presence Animal Nutrition, Paulínia, SP, Brazil) trong hai khay thức ăn để theo dõi mức tiêu thụ thức ăn. Mật mía như một nguồn carbon được bổ sung hàng ngày sau khi bổ sung thức ăn để duy trì tỷ lệ C:N cao (20:1) (Avnimelech, 1999) nhằm đảm bảo vi khuẩn dị dưỡng phát triển tối ưu (Cua, Kochva, Verstraete, & Avnimelech, 2009). Các chất nền thẳng đứng (lưới polyetylen 1,0 mm) được đặt ở giữa bể để cung cấp thêm 30% diện tích của bể. Thí nghiệm này được thực hiện trong điều kiện euryhaline (∼5). Hạn chế thay nước và được thực hiện không quá 0,5% mỗi ngày bằng cống trung tâm để tránh tích tụ bùn trong suốt thời gian thử nghiệm. Nước ngọt khử Clo đã được thêm vào để bù đắp tổn thất bay hơi và loại bỏ bùn.
Hai hệ thống riêng lẻ đã được thiết lập theo Emerenciano và cộng sự (2007): hệ thống biofloc (BS) và nước sạch (CWS). Thử nghiệm được bắt đầu thả giống L. vannamei (1,43 ± 0,33 g) trong 40 (20 + 20) thùng nhựa hình chữ nhật 40 L (27 cm × 37 cm × 54 cm) với mật độ 63 con/ m2 (12 con/ thùng). Tôm con được phân phối trong một thiết kế thí nghiệm hoàn toàn ngẫu nhiên giai thừa (loại nước và % chất thải cá rô phi bao gồm các yếu tố chính) và nuôi trong 45 ngày. 4 bể lặp lại được chỉ định ngẫu nhiên cho mỗi nghiệm thức. Các nghiệm thức dựa trên tỷ lệ phần trăm bao gồm TPWS (0 hoặc đối chứng, 1,5%, 3,0%, 4,5% và 6,0%) trong hệ thống BS hoặc CWS, tổng cộng có 10 nghiệm thức. Công thức của khẩu phần ăn được mô tả dưới đây (phần 2.4).
Đối với cả 2 nghiệm thức, nước được bơm từ bể macrocosm đến các thiết bị thí nghiệm bằng một máy bơm chìm (máy bơm ¾ HP) và được trả lại bằng trọng lực. Lưu lượng nước sạch tất cả các thiết bị thí nghiệm được kiểm tra 2 lần mỗi ngày để duy trì tính đồng nhất giữa các thiết bị càng nhiều càng tốt (∼500%/ ngày của lưu thông nước giữa bể macrocosm và thùng). Các đơn vị thí nghiệm cũng được hút mỗi tuần 1 lần nhằm loại bỏ phân và bất kỳ chất cặn bã nào khác.
Đối với các nghiệm thức CWS, sơ đồ tương tự được mô tả ở trên trong BS đã được thực hiện, ngoại trừ bể vĩ mô (i) không được thả động vật, (ii) không được bổ sung carbon để duy trì nước sạch. Ngoài ra, việc sục khí được cung cấp bởi 2 máy thổi 4 HP kết nối với máy phát điện diesel khẩn cấp để giữ mức oxy hòa tan tối ưu trong cả 2 hệ thống.
Nhiệt độ, độ mặn, pH (YSI-100, Yellow Springs Instruments Inc., OH, USA) và nồng độ oxy hòa tan (YSI-55, Yellow Springs Instruments Inc., OH, USA) được theo dõi 2 lần/ ngày. Chất rắn lắng (hình nón Imhoff) được theo dõi hàng ngày (08:00 sáng). Tổng nitơ amoniac (NH4 –N) và nitrit (NO2 –N) được đo mỗi tuần 1 lần (UNESCO, 1983). Tất cả tôm được cân chính xác đến 0,1 g khi bắt đầu và kết thúc thí nghiệm. Trọng lượng cơ thể cuối cùng (g), tốc độ tăng trưởng cụ thể (SGR = [(ln trọng lượng cơ thể cuối cùng – ln trọng lượng cơ thể ban đầu)/thời gian thí nghiệm] × 100), tỷ lệ chuyển hóa thức ăn(FCR = tổng lượng thức ăn ăn vào/tổng tăng trọng) và tỷ lệ sống (số tôm sống cuối cùng/tổng số tôm × 100) đã được đánh giá.
2.2. Sản xuất phụ phẩm cá ủ chua
TPWS được sử dụng trong nghiên cứu này được sản xuất tại Phòng thí nghiệm Công nghệ Thủy sản và Kiểm soát Chất lượng (LAPESC/ UFERSA) bằng cách sử dụng dư lượng thịt thăn của cá rô phi sông Nile (Oreochromis niloticus) chế biến bao gồm đầu, xương, da, vây và nội tạng. Thức ăn ủ bằng axit theo phương pháp được mô tả bởi Arruda, Borghesi, Brum, D′Arce, và Oetterer (2006) với một số thay đổi: 2% axit Formic (độ tinh khiết ≥ 95%, Sigma-Aldrich) và 3% axit photphoric (độ tinh khiết 85% – 90%, Sigma-Aldrich) và 1% axit Sorbic(độ tinh khiết ≥ 99,0%, Sigma-Aldrich) làm chất chống nấm. Thức ăn ủ chua được sấy khô trong lò ở nhiệt độ 60°C trong 24 giờ (để đạt được độ ẩm dưới 13%), nghiền trong Máy nghiền Rotor (Dao quay và Búa xoay MA900, Marconi Equip. Lab. Ltda., Brazil) và đồng nhất hóa (500μm lưới). Trước khi xây dựng các khẩu phần ăn thử nghiệm, thức ăn ủ chua của cá đã được trung hòa bằng cách thêm 1,6% canxi hydroxit để tăng độ pH của thức ăn ủ chua từ 2,8 lên 7,1.
2.3. Xây dựng khẩu phần ăn và cho ăn
5 khẩu phần ăn thử nghiệm được xây dựng ở dạng đẳng nhiệt và đẳng proteic và đáp ứng các yêu cầu dinh dưỡng của loài (Bảng 1). TPWS bao gồm dao động từ 0 đến 6% của khẩu phần ăn. Mức độ bao gồm tổng thể thấp là do hàm lượng lipid thô cao có trong thức ăn ủ chua (37,4%). Tất cả các khẩu phần ăn được xử lý trong Phòng thí nghiệm Dinh dưỡng Động vật Thủy sản của Đại học Liên bang do Ceará (UFC) bằng phương pháp được mô tả bởi Nunes, Sa và Sabry-Neto (2011), với một số sửa đổi (ví dụ: bao gồm cá mòi thủy phân làm nguồn EAA; và giảm lượng dầu cá hồi do hàm lượng lipid cao của TPWS). Tất cả các khẩu phần được bảo quản đông lạnh ở -20°C cho đến khi sử dụng. Đối với cả 2 nghiệm thức, tôm con được cho ăn 2 lần/ ngày (08:00 sáng và 06:00 chiều) bằng khay thức ăn để theo dõi mức tiêu thụ thức ăn.
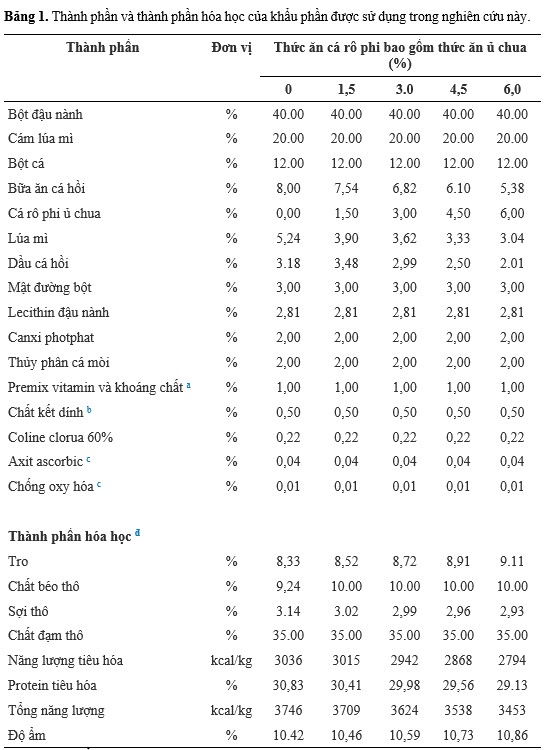
aDSM (Sản phẩm dinh dưỡng DSM, São Paulo, SP, Brazil): Vitamin A 1.250.000UI; Vitamin D3 350.000 UI; Vitamin E 25.000 UI; Vitamin K3 500 mg; Vitamin B1 5.000 mg; Vitamin B2 4.000 mg; Vitamin B6 10,0 mg; Axit nicotinic 15.000 mg; Axit pantothenic 10.000 mg; Biotin 150 mg; Axit folic 1.250 mg; Vitamin C 25.000 mg; Cholin 50.000 mg; Inositol 20.000,0 mg; Sắt 2.000 mg; Đồng 3.500 mg; Chelate Cooper 1.500 mg; Kẽm 10.500 mg; Kẽm Chelate 4.500 mg; Mangan 4.000 mg; Selen 15, mg; Chelate Selenium 15 mg; Iốt 150 mg; Coban 30 mg.
bPegabind™ (Bentoli Agrinutrition Inc., Austin, EUA).
cStay C™, DSM (Sản phẩm dinh dưỡng DSM, Sao Paulo, SP, Brazil).
dCác giá trị ước tính.
2.4. Phân tích thống kê
Sau khi kiểm tra tính đồng nhất và tính quy tắc (Zar, 1996), dữ liệu hiệu suất tôm được phân tích bằng cách sử dụng thử nghiệm ANOVA và Tukey hai chiều để so sánh phương tiện với α cố định trong 0,05 (Zar, 1996) bằng phần mềm R (phiên bản 3.0.2). Dữ liệu tỷ lệ sống sót được chuyển đổi bằng phép biến đổi arcsine để chuẩn hóa dữ liệu trước khi phân tích; tuy nhiên, trung bình ban đầu và độ lệch chuẩn được trình bày.
3. Kết quả
Liên quan đến phân tích trung tâm, kết quả cho thấy TPWS chứa 83,8% chất khô, 33,7% protein thô, 37,4% lipid thô và 21,5% tro tính theo chất khô (Bảng 2). Các thông số chất lượng nước được duy trì trong khoảng khuyến nghị đối với tôm thẻ chân trắng L. vannamei trong cả 2 hệ thống với nhiệt độ từ 24 đến 32°C, độ pH từ 6,7 đến 8,7 và độ mặn từ 4-5. Lượng oxy hòa tan luôn được giữ > 3,7 mg/ L, tổng nitơ amoniac < 0,52 mg/ L và nitrit < 0,25 mg/ L ở nồng độ an toàn cho động vật trong suốt quá trình thí nghiệm. Chất thải rắn tăng theo thời gian mặc dù mức duy trì dưới 15 mL/ L.
Bảng 2. Thành phần gần đúng của chất thải cá rô phi ủ chua (TPWS – axit ủ chua) sử dụng bã cá rô phi sông Nile (Oreochromis niloticus) được sản xuất bằng phương pháp được mô tả bởi Arruda và cộng sự (2006).

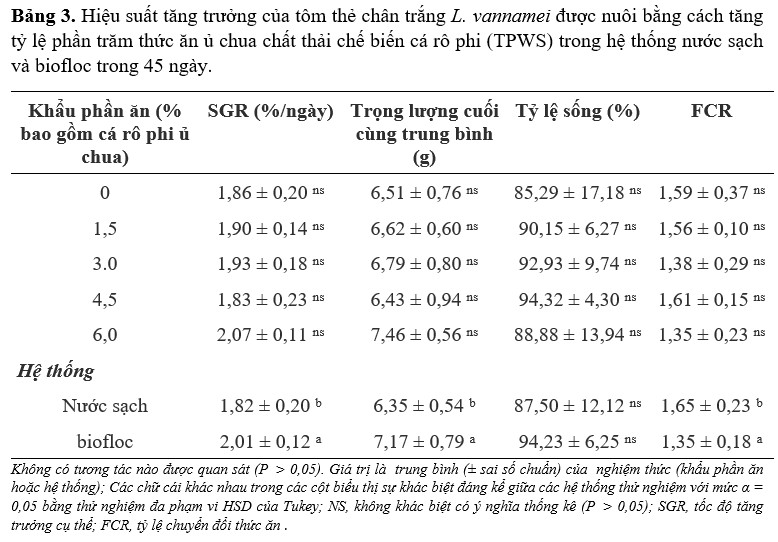
Về hiệu suất tăng trưởng (Bảng 3), không quan sát thấy sự tương tác giữa hệ thống và khẩu phần ăn (P > 0,05). Khả năng sống sót không bị ảnh hưởng bởi cả hệ thống và khẩu phần ăn; và trình bày trung bình trên 85% trong tất cả các nghiệm thức. Thử nghiệm FCR trình bày các giá trị thấp hơn đáng kể trong BFT (1,35) so với CWS (1,65). Theo xu hướng tương tự, trọng lượng cuối cùng trung bình và SGR bị ảnh hưởng về mặt thống kê bởi hệ thống chứ không phải bởi khẩu phần ăn (P > 0.05), thể hiện các giá trị cao hơn trong BFT với 7,17 g và 2,01%/ ngày so với 6,35 g và 1,82%/ ngày trong CWS.
Bảng 3. Hiệu suất tăng trưởng của tôm thẻ chân trắng L. vannamei được nuôi bằng cách tăng tỷ lệ phần trăm thức ăn ủ chua chất thải chế biến cá rô phi (TPWS) trong hệ thống nước sạch và biofloc trong 45 ngày.
4. Thảo luận
Các thông số chất lượng nước vẫn nằm trong phạm vi khuyến nghị cho nuôi tôm thẻ chân trắng (Van Wyk & Scarpa, 1999), bao gồm cả chất thải rắn lắng được duy trì dưới mức 15 mL/ L. Schveitzer và cộng sự. (2013) đã chứng minh rằng nồng độ cao của chất rắn lắng và TSS dường như có hại hơn đối với nuôi tôm thẻ chân trắng L. vannamei.
Trong các điều kiện thử nghiệm, cả 2 hệ thống biofloc (BS) và nước sạch (CWS), chất thải chế biến cá rô phi được ủ chua (TPWS) đều có thể được đưa vào ở mức cao nhất (6,0%) mà không làm giảm hiệu suất tăng trưởng và tỷ lệ sống. Mặt khác, trong điều kiện BS, tôm thể hiện năng suất tốt nhất so với CWS, có thể là do nguồn thức ăn tự nhiên luôn sẵn có. Năng suất tự nhiên này thường xuất hiện dưới dạng vi khuẩn, vi tảo, động vật nguyên sinh, nematodes, giáp xác chân chèo và luân trùng (Azim & Little, 2008; Ballester và cộng sự, 2010; Decamp và cộng sự, 2002; Ray và cộng sự, 2010). Những vi sinh vật này là nguồn giàu chất béo (Maica, Borba, & Wasielesky, 2012), vitamin và axit amin thiết yếu (Ju, Forster, Conquest, & Dominy, 2008), cũng như “protein nguyên dạng” rất đa dạng. Khái niệm “protein nguyên dạng” có liên quan đến nguồn protein không qua xử lý, chủ yếu bao gồm thực phẩm sống (Emerenciano, Cuzon, Goguenheim, Gaxiola, & Aquacop, 2012b). Điều quan trọng cần lưu ý là nguồn protein vi khuẩn đóng một vai trò quan trọng trong sự cân bằng và tái hấp thụ các chất hữu cơ dạng hạt và phân (coprophagia – ăn/hấp thụ phân) do tôm để lại dẫn đến hình thức cung cấp thức ăn liên tục. Sự xâm chiếm của vi khuẩn trong ruột tôm đã cho thấy những tác động tích cực như cải thiện hệ tiêu hóa của tôm, hoạt tính của enzyme (Xu, Pan, Sun, & Huang, 2012) và tăng tính khả dụng của các enzyme ngoại bào (Xu & Pan, 2012) hoạt động như “lợi khuẩn tự nhiên” (De Schryver, Boon, Verstraete, & Bossier, 2012).
Trong những năm gần đây, mối quan tâm về các nguồn protein thay thế trong khẩu phần ăn uống như ngũ cốc thực vật và các sản phẩm phụ của ngành chăn nuôi trên cạn đã tăng lên. Mặt khác, vẫn cần đặc biệt chú ý đến mùi vị, khả năng tiêu hóa, sự thiếu hụt các axit amin thiết yếu và sự hiện diện của các yếu tố kháng dinh dưỡng (Forster và cộng sự, 2003; Naylor và cộng sự, 2009). Mặc dù vẫn tồn tại những vấn đề, nhiều trường hợp thành công đã được báo cáo khi sử dụng protein thay thế trong khẩu phần ăn như phụ phẩm gia súc và hỗn hợp cải dầu và đậu nành (Forster và cộng sự, 2003; Suarez và cộng sự, 2009), phụ phẩm gia cầm (Amaya và cộng sự, 2007; Cruz-Suárez và cộng sự, 2007; Samocha và cộng sự, 2004), phụ phẩm từ lợn (Hernández và cộng sự, 2008), và protein đậu nành cô đặc (Paripatananont, Boonyaratpalin, Pengseng, & Chotipuntu, 2001). Bauer và cộng sự (2012) gợi ý rằng hỗn hợp protein đậu nành cô đặc và bột hạt flocs có thể được sử dụng để thay thế cho bột cá trong khẩu phần ăn của tôm thẻ chân trắng giống L. vannamei. Những nghiên cứu này đã được thực hiện trong điều kiện nước sạch và một số nỗ lực đã được thực hiện để nghiên cứu các nguồn thay thế trong điều kiện biofloc. Scopel và cộng sự (2011) đã đánh giá việc thay thế bột cá (0, 12,5% và 21,0%) bằng sự kết hợp đậu nành và các sản phẩm phụ từ động vật trên cạn. Các nhà nghiên cứu nhận thấy rằng 12,5% lượng thức ăn thay thế không ảnh hưởng đến sự tăng trưởng của tôm, dẫn đến tốc độ tăng trưởng là 0,7 g/ tuần tương tự như tốc độ tăng trưởng trong nghiên cứu ở điều kiện nước sạch, nhưng thấp hơn 0,9 g/ tuần được quan sát thấy ở biofloc.
Không tìm thấy tài liệu nào liên quan đến việc sử dụng TPWS trong khẩu phần ăn của tôm thẻ chân trắng L. vannamei trong điều kiện biofloc. Mặc dù mức độ thức ăn ủ chua thấp được đưa vào khẩu phần ăn do hàm lượng lipid cao trong thức ăn cá ủ chua, nhưng mức cao nhất là 6% vẫn có thể cho thấy mức giảm đáng kể chi phí trong các công thức nuôi tôm. Trong một nghiên cứu sử dụng nước sạch, Gallardo và cộng sự (2012) đã đánh giá thức ăn cho tôm thẻ chân trắng có chứa (i) chất thải cá ủ chua, (ii) chất thải cá ủ chua với bột đậu nành và (iii) bột chất thải cá như một nguồn protein. Các tác giả báo cáo rằng tôm được cho ăn bằng khẩu phần ăn có chứa chất thải cá ủ chua kết hợp với bột đậu nành tăng trọng 0,7 g/ tuần cao hơn so với tôm ăn bằng chất thải cá ủ chua hoặc bột chất thải cá (0,3 g/ tuần). Điều quan trọng cần lưu ý là các giá trị này thấp hơn so với quan sát được trong nghiên cứu này, ví dụ với các điều kiện biofloc (0,9 g/ tuần). Ngoài ra, trong nghiên cứu này, các giá trị FCR lần lượt là 1,3 và 1,6 đối với BS và CWS, thấp hơn so với 2,8 và 2,5 được quan sát bởi Ray và cộng sự (2010) và Xu và cộng sự (2012) sử dụng khẩu phần ăn lần lượt dựa trên protein đậu nành và khẩu phần ăn có hàm lượng protein thấp, cả trong điều kiện biofloc đối với tôm thẻ chân trắng L. vannamei.
Ngược lại với nghiên cứu này, Costa, Portz, Hisano, Druzian và Ledo (2009) đã thực hiện một nghiên cứu thú vị đánh giá thức ăn ủ chua của tôm trong khẩu phần ăn của cá rô phi con (O. niloticus). Các nhà nghiên cứu kết luận rằng có thể bao gồm 2,75% thức ăn ủ chua của tôm, giảm 3,3% chi phí thức ăn mà không làm giảm năng suất của cá. Trong một nghiên cứu tương tự, Cavalheiro, Souza và Bora (2007) đã thử nghiệm ủ chua đầu tôm (khoảng 40% protein) như một chất thay thế cho bột cá trong khẩu phần ăn của cá rô phi ở các mức 0, 33,3%, 66,6% và 100%. Kết quả cho thấy thức ăn ủ chua tôm mang lại lợi ích kinh tế và có thể thay thế 100% bột cá mà không ảnh hưởng đến chất lượng thức ăn.
5. Kết luận
Trong các điều kiện thí nghiệm này, việc đưa thức ăn ủ chua chất thải chế biến cá rô phi (TPWS) vào khẩu phần ăn của L. vannamei có thể đạt tới 6% mà không ảnh hưởng đến năng suất và tỷ lệ sống của tôm. Ngoài ra, tôm nuôi trong hệ thống BS cho thấy hiệu suất tăng trưởng vượt trội so với CWS.
Theo Joaquim da Rocha Soares Neto, Felipe de Azevedo Silva Ribeiro, Alex Augusto Gonçalves, Maurício Gustavo Coelho Emerenciano
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Aeromonas schubertii, Một Loại Vi Khuẩn Mới Được Phát Hiện Từ Các Trang Trại Bị Ảnh Hưởng Bởi AHPND, Có Khả Năng Gây Chết Tôm Thẻ Chân Trắng (Penaeus vannamei)
- Các Chất Thay Thế Mới Như Bacteriocin Dẫn Đầu Trong Việc Thay Thế Kháng Sinh Trong Nuôi Trồng Thủy Sản Ở Tương Lai
- Rà Soát Lại Bệnh Vibrio Trong Nuôi Tôm

 English
English