Kỹ Thuật Nuôi, Tin tức
Virus Gây Hội Chứng Đốm Trắng Kích Hoạt Con Đường Glycolytic Trong Các Tế Bào Miễn Dịch Của Tôm (Tế Bào Máu) Để Có Lợi Cho Sự Nhân Lên Của Nó
Tóm tắt
Vi rút hội chứng đốm trắng (WSSV) là mầm bệnh gây thiệt hại kinh tế đáng kể cho ngành nuôi tôm. WSSV kích hoạt quá trình glycolysis hiếu khí trong các tế bào miễn dịch của tôm (tế bào máu), nhưng cách thức vi rút này điều chỉnh các enzyme hoặc con đường glycolysis vẫn chưa được biết rõ. Do đó, mức độ mRNA và hoạt tính của 4 loại enzyme glycolysis quan trọng là Hexokinase (HK), Phosphofructokinase (PFK), Pyruvate kinase (PK) và Lactate dehydrogenase (LDH) được đo trong các tế bào máu của tôm bị nhiễm WSSV. Biểu hiện gen của HK và PFK, nhưng không phải LDH hoặc PK, đã tăng lên ở giai đoạn sao chép bộ gen của vi rút (12 giờ); hơn nữa, hoạt tính của các enzyme này, ngoại trừ HK, đồng thời tăng lên. Tuy nhiên, không có sự gia tăng hoạt tính của enzyme ở giai đoạn cuối của vi rút (24 giờ). Vô hiệu hóa DSRNA in vivo và phá vỡ quá trình glycolysis bởi 2-DG đã khẳng định thêm vai trò của quá trình glycolysis trong quá trình nhân lên của virus. Dựa trên các nghiên cứu truy tìm bằng cách sử dụng glucose được đánh dấu bằng đồng vị ổn định, quá trình glycolysis được kích hoạt ở giai đoạn sao chép bộ gen của vi rút, nhưng không phải ở giai đoạn cuối của vi-rút. Nghiên cứu này cho thấy WSSV đã tăng cường quá trình glycolysis bằng cách kích hoạt enzyme glycolysis ở giai đoạn sao chép bộ gen của vi rút, cung cấp năng lượng và các phân tử sinh học cho sự nhân lên của virus.
1. Giới thiệu
Quá trình trao đổi chất bị virus tấn công đã được nghiên cứu trong nhiều năm để hiểu quá trình virus làm biến đổi quá trình trao đổi chất của vật chủ để thúc đẩy sự nhân lên của nó. Sự xen kẽ trao đổi chất do nhiễm vi-rút thường giống với quá trình tái lập trình trao đổi chất trong tế bào ung thư. Bằng cách tạo ra các con đường trao đổi chất của vật chủ, lượng phân tử sinh học tăng cao, bao gồm nucleotide, axit amin và lipid, sau đó có thể được sử dụng để tạo ra virion truyền nhiễm. Ngoài việc sản xuất phân tử sinh học, quá trình tái lập trình trao đổi chất do vi rút gây ra cũng có thể cung cấp ATP ở chế độ nhanh để hỗ trợ các quá trình sử dụng nhiều năng lượng như sao chép và đóng gói bộ gen của virus, hoặc NADPH để sinh tổng hợp khử (tổng hợp lipid) và duy trì cân bằng nội môi oxy hóa khử.
Quá trình glycolysis hiếu khí là một nguồn carbon thường được kích hoạt trong quá trình lây nhiễm vi rút để cung cấp ATP, NADPH và các phân tử carbon cho sự nhân lên của vi rút. Glycolysis là một con đường bắt buộc để đảm bảo sự nhân lên thành công của vi rút ở vi rút lây nhiễm cho động vật có xương sống. Vi rút nhắm đến các enzyme glycolysis giới hạn tốc độ, cụ thể là Hexokinase (HK), Phosphofructokinase (PFK) và Pyruvate kinase (PK), để kiểm soát tốc độ trao đổi chất của quá trình glycolysis. Một loại protein virut có tên là E4ORF1 từ adenovirus gây ra biểu hiện HK2 và PFKM thông qua kích hoạt Myc để hỗ trợ quá trình glycolysis và nhân lên của virut. Oncoprotein LMP1 của vi rút Epstein-Barr (EBV) thúc đẩy hoạt động phiên mã của HK2 via c-Myc điều hòa quá trình glycolysis. Vi rút không chỉ thúc đẩy sự biểu hiện của các enzyme glycolytic để tăng quá trình glycolysis mà còn có thể làm tăng hoạt tính của enzyme thông qua tương tác giữa protein của vi rút và enzyme glycolysis. Ví dụ, protein NS5A của vi rút viêm gan C (HCV) và protein NS1 của vi rút sốt xuất huyết (DENV) sẽ tăng cường hoạt tính của HK và GAPDH bằng cách tương tác với enzyme glycolytic.
Việc lập trình lại quá trình trao đổi chất do vi rút gây ra không chỉ giới hạn ở các tế bào bị nhiễm vi rút ở động vật có xương sống, vì một loại vi rút không xương sống có tên là vi rút hội chứng đốm trắng (WSSV) cũng lập trình lại quá trình trao đổi chất của vật chủ (tôm) để tạo điều kiện thuận lợi cho quá trình nhân lên của nó. Chu kỳ nhân lên WSSV in vivo là ~ 24 giờ, với giai đoạn sao chép bộ gen của vi rút là 12 giờ và giai đoạn cuối là 24 giờ. Ở giai đoạn sao chép bộ gen của vi rút (12 giờ), WSSV kích hoạt một số con đường trao đổi chất, ví dụ: glycolysis hiếu khí, con đường pentose phosphate, sinh tổng hợp nucleotide, glutaminolysis, lipolysis và sinh tổng hợp axit amin, trong các tế bào miễn dịch của tôm (tế bào máu) và các mô đích khác.
Để hoàn thành quá trình nhân lên của vi rút, WSSV gây ra quá trình glycolysis hiếu khí trong tế bào máu của tôm ở giai đoạn sao chép bộ gen của vi rút (12 giờ). Sự chuyển vị glycolysis được hỗ trợ bởi sự điều hòa của các enzym glycolysis. Godoy-Lugo và cộng sự (2019) đã báo cáo rằng yếu tố phiên mã HIF-1 điều chỉnh HK, PFK và PK theo cách thức cụ thể của mô ở tôm thẻ chân trắng bị nhiễm WSSV. Ở tôm thẻ chân trắng (Exopalaemon carinicauda), WSSV làm tăng biểu hiện của HK và PFK. Khi nhiễm WSSV, hoạt động thấp của pyruvate dehydrogenase (PDH) chuyển glucose thành sản xuất lactate thay vì đi vào chu trình TCA. Lactate dehydrogenase xúc tác quá trình chuyển đổi pyruvate thành lactate, được kích hoạt trong quá trình nhiễm WSSV. Vì hầu hết pyruvate được chuyển thành lactate, nên quá trình ngưng kết hợp glutamate sẽ duy trì chu trình TCA, tạo điều kiện thuận lợi cho việc sản xuất năng lượng và phân tử sinh học liên tục. Ngoài ra, Glucose-6-phosphate dehydrogenase (G6PDH) được kích hoạt trong quá trình nhiễm WSSV, chuyển hướng glucose-6-phosphate, một chất trung gian glycolysis, vào con đường pentose phosphate. Điều này không chỉ thúc đẩy quá trình sinh tổng hợp nucleotide để vi rút nhân lên mà còn tạo ra đủ NADPH, một chất khử để vô hiệu hóa ROS được tạo ra trong quá trình lây nhiễm vi rút.
Quá trình glycolysis là một con đường quan trọng để sao chép vi rút đã được nghiên cứu ở tôm bị nhiễm WSSV; tuy nhiên, hầu hết các nghiên cứu chỉ mô tả một loại enzyme glycolysis riêng lẻ. Việc theo dõi glucose được dán nhãn đồng vị ở tôm bị nhiễm WSSV có thể cung cấp sự hiểu biết toàn diện về quá trình glycolysis trong quá trình nhiễm WSSV. Trong nghiên cứu này, glucose được đánh dấu bằng đồng vị ổn định ([U- 13C] Glucose) đã được sử dụng làm chất đánh dấu để theo dõi các chất chuyển hóa glycolysis khác nhau trong quá trình nhiễm WSSV. 4 enzyme glycolysis quan trọng (HK, PFK, PK và LDH) đã được nghiên cứu để đánh giá vai trò của chúng trong việc lây nhiễm WSSV.
2. Vật liệu và phương pháp
2.1. Động vật thí nghiệm và chủng cấy WSSV
Tôm thẻ chân trắng chưa trưởng thành (Litopenaeus vannamei, 2~3 g) được sử dụng trong nghiên cứu này được lấy từ Trung tâm Quốc tế về Phát triển Khoa học Nuôi trồng Thủy sản Tôm, Đại học Quốc gia Cheng Kung (NCKU) và Khoa Nuôi trồng Thủy sản, Đại học Khoa học và Công nghệ Quốc gia Pingtung (NPUST). Tôm được giữ trong nước biển tiệt trùng 30 ppt ở 27°C trong 1 ngày trước khi nhiễm virus. Nguồn giống WSSV (phân lập Đài Loan, gia nhập GenBank số AF440570) đã được chuẩn bị bằng cách thu thập bạch huyết của tôm SPF sắp chết bị nhiễm WSSV. Nguồn WSSV được pha loãng 10-4 với 1x PBS (137 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4 và 2 mM KH2PO4) và dùng để tiêm vào cơ tôm. Liều lượng cảm nhiễm WSSV (100 μl/3 g tôm) gây ra tỷ lệ chết ~50% trong 3 ngày và 100% trong 5 ngày, trong khi tôm được xử lý bằng PBS (100 μl/3 g tôm) được dùng làm đối chứng. Vào lúc 12 và 24 giờ sau cảm nhiễm WSSV, các tế bào máu được thu thập để đánh giá hoạt tính của enzyme và định lượng biểu hiện của gen glycolytic và WSSV. Chân bơi được thu thập để đo số lượng bản sao bộ gen của WSSV.
2.2. Định lượng gen Glycolytic và gen cấu trúc WSSV VP28 bằng PCR thời gian thực
Chiết xuất RNA từ tế bào máu thu được 12 và 24 giờ được thực hiện với REzol (Protech Enterprise) và cDNA được tổng hợp với SuperScript™ II Reverse Transcriptase (Invitrogen) và mồi Anchor-dTv (Bảng 1). cDNA thu được được sử dụng để đo biểu hiện của gen mục tiêu, sử dụng hệ thống phát hiện Bio-Rad và KAPA SYBR® FAST qPCR Master Mix (KAPA). Bộ mồi của từng gen mục tiêu được liệt kê (Bảng 1). Dữ liệu được chuẩn hóa với các giá trị của EF-1α (đối chứng nội bộ) và được tính toán bằng phương pháp 2-ΔCT. Quy tắc thực nghiệm được thực hiện trên tất cả các dữ liệu để phát hiện và loại trừ các ngoại lệ thống kê. Sự khác biệt giữa các nhóm được xác định bằng bài kiểm tra Student’s t-test.
Bảng 1. Bộ mồi được sử dụng trong nghiên cứu
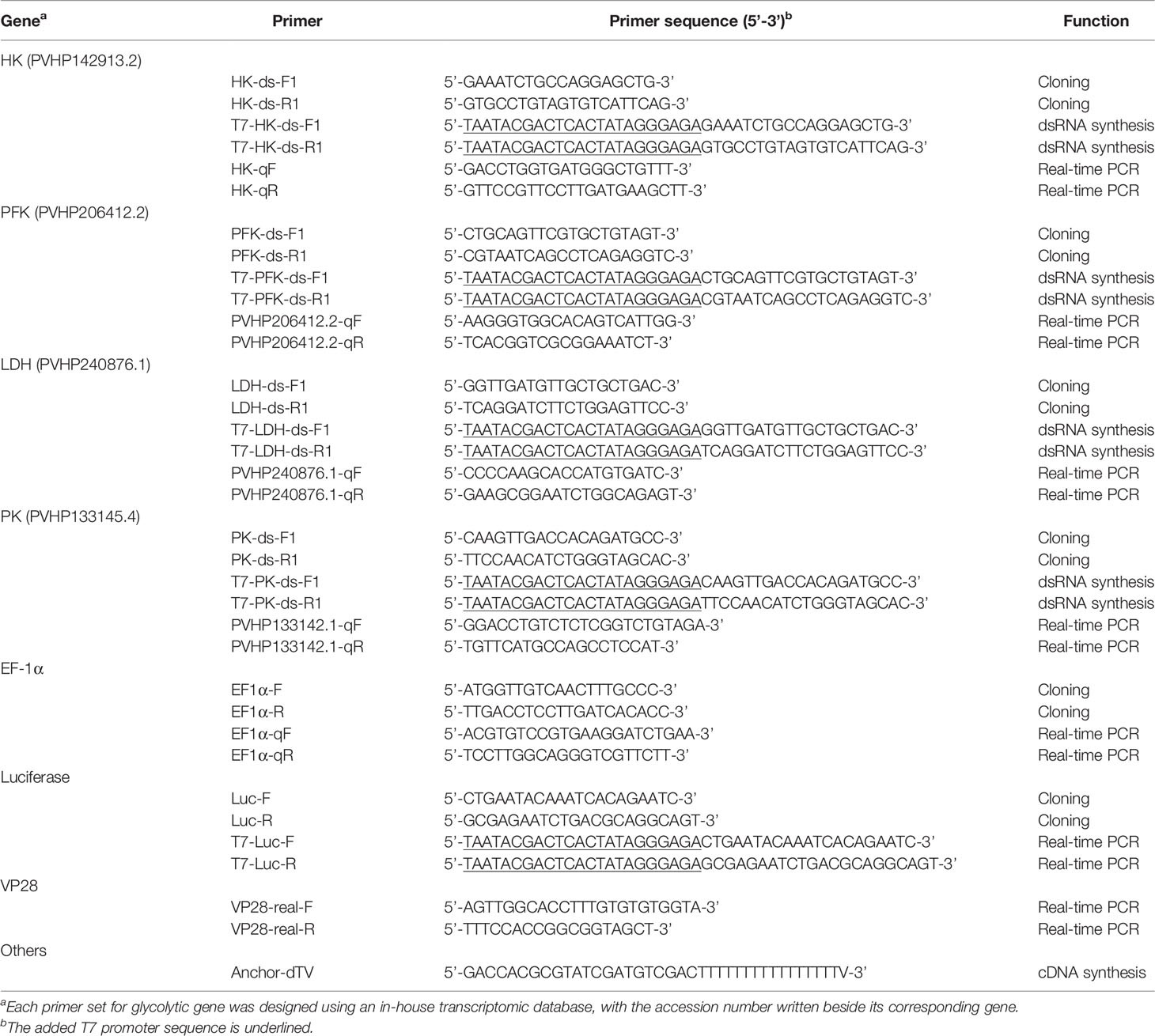
aBộ mồi cho gen glycolytic được thiết kế bằng cơ sở dữ liệu phiên mã nội bộ, với số gia nhập được viết bên cạnh gen tương ứng.
bTrình tự quảng bá T7 được thêm vào được gạch
2.3. Số bản sao bộ gen WSSV
Quá trình trích xuất DNA bộ gen từ động vật chân đốt thu được 24 giờ được thực hiện bằng bộ chiết xuất DNA DTAB/CTAB (GeneReach Biotechnology Corp.) và số lượng bản sao bộ gen WSSV được xác định bằng hệ thống định lượng IQ Real™ WSSV (GeneReach Biotechnology Corp.). Sự khác biệt giữa các nhóm được phát hiện bằng bài kiểm tra Student’s t-test.
2.4. Hoạt tính của Hexokinase (HK) trong tế bào máu của tôm bị nhiễm WSSV
Các tế bào máu được thu thập ở 12 và 24 giờ (6 tôm/ bể và 4 bể/ nhóm) được sử dụng để đánh giá hoạt tính của hexokinase, với bộ xét nghiệm so màu hexokinase (Biovision). Tế bào máu được đồng nhất với bộ đệm xét nghiệm 100 µl HK. Chất đồng nhất này được ủ trên băng trong 10 phút và được ly tâm ở tốc độ ~13.000 x g trong 5 phút. Nồng độ protein trong phần nổi phía trên được xác định bằng xét nghiệm Bradford (Cô đặc thuốc thử thuốc nhuộm xét nghiệm protein Bio-Rad). 5 μg protein hemocyte đã được thêm vào một đĩa 96 giếng, với việc bổ sung 50 μl bộ đệm xét nghiệm HK. Đường chuẩn NADH được chuẩn bị cùng với nhóm mẫu. Hỗn hợp phản ứng sau đó được thêm vào để bắt đầu phản ứng (34 µl dung dịch đệm thử nghiệm HK, 2 µl hỗn hợp enzyme HK, 2 µl HK developer, 2 µl HK coenzyme và 10 µl HK cơ chất). Các biện pháp đối chứng tổng quan đã được chuẩn bị theo các mẫu ngoại trừ chất nền HK không được thêm vào. Độ hấp thụ được xác định ở bước sóng 450nm và nhiệt độ phòng cứ sau 2 phút trong 50 phút, với sản lượng NADH được tính bằng đường cong chuẩn. Hoạt tính HK của mẫu được tính theo phương trình sau: (B2-B1)/(ΔT x P), trong đó B2 là NADH được tạo ra từ mẫu (nmol) tại thời điểm đọc lần thứ 2; B1 là lượng NADH được tạo ra từ mẫu (nmol) tại thời điểm đọc đầu tiên; ΔT là thời gian phản ứng giữa lần đọc đầu tiên và lần đọc thứ 2 (phút); và P là lượng protein được thêm vào. Sự khác biệt giữa các nhóm được phát hiện bằng bài kiểm tra Student’s t-test. B1 là lượng NADH được tạo ra từ mẫu (nmol) tại thời điểm đọc đầu tiên; ΔT là thời gian phản ứng giữa lần đọc đầu tiên và lần đọc thứ 2 (phút); và P là lượng protein được thêm vào. Sự khác biệt giữa các nhóm được phát hiện bằng bài kiểm tra Student’s t-test. B1 là lượng NADH được tạo ra từ mẫu (nmol) tại thời điểm đọc đầu tiên; ΔT là thời gian phản ứng giữa lần đọc đầu tiên và lần đọc thứ 2 (phút); và P là lượng protein được thêm vào. Sự khác biệt giữa các nhóm được phát hiện bằng bài kiểm tra Student’s t-test.
2.5. Hoạt tính của phosphofructokinase (PFK) trong tế bào máu của tôm bị nhiễm WSSV
Một bộ xét nghiệm so màu hoạt tính phosphofructokinase (Biovision) đã được sử dụng để đo hoạt tính PFK. Các tế bào máu được thu thập ở 12 và 24 giờ (6 tôm/ bể và 4 bể/ nhóm) được đồng nhất với 100 µl dung dịch đệm xét nghiệm PFK. Chất đồng nhất được ly tâm ở tốc độ ~13.000 x g trong 5 phút và xét nghiệm Bradford được thực hiện để định lượng nồng độ protein. Sau đó, 1,25 µg protein hemocyte được thêm vào đĩa 96 giếng, và thêm vào 50 µl dung dịch đệm xét nghiệm PFK. Phản ứng được bắt đầu ở 37°C bằng cách thêm hỗn hợp phản ứng chứa 42 µl dung dịch đệm xét nghiệm PFK, 2 µl hỗn hợp enzym PFK, 2 µl chất phát triển PFK, 2 µl ATP và 2 µl chất nền PFK. Các biện pháp đối chứng tổng quan đã được chuẩn bị theo các mẫu ngoại trừ chất nền PFK không được thêm vào. Đường chuẩn NADH được chuẩn bị cùng với nhóm mẫu. Toàn bộ hỗn hợp được đọc ở bước sóng 450 nm mỗi phút trong 40 phút.
2.6. Hoạt tính của Pyruvate Kinase (PK) trong tế bào máu của tôm bị nhiễm WSSV
Trong các tế bào máu được thu thập ở 12 và 24 giờ (6 tôm/ bể và 4 bể/ nhóm), hoạt tính PK được xác định bằng bộ xét nghiệm đo màu/đo huỳnh quang hoạt tính pyruvate kinase (Biovision). Các tế bào máu được đồng nhất với 100 µl dung dịch đệm xét nghiệm PK và các mảnh vụn của tế bào được loại bỏ bằng cách ly tâm chất đồng nhất (10.000 x g trong 1 phút). Sau khi nồng độ protein được xác định, 2.5 μg protein hemocyte được thêm vào một đĩa 96 giếng, tiếp theo là 50 μl dung dịch đệm xét nghiệm PK. Một đường chuẩn pyruvate cũng đã được chuẩn bị. Phản ứng được bắt đầu ở nhiệt độ phòng bằng cách thêm 44 μl dung dịch đệm xét nghiệm PK, 2 μl hỗn hợp chất nền, 2 μl hỗn hợp enzyme và 2 μl Chất kiểm soát nền thăm dò OxiRed™ đã được chuẩn bị theo các mẫu ngoại trừ hỗn hợp chất nền không được thêm vào. Hoạt động được đo ở bước sóng 570nm mỗi phút trong 20 phút và hoạt động được tính như sau: (B2-B1)/(ΔT x P).
2.7. Hoạt tính của Lactate Dehydrogenase (LDH) trong tế bào máu của tôm bị nhiễm WSSV
Hoạt tính LDH trong tế bào máu được thu thập ở 12 và 24 giờ (6 tôm/ bể và 4 bể/ nhóm) được đánh giá bằng bộ xét nghiệm so màu hoạt tính lactate dehydrogenase (Biovision). Sau khi các tế bào máu được đồng nhất hóa trong 150 μl dung dịch đệm xét nghiệm LDH, chất đồng nhất này được ly tâm ở tốc độ 10.000 x g trong 15 phút ở 4°C và nồng độ protein trong dịch nổi phía trên được định lượng bằng xét nghiệm Bradford. Sau đó, 10 μg protein hemocyte được đưa đến thể tích cuối cùng là 50 μl với dung dịch đệm xét nghiệm LDH. Phản ứng được bắt đầu ở 37°C bằng cách thêm 48 μl dung dịch đệm xét nghiệm LDH và 2 μl dung dịch hỗn hợp cơ chất và hoạt tính được xác định ở bước sóng 450 nm cứ sau 2 phút trong 30 phút. Hoạt động được tính toán với phép tính sau: (B2-B1)/(ΔT x P). Bài kiểm tra Student’s t-test đã được sử dụng để phát hiện sự khác biệt.
2.8. Glycolytic Enzyme vô hiệu hóa gen In Vivo bằng sự can thiệp của dsRNA
Cơ sở dữ liệu phiên mã dạ dày L. vannamei nội bộ được thiết lập với trình tự thế hệ tiếp theo (dữ liệu không được hiển thị) đã được sử dụng để thiết kế các bộ mồi cho từng gen glycolysis. Trình tự của các bộ mồi được liệt kê trong Bảng 1. Một phần trình tự đối chứng HK, PFK, PK, LDH và luciferase được khuếch đại bằng cách sử dụng PCR và các bộ mồi tương ứng: HK-ds-F1/HK-ds-R1, PFK-ds-F1/PFK-ds-R1, LDH-ds-F1/LDH-ds-R1, PK-ds-F1/PK-ds-R1 và Luc-F/Luc-R. Trình tự khởi đầu T7 sau đó được tích hợp vào bộ khuếch đại bằng PCR, sử dụng các bộ mồi sau: HK: T7-HK-ds-F1/HK-ds-R1 và HK-ds-F1/T7-HK-ds-R1; PFK: T7-PFK-ds-F1/PFK-ds-R1 và PFK-ds-F1/T7-PFK-ds-R1; LDH: T7-LDH-ds-F1/LDH-ds-R1 và LDH-ds-F1/T7-LDH-ds-R1; PK: T7-PK-ds-F1/PK-ds-R1 và PK-ds-F1/T7-PK-ds-R1; Luc: T7-Luc-F/Luc-R và Luc-F/T7-Luc-R. Một bộ khuếch đại neo T7 đã được sử dụng để tạo ssRNA bằng cách sử dụng bộ hệ thống sản xuất RNA quy mô lớn T7 RiboMax™ express (Promega). Hai ssRNA bổ sung được ủ với nhau để tổng hợp DSRNA, được tinh chế bằng chiết xuất phenol/chloroform.
Tôm (~3 g trọng lượng cơ thể) được tiêm dsRNA tổng hợp (pha loãng với PBS được lọc 0,22 µm, 1 μg/g tôm) 3 ngày trước khi tiêm vi rút. Luciferase dsRNA hoặc PBS đóng vai trò đối chứng. Vào lúc 72 giờ sau khi tiêm dsRNA, một số tế bào máu đã được thu thập (3 con tôm/bể, 4 bể/nhóm) để xác nhận hiệu quả của việc vô hiệu hóa gen, trong khi những con tôm còn lại được tiêm chất cấy vi rút hoặc được sử dụng làm đối chứng.
2.9. Chất đánh dấu glucose được dán nhãn đồng vị ổn định và sắc ký lỏng Electrospray ion hóa khối phổ (LC-ESI-MS) để theo dõi các chất chuyển hóa
Tôm bị nhiễm WSSV được tiêm glucose [U-13C] để tạo điều kiện truy tìm đồng vị carbon ổn định thông qua quá trình glycolysis (Hình 1). Thủ tục đã được thực hiện như mô tả (15). Tóm lại, glucose [U-13C] đánh dấu đồng vị ổn định (Cambridge Isotope Laboratories Inc., Hoa Kỳ) được tiêm vào xoang máu bụng (tôm 450 μg/g) ở 12 hoặc 24 giờ. Vào lúc 10 hoặc 30 phút sau khi tiêm chất đánh dấu, các mẫu tế bào máu (3 tôm/bể, 4 bể/nhóm) đã được thu thập và MeOH được sử dụng để chiết xuất các chất chuyển hóa, được đông khô và chịu các phân tích LC-ESI-MS.
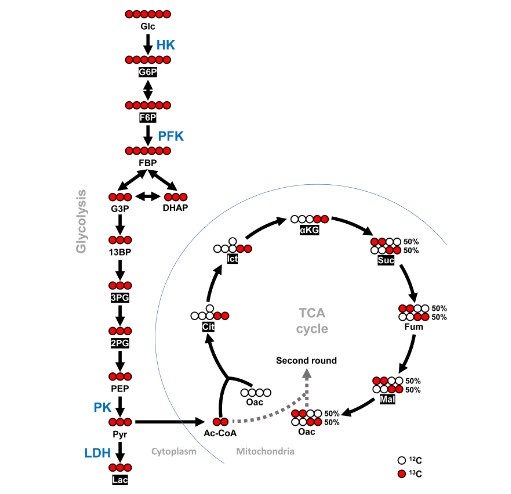
Hình 1. Sơ đồ glucose [U-13C] đi vào chu trình TCA thông qua quá trình glycolysis. Các chất chuyển hóa 13C được phát hiện trong nghiên cứu này được hiển thị bằng phông chữ màu trắng trong hộp đen. Vòng tròn màu đỏ đại diện cho carbon-13 (13C) và vòng tròn màu trắng đại diện cho carbon-12 (12C). Biểu đồ này đã được điều chỉnh và sửa đổi từ McDonald và cộng sự (23) và Courtney và cộng sự (24). Đối với chất chuyển hóa, Glc, Glucose; G6P, Glucose-6-photphat; F6P, Fructose-6-photphat; FBP, Fructoza 1,6-biphotphat; G3P, Glyceraldehyd-3-photphat; DHAP, Dihydroxyacetone photphat; 13BP, 1,3-Bisphosphoglycerate; 3PG, 3-Phosphoglycerate; 2PG, 2-Phosphoglyxerat; PEP, Phosphoenolpyruvate; Pyr, Pyruvat; Lạc, Lactate; Ac-CoA, Acetyl-CoA; Xit, xitrat; Ict, Isocitrate; αKG, α-Ketoglutarate; Suc, Succinat; Fum, Fumarat; Mal, Malate; và Oac, Oxaloacetate. Đối với các enzyme, HK, Hexokinase; PFK, Phosphofructokinase; PK, Pyruvate kinase; và LDH, Lactate dehydrogenase.
Hệ thống sắc ký lỏng siêu hiệu năng (UPLC) (Ultimate 3000 RSLC, Dionex) và khối phổ kế thời gian bay bốn cực (QTOF) với nguồn ion hóa phun điện (ESI) (hệ thống maXis HURQToF, Bruker Daltonics) đã được sử dụng cho LC-ESI -MS phân tích. Mẫu chất chuyển hóa được hòa tan trong ddH2O, dung dịch đệm phản ứng (anilin 0,3 M [Sigma-Aldrich, USA] trong HCl 60 mM), và N-(3-dimenthylaminopropyl)-N’-ethylcarbodiimide hydrochloride (EDC; Sigma-Aldrich, USA) và ủ trong 2 giờ ở 25°C, thêm 10% amoni hydroxit để dừng phản ứng. Các dẫn xuất được xử lý bằng sắc ký lỏng pha đảo (RPLC) với cột BEH C18 (2,1 x 100 mm, Waters). Quá trình rửa giải bắt đầu từ 99% pha động A (0,1% axit formic trong ddH2O) và 1% pha động B (axit formic 0,1% trong ACN), giữ ở 1% B trong 0,5 phút, tăng lên 60% B trong 6 phút, tiếp tục tăng lên 90% B trong 0,5 phút, giữ ở 90% B trong 1,5 phút, sau đó giảm xuống 1% B trong 0,5 phút; sau đó, 1% B được sử dụng để cân bằng cột trong 4 phút. Thể tích tiêm là 10 µl và tốc độ dòng là 0,3 ml/phút. Sắc ký đồ LC-ESI-MS thu được dưới điện áp mao quản 4.500 hoặc 3.500 V ở chế độ ion âm, nhiệt độ khô 190°C, lưu lượng khí khô duy trì ở mức 8 l/phút, khí phun sương ở 1,4 bar, và phạm vi thu nhận từ 100-1.000 m/z.
Phần mềm điều khiển HyStar và microOTOF (Bruker Daltonics) đã được sử dụng để lấy dữ liệu, được đánh giá bằng phần mềm DataAnalysis và TargetAnalysis (Bruker Daltonics). Để theo dõi những thay đổi về số lượng của các chất chuyển hóa được dán nhãn 13C, các thay đổi về số lần trong nhóm WSSV được tính toán tương ứng với nhóm PBS tương ứng (nhóm WSSV/PBS). Tất cả số lượng tín hiệu đã được chuẩn hóa theo trọng lượng mẫu và sự khác biệt giữa các nhóm được phân tích bằng bài kiểm tra Student’s t-test.
2.10. Ảnh hưởng của 2-Deoxy-D-Glucose (2-DG) đối với sự sao chép của WSSV
Để nghiên cứu sự liên quan của quá trình glycolysis trong quá trình sao chép WSSV, 2-DG (Sigma), một chất tương tự cấu trúc của glucose, đã được sử dụng để phá vỡ quá trình glycolysis ở tôm bị nhiễm WSSV. Tôm được tiêm 100 μl dung dịch 2-DG (hòa tan trong PBS được lọc 0,22 µm, 0,5 mg/g tôm) 2 lần trước khi nhiễm WSSV (lúc 1 ngày và 2 giờ trước khi nhiễm vi-rút), với tôm được tiêm PBS như một điều khiển. Việc lấy mẫu được thực hiện ở 24 giờ và chịu sự biểu hiện của gen cấu trúc WSSV (VP28) và định lượng số lượng bản sao bộ gen của WSSV.
3. Kết quả
3.1. Hexokinase (HK) được yêu cầu để sao chép WSSV
Trong nghiên cứu này, 4 enzyme glycolysis quan trọng là HK, PFK, PK và LDH đã được phân tích (Hình 1). Hexokinase xúc tác bước đầu tiên của quá trình glycolysis, phosphoryl hóa glucose thành glucose-6-phosphate. Ở tôm bị nhiễm WSSV, biểu hiện gen HK tăng lên ở mức 12 và 24 giờ (Hình 2A). Về hoạt động của HK, không có sự thay đổi về tế bào máu của tôm bị nhiễm WSSV so với tôm được điều trị bằng PBS ở 12 giờ; tuy nhiên, ở mức 24 giờ, hoạt động đã giảm ở tôm bị nhiễm WSSV (Hình 2B).
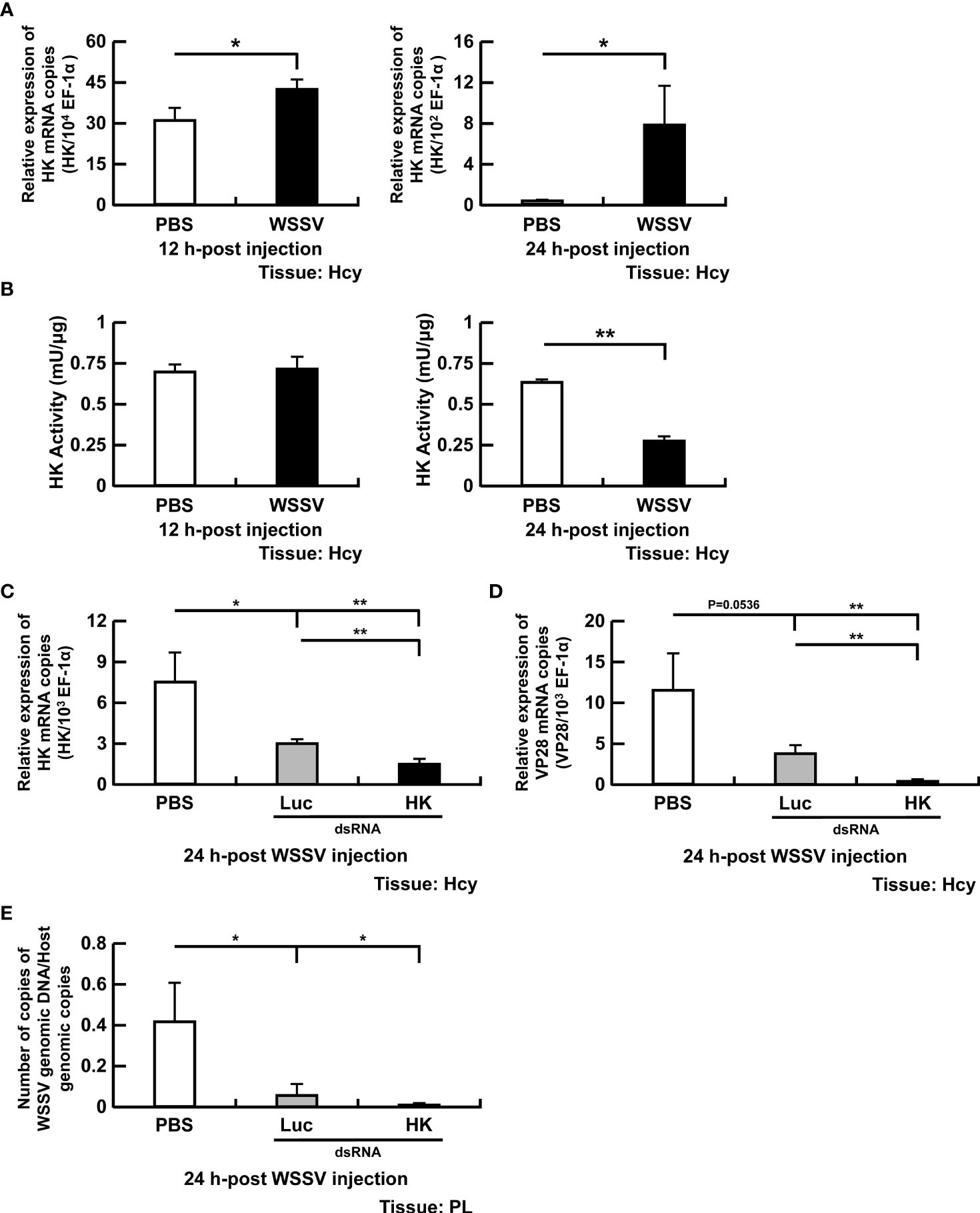
Hình 2. Sự tham gia của HK trong quá trình sao chép WSSV. (A, B) Mức độ mRNA và hoạt động của enzyme HK trong tế bào máu của tôm trong quá trình nhiễm WSSV. (C) Để vô hiệu hóa dsRNA HK, biểu hiện gen của HK trong tế bào máu tôm được phân tích bằng PCR thời gian thực sau 24 giờ sau khi tiêm WSSV. (D, E) Ảnh hưởng của việc vô hiệu hóa gen của HK đối với sự biểu hiện của gen cấu trúc VP28 và số lượng bản sao bộ gen của WSSV sau 24 giờ sau khi tiêm WSSV. Các nhóm chỉ được xử lý bằng PBS hoặc bằng dsRNA luciferase (Luc) không đặc hiệu được sử dụng làm nhóm đối chứng. Số lượng bản sao bộ gen của WSSV đã giảm 484 lần trong nhóm dsRNA HK so với nhóm dsRNA Luc. Mỗi thanh đại diện cho giá trị trung bình ± SD. Dấu hoa thị biểu thị sự khác biệt giữa các nhóm được chỉ định (*p <0,05; **p <0,01). Hcy: Tế bào máu; và PL, chân bơi.
Để điều tra thêm về tầm quan trọng của HK trong sao chép WSSV, quá trình im lặng in vivo qua trung gian dsRNA của HK đã được thực hiện. Ở thời điểm 72 giờ sau xử lý dsRNA HK, một số lượng lớn tôm chết đã được quan sát thấy. Tôm sống sót được tiêm WSSV và tế bào máu được thu thập 24 giờ sau đó. Biểu hiện mRNA của HK đã bị dsRNA HK triệt tiêu đáng kể ở mức 24 giờ so với đối chứng PBS hoặc luciferase (Hình 2C). Hơn nữa, biểu hiện mRNA WSSV VP28 (Hình 2D) và số lượng bản sao bộ gen WSSV (Hình 2E) đã giảm ở tôm được tiêm WSSV được xử lý trước bằng dsRNA HK.
3.2. Phosphofructokinase (PFK) và Lactate Dehydrogenase (LDH) được yêu cầu để sao chép WSSV
Phosphofructokinase, một enzyme giới hạn tốc độ trong quá trình glycolysis, thúc đẩy quá trình phosphoryl hóa fructose-6-phosphate thành fructose 1,6-bisphosphate. Ở 12 và 24 giờ, biểu hiện gen PFK đã tăng lên ở tôm bị nhiễm WSSV so với đối chứng PBS (Hình 3A). Hoạt tính PFK tăng lên ở các tế bào máu bị nhiễm WSSV so với các tế bào máu được điều trị bằng PBS ở 12 giờ, trong khi ở 24 giờ, hoạt tính PFK giảm đáng kể (Hình 3B).
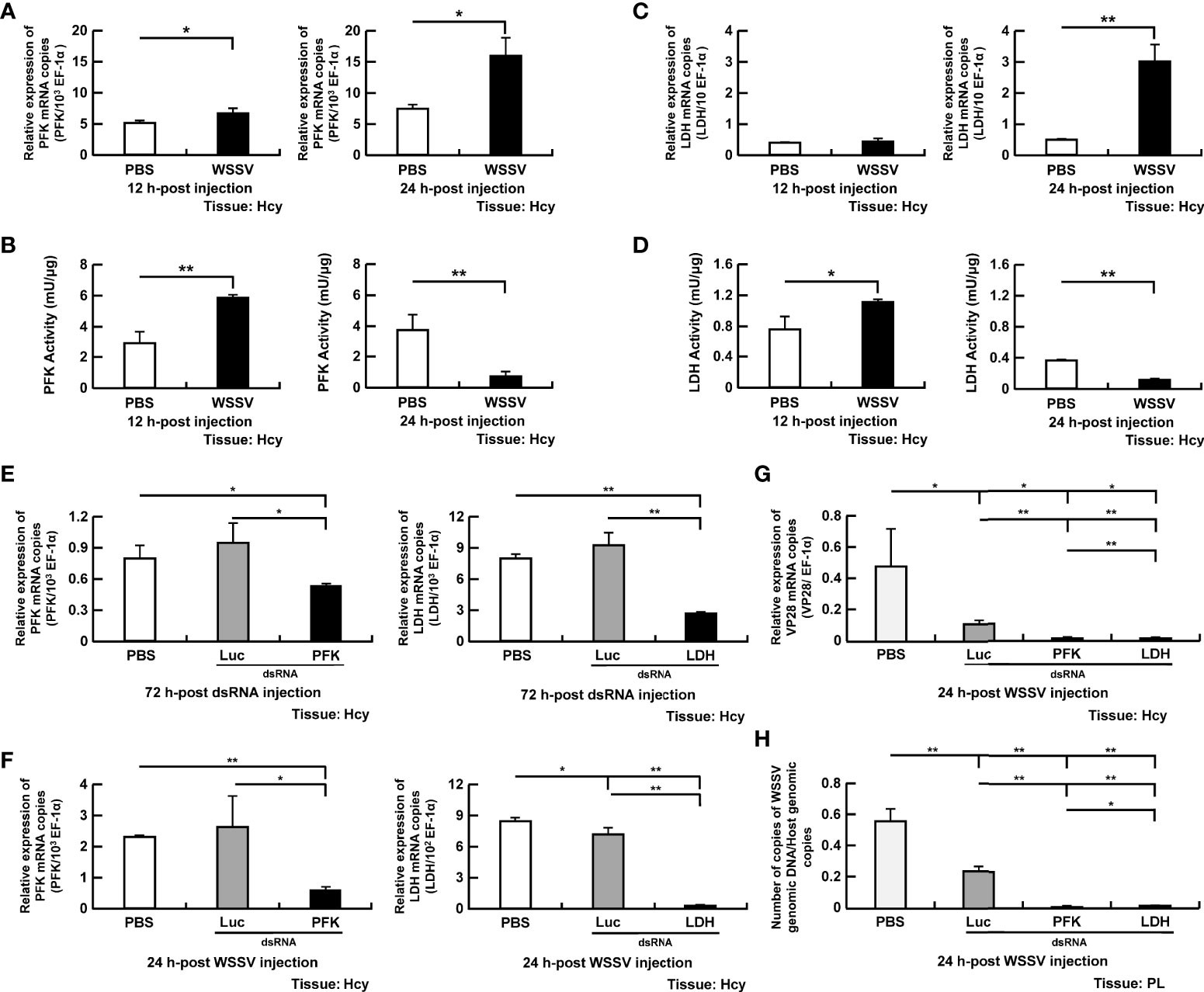
Hình 3. Sự tham gia của PFK và LDH trong quá trình sao chép WSSV (A, B) Mức độ mRNA và hoạt tính enzyme của PFK trong tế bào máu của tôm trong quá trình nhiễm WSSV. (C, D) Mức độ mRNA và hoạt tính enzyme của LDH trong tế bào máu của tôm trong quá trình nhiễm WSSV. (E) Để vô hiệu hóa PFK và dsRNA LDH, biểu hiện gen của PFK và LDH trong tế bào máu của tôm được phân tích bằng PCR thời gian thực sau 72 giờ sau khi tiêm dsRNA tương ứng và trước cảm nhiễm WSSV. (F) Biểu hiện gen của các gen trên được đo lại ở tôm được xử lý bằng dsRNA sau 24 giờ nhiễm WSSV. (GH) Ảnh hưởng của việc vô hiệu hóa gen của PFK và LDH đối với sự biểu hiện của gen cấu trúc VP28 và số lượng bản sao bộ gen của WSSV sau 24 giờ sau khi tiêm WSSV. Các nhóm chỉ được xử lý bằng PBS hoặc bằng dsRNA luciferase (Luc) không đặc hiệu được sử dụng làm nhóm đối chứng. Số bản sao bộ gen của WSSV lần lượt giảm 79 lần và 18 lần ở nhóm PFK và dsRNA LDH, so với nhóm dsRNA Luc. Mỗi thanh đại diện cho giá trị trung bình ± SD. Dấu hoa thị cho biết sự khác biệt giữa các nhóm được chỉ định (*p <0,05; **p <0,01). Hcy, Hemocytes, PL, chân bơi.
Lactate dehydrogenase, men chuyển pyruvate thành lactate, cũng được chọn cho nghiên cứu. Mặc dù biểu hiện gen LDH không thay đổi ở tôm bị nhiễm WSSV ở 12 giờ (Hình 3C), nhưng hoạt tính của LDH trong tế bào máu đã tăng lên (Hình 3D). Ở 24 giờ, biểu hiện gen của LDH đã tăng lên đáng kể ở nhóm nhiễm WSSV (Hình 3C), nhưng hoạt tính lại giảm ở các tế bào máu (Hình 3D).
Để khám phá thêm vai trò của PFK và LDH trong quá trình sao chép WSSV, tôm được xử lý bằng dsRNA tương ứng để ngăn chặn biểu hiện gen. Biểu hiện gen của PFK và LDH đã bị ức chế ở tôm được điều trị bằng dsRNA tương ứng trước khi nhiễm vi-rút và ở 24 giờ (Hình 3E, F). Cả hai chế độ vô hiệu hóa PFK và LDH đều làm giảm đáng kể biểu hiện mRNA của WSSV VP28 (Hình 3G) và số lượng bản sao bộ gen của WSSV (Hình 3H).
3.3. Pyruvate Kinase (PK) được yêu cầu để sao chép WSSV
Pyruvate kinase là một enzyme giới hạn tốc độ xúc tác bước cuối cùng của quá trình glycolysis bằng cách chuyển phosphoenolpyruvate thành pyruvate. Biểu hiện của PK không thay đổi ở tôm bị nhiễm WSSV ở 12 giờ, trong khi sự gia tăng đáng kể biểu hiện xảy ra ở 24 giờ (Hình 4A). Trái ngược với biểu hiện gen, hoạt động PK tăng lên ở các tế bào máu bị nhiễm WSSV ở 12 giờ, nhưng giảm ở 24 giờ (Hình 4B). Sau khi điều trị bằng dsRNA PK, biểu hiện thấp của PK trong nhóm vô hiệu hóa cho thấy rằng quá trình vô hiệu hóa gen qua trung gian dsRNA PK đã thành công (Hình 4). PK vô hiệu hóa làm giảm đáng kể cả biểu hiện mRNA WSSV VP28 (Hình 4D) và sao chép bộ gen WSSV (Hình 4E).
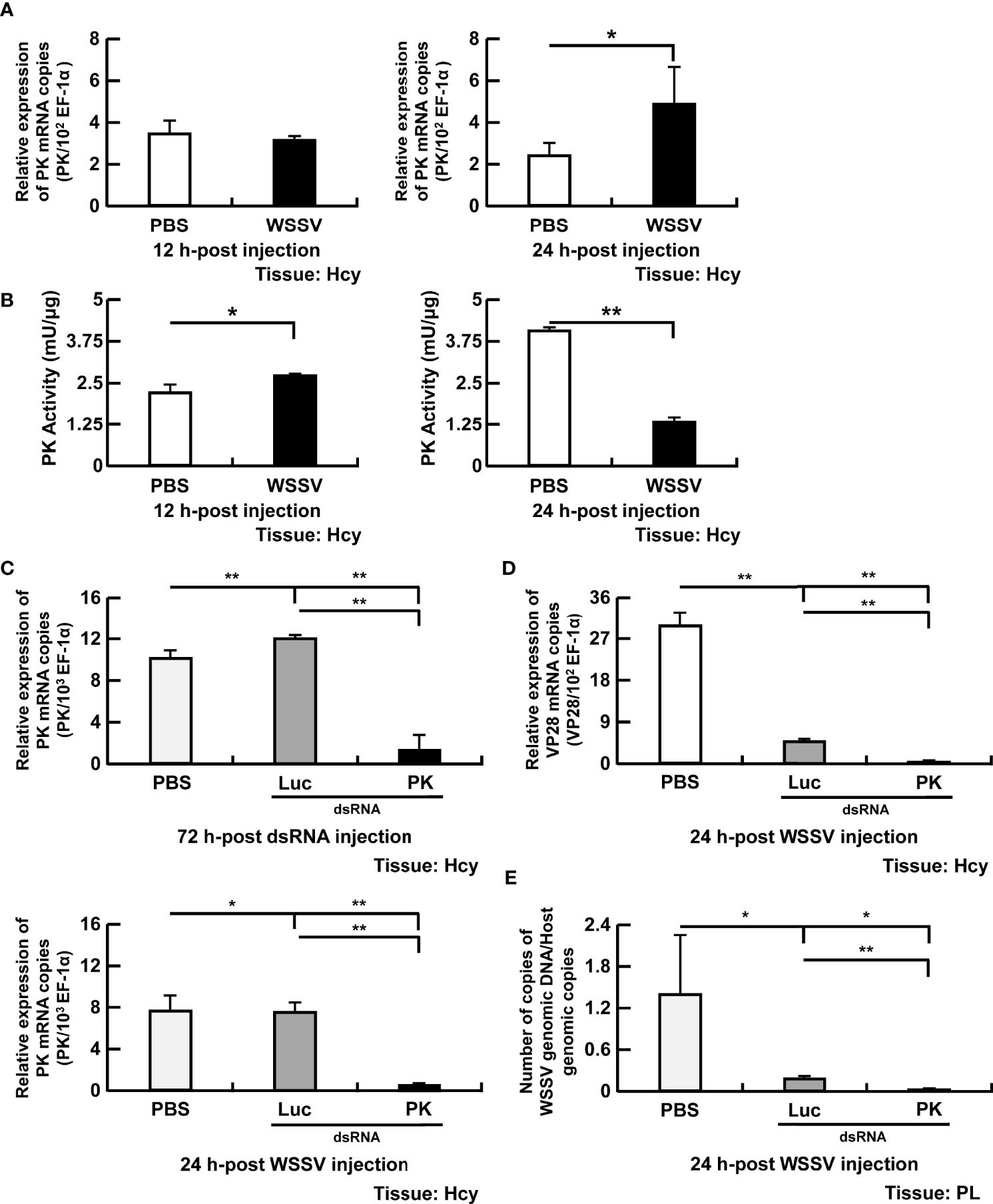
Hình 4. Sự tham gia của PK trong quá trình sao chép WSSV. (A, B) Mức độ mRNA và hoạt tính enzyme của PK trong tế bào máu của tôm trong quá trình nhiễm WSSV. (C) Để vô hiệu hóa dsRNA PK, biểu hiện gen của PK trong tế bào máu tôm được phân tích bằng PCR thời gian thực sau 72 giờ sau khi tiêm dsRNA PK và trước cảm nhiễm WSSV. Biểu hiện gen PK được đo lại ở tôm được xử lý bằng dsRNA sau 24 giờ sau khi tiêm WSSV. (D, E) Ảnh hưởng của việc vô hiệu hóa gen của PK đối với sự biểu hiện của gen cấu trúc VP28 và số lượng bản sao bộ gen của WSSV sau 24 giờ sau khi tiêm WSSV. Các nhóm chỉ được xử lý bằng PBS hoặc bằng dsRNA luciferase (Luc) không đặc hiệu được sử dụng làm nhóm đối chứng. Số lượng bản sao bộ gen của WSSV đã giảm 225 lần trong nhóm dsRNA PK so với nhóm dsRNA Luc. Mỗi thanh đại diện cho giá trị trung bình ± SD. Dấu hoa thị cho biết sự khác biệt giữa các nhóm được chỉ định (*p <0,05; **p <0,01). Hcy, Tế bào máu; và PL, chân bơi.
3.4. Theo dõi các chất chuyển hóa In Vivo có nguồn gốc từ glucose [U- 13C] được tiết lộ Glycolysis được kích hoạt ở giai đoạn sao chép bộ gen của virus (12 giờ)
Tôm bị nhiễm WSSV được tiêm glucose [U- 13C] ở 12 giờ để điều tra chất chuyển hóa glycolysis trong quá trình sao chép của WSSV. Cụ thể, carbon-13 (13C) từ glucose [U- 13C] được đánh dấu được theo dõi thông qua con đường glycolysis và chu trình TCA khi nó được chuyển đến các chất chuyển hóa xuôi dòng trong quá trình hoạt tính của enzyme (Hình 1). Mặc dù mức độ carbon được đánh dấu trong một số chất chuyển hóa là không thể phát hiện được, nhưng có sự gia tăng đáng kể trong các chất chuyển hóa glycolysis glucose-6-photphat (G6P), fructose-6-photphat (F6P), 3-phosphoglycerate (3-PG) và 2 -phosphoglycerate (2-PG) trong nhóm WSSV sau 10 phút sau khi tiêm chất đánh dấu, trong khi ở chu trình TCA, isocitrate (Ict) tăng và α-ketoglutarate (α-KG) giảm (Hình 5A). Sau 30 phút sau khi tiêm chất đánh dấu, cả citrate (Cit) và isocitrate (Ict) đều tăng (Hình 5B). Sự thay đổi chất chuyển hóa 10 phút sau khi tiêm chất đánh dấu (ở 12 giờ) được tóm tắt trong Hình 5C và dữ liệu chuyển hóa thô được cung cấp trong Bảng S1.
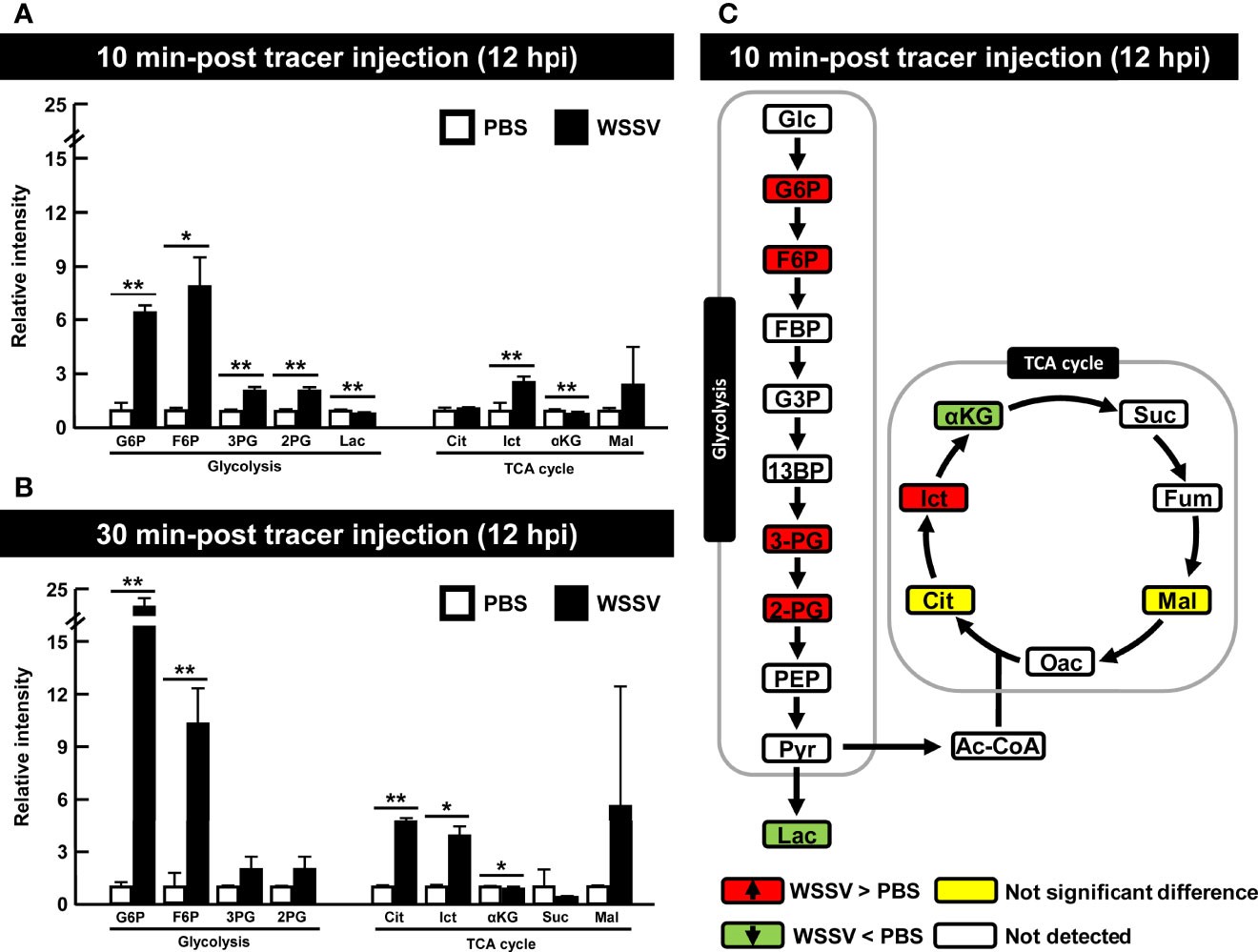
Hình 5. Glycolysis được kích hoạt bởi WSSV ở giai đoạn sao chép bộ gen của vi rút (12 giờ). Vào lúc 12 giờ sau cảm nhiễm với WSSV hoặc PBS, tôm được tiêm glucose [U- 13C] và tế bào máu được thu thập sau (A) 10 phút hoặc (B) 30 phút tiêm chất đánh dấu. Dữ liệu trao đổi chất được tạo bằng LC-ESI-Q-TOF-MS. Sự thay đổi số lần của từng chất chuyển hóa 13C trong nhóm WSSV so với chất chuyển hóa 13C tương ứng trong nhóm PBS đã được tính toán. Mỗi thanh đại diện cho giá trị trung bình ± SD. Dấu hoa thị cho biết sự khác biệt giữa các nhóm WSSV và PBS (*p < 0,05; **p < 0,01). (C) Tổng quan về những thay đổi của chất chuyển hóa 13C ở tôm nhiễm WSSV (12 giờ) sau 10 phút sau [U-13C] tiêm glucose. Các thay đổi trong nhóm WSSV so với đối chứng PBS tương ứng được đánh giá là tăng đáng kể (Đỏ), không khác biệt đáng kể (Vàng), giảm đáng kể (Xanh lục) hoặc không được phát hiện (Trắng). Các chữ viết tắt giống như các chữ viết tắt được sử dụng trong Hình 1.
3.5. Theo dõi Các chất chuyển hóa In Vivo có nguồn gốc từ Glucose [U- 13C] được đề xuất Glycolysis không được kích hoạt ở giai đoạn cuối của virus (24 giờ)
Ở 24 giờ, mặc dù G6P là chất chuyển hóa duy nhất tăng đáng kể sau 10 phút sau khi tiêm chất đánh dấu (Hình 6A), một số chất chuyển hóa chu trình glycolytic và TCA khác cũng tăng lên trong nhóm WSSV sau 30 phút sau khi tiêm chất đánh dấu (Hình 6B). Hình 6C minh họa các kết quả của Hình 6A và dữ liệu chuyển hóa thô được cung cấp trong Bảng S2.
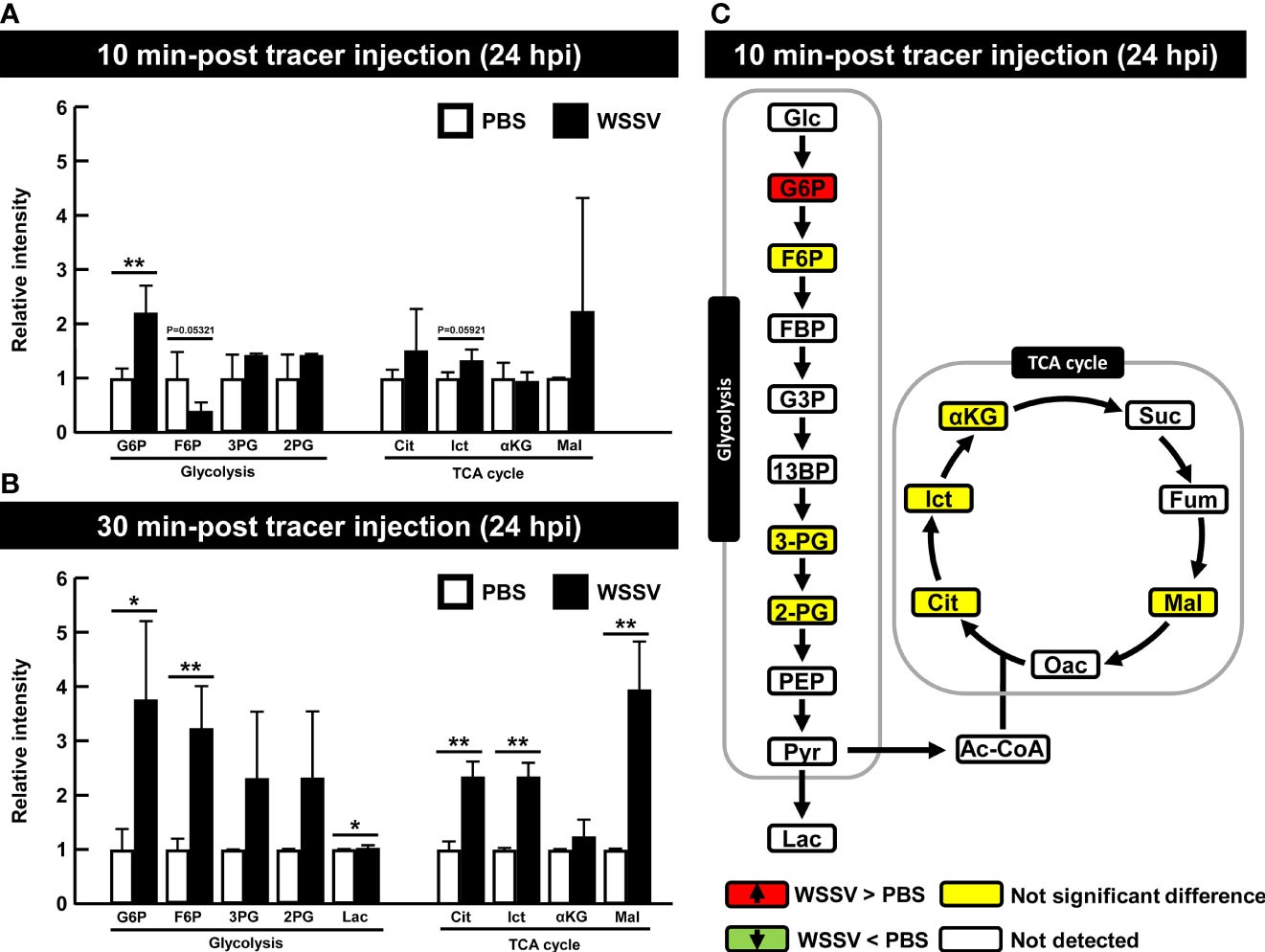
Hình 6. Các tế bào máu bị nhiễm WSSV đã bị vô hiệu hóa quá trình glycolysis ở giai đoạn cuối của vi rút (24 giờ) Vào 24 giờ sau khi cảm nhiễm với WSSV hoặc PBS, tôm được tiêm [U-13C] glucose và các tế bào máu được thu thập sau (A) 10 phút hoặc (B) 30 phút tiêm chất đánh dấu. Dữ liệu trao đổi chất được tạo bằng LC-ESI-Q-TOF-MS. Sự thay đổi số lần của từng chất chuyển hóa 13C trong nhóm WSSV so với chất chuyển hóa 13C tương ứng trong nhóm PBS đã được tính toán. Mỗi thanh đại diện cho giá trị trung bình ± SD. Dấu hoa thị cho biết sự khác biệt giữa các nhóm WSSV và PBS (*p < 0,05; **p < 0,01). (C) Tổng quan về những thay đổi của chất chuyển hóa 13C ở tôm nhiễm WSSV (24 giờ) sau 10 phút sau [U-13C] tiêm glucose. Các thay đổi trong nhóm WSSV so với đối chứng PBS tương ứng được đánh giá là tăng đáng kể (Đỏ), không khác biệt đáng kể (Vàng), giảm đáng kể (Xanh lục) hoặc không được phát hiện (Trắng). Các chữ viết tắt như trong Hình 1.
3.6. Sự gián đoạn quá trình glycolysis cản trở sự sao chép của WSSV
Để xác minh thêm mối liên quan giữa quá trình glycolysis và sự nhân lên của virus, tôm được xử lý bằng chất tương tự glucose (2-DG) và được lấy mẫu ở 24 giờ. Gen cấu trúc VP28 của WSSV (Hình 7A) và số lượng bản sao bộ gen của WSSV (Hình 7B) đã giảm đáng kể ở tôm bị nhiễm WSSV được xử lý trước bằng 2-DG.
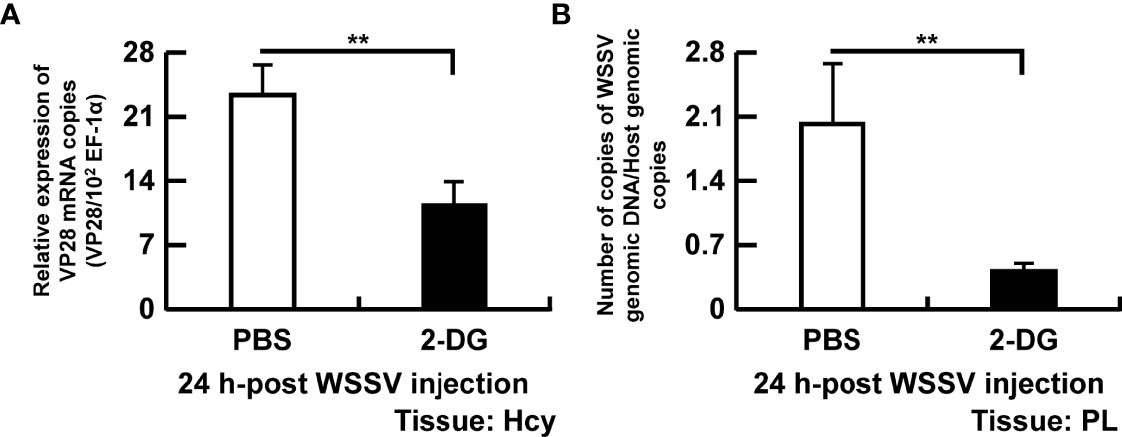
Hình 7. Sự gián đoạn của quá trình glycolysis cản trở sự sao chép của WSSV. Để xác định tầm quan trọng của quá trình glycolysis trong sao chép WSSV, tôm được tiêm 0,5 mg/g 2-DG hai lần trước cảm nhiễm WSSV và phân tích được thực hiện 24 giờ sau cảm nhiễm WSSV. (A) Biểu hiện gen của gen cấu trúc VP28 của WSSV trong tế bào máu của tôm. (B) Số lượng bản sao bộ gen của WSSV được định lượng trong chân bơi. Số lượng bản sao bộ gen của WSSV đã giảm 5 lần ở nhóm được tiêm 2-DG so với nhóm được tiêm PBS. Mỗi thanh đại diện cho giá trị trung bình ± SD. Dấu hoa thị cho biết sự khác biệt giữa các nhóm WSSV và PBS (** p < 0,01). Hcy, Tế bào máu; và PL, hân bơi.
4. Thảo luận
Là một ký sinh trùng nội bào bắt buộc, sự nhân lên của vi rút phụ thuộc rất nhiều vào quá trình trao đổi chất của tế bào chủ, đặc biệt là quá trình glycolysis đóng vai trò là nguồn carbon. Trong nghiên cứu này, 2 deoxy-D-glucose (2-DG) được sử dụng làm chất tương tự glucose để nghiên cứu vai trò của quá trình glycolysis trong quá trình sao chép WSSV. Hợp chất này làm gián đoạn quá trình glycolysis ở tôm và làm suy yếu quá trình sao chép của WSSV (Hình 7), tương tự như tác dụng đối với vi rút viêm gan B (HBV), vi rút herpes, vi rút rhov (RV). Kết quả là quá trình glycolysis rất quan trọng đối với sự sao chép của WSSV.
Nhiều loại vi-rút điều chỉnh các enzyme glycolysis để điều chỉnh tăng quá trình glycolysis nhằm tạo điều kiện thuận lợi cho sự nhân lên của vi-rút. Ví dụ, protein Avian reovirus σA kích hoạt sự biểu hiện của các enzyme glycolysis thông qua HIF-1α, do đó thúc đẩy quá trình glycolysis. Khi nhiễm EBV, sự biểu hiện protein của các enzyme glycolysis được tăng lên thông qua LMP1 được mã hóa bởi EBV để hỗ trợ việc bổ sung glycolysis của nó. Hơn nữa, sự tái điều hòa của các gen glycolytic đã được báo cáo trong các trường hợp nhiễm vi-rút ở động vật có xương sống, ví dụ vi-rút Epstein-Barr (LDH), vi-rút herpes simplex (PFK), vi-rút herpes 6A ở người (HK & LDH) và vi-rút cúm A (HK & PK). Để hiểu quy định về quá trình glycolysis trong nhiễm trùng WSSV, trước tiên đã nghiên cứu biểu hiện của 4 loại enzyme (HK, PFK, LDH và PK) chi phối tốc độ glycolysis (Hình 1). Đã có chứng minh rằng nhiễm WSSV làm tăng biểu hiện gen của HK và PFK (Hình 2A, 3A), chứ không phải LDH hoặc PK (Hình 3C, 4A), ở giai đoạn sao chép bộ gen của vi rút (12 giờ). Liu và cộng sự (2017) cũng báo cáo rằng nhiễm WSSV làm tăng biểu hiện của HK và PFK ở Exopalaemon carinicauda. Hơn nữa, WSSV đã kích hoạt quá trình glycolysis để hỗ trợ quá trình sao chép và nó cũng làm tăng biểu hiện protein của một số enzyme glycolysis, ví dụ HK và PK. Trong nghiên cứu này, các hoạt tính của PFK, LDH và PK đã tăng lên ở giai đoạn sao chép bộ gen của vi rút (12 giờ), trong khi HK thì không (Hình 2B, 3B, D và 4B). Vô hiệu hóa các enzyme glycolysis này làm suy yếu quá trình sao chép của vi rút về mặt biểu hiện gen cấu trúc của vi rút (VP28) và số lượng bản sao bộ gen của vi rút (Hình 2D, E, 3G, H, 4D, E). Ngoài ra, so với nhóm được xử lý PBS, việc xử lý dsRNA Luc cũng làm giảm đáng kể biểu hiện mRNA của WSSV và số lượng bản sao bộ gen của WSSV (Hình 2D, E, 3G, H, 4D, E), có lẽ là do các phản ứng chống vi-rút không đặc hiệu được quy cho các dsRNA. Nói chung, những kết quả này đã chứng minh rằng quá trình glycolysis do WSSV gây ra được hỗ trợ bởi các enzym glycolysis đã hoạt hóa và các enzyme glycolysis này là các yếu tố quyết định cho sự sao chép thành công của vi rút. Những kết quả này phù hợp với quá trình tái lập trình trao đổi chất do vi-rút gây ra khác, trong đó quá trình glycolysis được kích hoạt để hỗ trợ sự nhân lên của vi-rút. Các enzyme glycolysis này có thể tạo ra các chất chuyển hóa cần thiết cho các con đường sinh tổng hợp khác, ví dụ như nucleotide và lipid, do đó tạo ra môi trường thuận lợi cho sự nhân lên của virus. Điều thú vị là ở giai đoạn cuối của virus, mặc dù biểu hiện gen của 4 enzyme glycolytic tăng lên ở tôm nhiễm WSSV nhưng hoạt tính của chúng lại giảm (Hình 2A, B, 3A–D, 4A, B). Có lẽ WSSV cản trở quá trình dịch mã của mRNA enzyme glycolytic ở giai đoạn này để tạo điều kiện thuận lợi cho việc chuyển đổi từ quá trình tổng hợp thành phần virus, tiêu tốn phân tử sinh học và năng lượng, sang quá trình hình thành virion. Ilkow và cộng sự (2008) đã báo cáo rằng protein capsid của vi rút rubella (RV) ức chế quá trình dịch mã protein bằng cách liên kết với protein liên kết poly (A) (PABP), một protein tế bào chủ giúp tăng cường hoạt động dịch mã bằng cách tuần hoàn hóa các mRNA. Sự ức chế dịch mã liên quan đến capsid này có thể cho phép chuyển từ dịch mã vi rút sang đóng gói RNA thành nucleocapsid.
Nhiễm WSSV không làm tăng hoạt tính của HK ở giai đoạn sao chép bộ gen của virus, mặc dù biểu hiện gen của nó đã tăng lên (Hình 2A, B). Kết quả này không phù hợp với các loại vi rút khác như vi rút sốt xuất huyết và EBV, có lẽ việc tăng hấp thu glucose không quá tải lượng của HK. Tuy nhiên, kết quả của việc vô hiệu hóa dsRNA đã nhấn mạnh vai trò quan trọng của HK trong quá trình glycolysis, vì nó xúc tác cho bước đầu tiên của quá trình trao đổi chất này. Mặc dù biểu hiện gen không thay đổi, các hoạt tính của LDH và PK đã tăng lên trong các tế bào máu bị nhiễm WSSV ở giai đoạn sao chép bộ gen của vi rút (Hình 3C, D, 4A, B). Hoạt tính của enzyme PK và LDH tăng cao có thể là do sự tương tác giữa protein của vi rút và enzyme glycolysis, thay vì quy định cổ điển về biểu hiện gen. Về vấn đề đó, sự tương tác giữa các enzyme của vật chủ và protein của vi rút được virut sử dụng để kiểm soát các quá trình trao đổi chất của vật chủ. Ví dụ, vi rút viêm gan C (HCV) và DENV sử dụng các tương tác như vậy để kiểm soát tốc độ trao đổi chất của quá trình glycolysis, một nguồn cacbon quan trọng để vi rút nhân lên. Trong các nghiên cứu khác, chúng tôi đang nghiên cứu Yeast-2 hybrid để xác định các protein virut cụ thể tương tác với các enzyme glycolysis này.
Truy tìm đồng vị ổn định đã được sử dụng để tiết lộ các kiểu chuyển hóa khác nhau do vi-rút gây ra. Ở giai đoạn sao chép bộ gen của WSSV, dấu vết đồng vị của glucose [U- 13C] trong các tế bào máu bị nhiễm WSSV chứng minh rằng quá trình glycolysis đã được kích hoạt. Hơn nữa, dòng glycolytic sau đó có thể đã bước vào chu trình TCA, vì citrate (Cit) và isocitrate (Ict) đều tăng 30 phút sau khi tiêm chất đánh dấu (Hình 5A, B). Nhiễm vi rút hợp bào hô hấp (RSV) gây ra dòng glycolysis lớn hơn được dành riêng cho con đường pentose phosphate và chu trình TCA. Số phận của quá trình glycolysis khác nhau khi nhiễm vi rút viêm gan B (HBV); trong trường hợp đó, glucose được kết hợp vào con đường pentose phosphate và sinh tổng hợp hexosamine hơn là chu trình TCA (42). Dựa trên quá trình theo dõi, lactate không tăng cùng thời điểm trong quá trình lây nhiễm WSSV (Hình 5A), điều này trái ngược với kết quả trước đó. Sử dụng đồng vị glutamine ổn định, He và cộng sự (2019) tiết lộ rằng glutamine góp phần sản xuất lactate thông qua quá trình chuyển hóa glutamine oxy hóa, cho thấy rằng lactate được tạo ra trong quá trình nhiễm WSSV có thể bắt nguồn từ glutamine. Tuy nhiên, không thể kết luận rằng quá trình glycolysis do WSSV gây ra chỉ góp phần vào chu trình TCA, vì sự khác biệt giữa các kết quả có thể được giải thích bằng cách loại bỏ tan máu (tương đương với huyết tương người) trong quá trình thí nghiệm hoặc sử dụng lactate như một nguồn nhiên liệu. Lactate, một chất thải trao đổi chất, phải được loại bỏ khỏi các tế bào nhân chuẩn để ngăn chặn quá trình axit hóa bất lợi trong tế bào chất và thúc đẩy quá trình glycolysis, do sự tích tụ của lactate trong tế bào chất điều hòa giảm các enzyme giới hạn tốc độ như HK và PFK. Trong một nghiên cứu trước đây, carbon từ lactate được tích hợp vào lipid thông qua chu trình TCA trong tế bào ung thư phổi và ung thư cổ tử cung ở người. Hơn nữa, lactate dehydrogenase B (LDHB) được định vị ở màng trong ty thể, điều này có thể tạo điều kiện thuận lợi cho quá trình chuyển đổi lactate thành pyruvate. Khi nhiễm WSSV, việc thiếu lactate ở 12 giờ có thể là do nhu cầu cao đối với chu trình TCA, nơi có thể dễ dàng sản xuất citrate và sau đó được sử dụng để tạo ra Acetyl-CoA cho quá trình tạo chất béo do WSSV gây ra. Liệu một số LDH của tôm có thể có trong ty thể hay không vẫn chưa được biết; tuy nhiên, dựa trên ví dụ từ các tế bào ung thư, lactate có thể được chuyển hóa trong các tế bào máu bị nhiễm WSSV, mặc dù cần nghiên cứu thêm để làm rõ điều này.
Citrate là một chất trung gian trong chu trình TCA và tăng cao ở mức 12 giờ và sau 30 phút sau khi tiêm chất đánh dấu (Hình 5B). Nó là một chất chuyển hóa có thể được vận chuyển ra khỏi ty thể, nơi nó được phân cắt bởi ATP citrate lyase để tạo ra acetyl-CoA tế bào, một chất chuyển hóa quan trọng cho sự nhân lên của vi rút vì nó có thể đóng vai trò là carbon quan trọng để tổng hợp lipid hoặc acetyl hóa protein của vi rút. Nghiên cứu trước đây của chúng tôi về quá trình phân giải glutaminolysis do WSSV gây ra cũng đã chứng minh sự đóng góp của glutamine vào chu trình TCA, gây ra sự tích tụ citrate ở 12 giờ. Là hai con đường đầu vào carbon chính, glycolysis và glutaminolysis có liên quan đến sự sao chép của nhiều loại vi rút khác nhau, bao gồm cả vi rút gây bệnh Marek, Herpevirus và HCV. Kết hợp lại với nhau, cả quá trình glycolysis và quá trình phân giải glutaminolysis đều tăng lên và có thể đã bước vào chu trình TCA ở giai đoạn sao chép bộ gen của WSSV.
Ở giai đoạn cuối của quá trình nhân lên của vi rút, mặc dù không có thay đổi đáng kể nào về các chất chuyển hóa trong 10 phút đầu tiên sau khi tiêm chất đánh dấu, nhưng các chất chuyển hóa khác nhau đã tăng lên sau 30 phút sau khi tiêm chất đánh dấu. Con đường glycolysis cần nhiều thời gian hơn để chuyển hóa chất đánh dấu, dẫn đến tốc độ glycolysis chậm (Hình 6). Quá trình glycolysis diễn ra tích cực hơn ở giai đoạn sao chép bộ gen của vi rút so với ở giai đoạn cuối của vi rút, mặc dù quá trình tạo chất béo, có thể cung cấp axit béo cho vỏ vi rút WSSV, được kích hoạt ở giai đoạn cuối của vi rút. Có lẽ các chất chuyển hóa cần thiết cho quá trình tạo chất béo được tạo ra sớm hơn. Cytomegalovirus ở người (HCMV) đã định tuyến lại quá trình glycolysis thành quá trình tổng hợp axit béo. Có lẽ WSSV sử dụng chiến lược tương tự như HCMV để cung cấp các chất chuyển hóa cho quá trình tạo chất béo. Các nghiên cứu trong tương lai là cần thiết để xác định xem Acetyl-CoA, chất nền ban đầu cho quá trình tạo chất béo, được tạo ra từ citrate bên ngoài ty thể ở thời điểm ban đầu, nhưng sau đó được sử dụng để tạo lipid ở giai đoạn cuối của vi rút.
Tóm lại, nghiên cứu này đã chứng minh quá trình glycolysis do WSSV gây ra thông qua việc điều chỉnh tăng cường các enzyme glycolysis của tôm. Khi đó, quá trình glycolysis tăng lên có thể góp phần vào quá trình tổng hợp nucleotide thông qua con đường pentose phosphate, và có thể cả chu trình TCA (Hình 5) và quá trình tạo chất béo bằng cách tăng tính sẵn có của Acetyl-CoA. Các chất trung gian trong quá trình glycolysis cũng có thể đóng vai trò là chất nền cho các con đường sinh tổng hợp khác để sao chép vi rút. Tuy nhiên, một số câu hỏi vẫn được trả lời. Ví dụ, các yếu tố hoặc thành phần làm trung gian giao tiếp giữa WSSV và con đường glycolysis vẫn chưa được làm sáng tỏ.
Theo Yen Siong Ng, Der-Yen Lee, Chun-Hung Liu, Cheng-Yi Tung, Shu-Ting He, Han-Ching Wang
Nguồn: https://www.frontiersin.org/articles/10.3389/fimmu.2022.901111/full
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Acinetobacter venetianus, Một Tác Nhân Tiềm Ẩn Gây Bệnh Đỏ Chân Ở Tôm Thẻ Chân Trắng Penaeus vannamei Nuôi Trong Môi Trường Nước Ngọt
- Các chủng Probiotic được sử dụng trong nuôi trồng thủy sản
- Việc Sử Dụng Kết Hợp Pediococcus Pentosaceus Và Fructooligosaccharide Cải Thiện Hiệu Suất Tăng Trưởng, Đáp Ứng Miễn Dịch Và Sức Đề Kháng Của Tôm Thẻ Chân Trắng Litopenaeus vannamei Chống Lại Vibrio parahaemolyticus

 English
English