Kỹ Thuật Nuôi, Tin tức
Ảnh Hưởng Của Stress Amoniac (NH3) Đối Với Tế Bào Máu Của Tôm Thẻ Chân Trắng Litopenaeus vannamei
Tóm tắt
Amoniac là một yếu tố căng thẳng chính trong môi trường nuôi trồng thủy sản. Stress amoniac lâu dài có thể ảnh hưởng đến sự tăng trưởng bình thường, và cũng làm tăng nguy cơ mắc các bệnh khác nhau. Để tìm hiểu cơ chế mà amoniac gây ra dịch bệnh ở tôm, các phương pháp tiếp cận phiên mã và chuyển hóa đã được sử dụng để phân tích các biểu hiện khác biệt của các gen trong tế bào máu và các chất chuyển hóa khác nhau trong huyết thanh của tôm thẻ chân trắng Litopenaeus vannamei khi phơi nhiễm với amoniac. Phân tích phiên mã cho thấy 17 gen liên quan đến quá trình chết rụng tế bào, 7 gen liên quan đến thực bào, 10 gen liên quan đến miễn dịch và 7 gen liên quan đến chu kỳ tế bào và chuyển hóa lipid cho thấy các biểu hiện khác biệt sau khi phơi nhiễm với amoniac. Phân tích chuyển hóa trên huyết thanh cho thấy 25 chất chuyển hóa phân biệt được xác định trong các mẫu ion dương và âm. Chúng tham gia vào quá trình chuyển hóa purine, chuyển hóa axit amin và lipid. Tiêm hai chất chuyển hóa được điều chỉnh tăng triethanolamine và oxypurinol cho tôm bình thường có thể gây ra quá trình chết rụng ở tôm bình thường. Phơi nhiễm với amoniac làm giảm đáng kể tổng số lượng tế bào máu và tăng đáng kể tỷ lệ tế bào apoptotic ở tôm. Những kết quả này cho thấy rằng việc phơi nhiễm với amoniac làm tăng quá trình chết rụng của tế bào máu, ảnh hưởng đến khả năng miễn dịch của tôm, từ đó làm tăng khả năng nhiễm mầm bệnh. Những dữ liệu này sẽ giúp chúng ta hiểu được cơ chế của stress amoniac dẫn đến suy giảm miễn dịch ở tôm.
1. Giới thiệu
Tôm thẻ chân trắng Litopenaeus vannamei là một loài tôm quan trọng trong nuôi trồng thủy sản. Đây là loài được nuôi rộng rãi nhất trên toàn thế giới do tốc độ tăng trưởng nhanh, khả năng kháng bệnh, và khả năng thích ứng với môi trường nuôi mật độ dày (Cuzon và cộng sự, 2004; Kim và cộng sự, 2014). Tuy nhiên, với việc mở rộng quy mô nuôi trồng thủy sản và đẩy mạnh chế độ nuôi mật độ siêu thâm canh, môi trường nuôi trồng thủy sản bắt đầu xấu đi, và dịch bệnh gia tăng, ảnh hưởng nghiêm trọng đến sản lượng và chất lượng của tôm thẻ chân trắng (Alagappan và cộng sự, 2010; Cuzon và cộng sự, 2004). Sự bùng phát dịch bệnh của tôm thường là kết quả của sự tương tác giữa các mầm bệnh, vật chủ và môi trường (Kautsky và cộng sự, 2000). Amoniac là yếu tố môi trường quan trọng trong hệ thống nuôi cấy thủy sản và là mối đe dọa lớn đối với sự sống của tôm (Cobo và cộng sự, 2014).
Trong môi trường nước, mưa và gió vận chuyển amoniac vào bể nuôi trồng thủy sản từ thức ăn dư thừa, phân của động vật, phân hủy chất rắn hữu cơ, amoniac dư thừa được tạo ra trong sản xuất nông nghiệp xung quanh (Kuhn và cộng sự, 2010). Amoniac thường có mặt ở các trạng thái ion hóa (NH4+) và không ion hóa (NH3) trong nước (Emerson và cộng sự, 1975; Fromm và Gillette, 1968), trong khi NH3 khuếch tán dễ dàng qua màng tế bào và vào hemolymph. Tỷ lệ NH4+ / NH3 có thể bị ảnh hưởng bởi pH, nhiệt độ và độ mặn (Chen và Chin, 1989; Kir và cộng sự, 2004; Lin và Chen, 2001). Các nghiên cứu cho thấy nồng độ amoniac cao có thể ức chế sự phát triển của tôm, tăng tần suất lột xác và dẫn đến tỷ lệ chết cao (Chen và Lin, 1992; Wickins, 1976). Ngoài ra, amoniac cũng có thể ảnh hưởng đến áp suất thẩm thấu, trạng thái sinh lý của mang và gan tụy (Lin và cộng sự, 1993; Lu và cộng sự, 2016). Nồng độ amoniac quá mức trong nước nuôi trồng thủy sản có thể ức chế hệ thống miễn dịch của tôm và tăng khả năng L. vannamei dễ bị nhiễm Vibrio hơn khi bị stress amoniac (Liu và Chen, 2004; Qiu và cộng sự, 2008). Do đó, việc hiểu một cách có hệ thống cơ chế phân tử của tôm thẻ L. vannamei đáp ứng với stress amoniac rất có giá trị. Trong nghiên cứu này, các chất chuyển hóa đã được sử dụng để nghiên cứu những thay đổi trong các chất chuyển hóa huyết thanh của tôm thẻ L. vannamei khi bị stress amoniac và bộ phiên mã được sử dụng để phân tích các đặc điểm biểu hiện gen của tế bào máu khi bị stress amoniac.
2. Vật liệu và phương pháp
2.1. Mẫu tôm
Tôm thẻ chân trắng L. vannamei khỏe mạnh nuôi trong bể cá của Viện Hải dương học, Viện Hàn lâm Khoa học Trung Quốc, Thanh Đảo, với trọng lượng trung bình 16,7g ± 5,8g, đã được sử dụng cho các thí nghiệm phơi nhiễm với amoniac. Trước khi thí nghiệm 3 ngày, tôm đã thích nghi ở 25 ± 1ºC với độ mặn 30‰ và pH 7,5 ± 0,1. Tất cả tôm được cho ăn 2 lần/ ngày vào lúc 8:00 sáng và 17:00 chiều với thức ăn viên thương mại (Công ty thức ăn chăn nuôi Dale, Yên Đài, Trung Quốc).
2.2. Phơi nhiễm với amoniac và thu thập mẫu
Dung dịch dự trữ amoniac-N (10 g/ L) được điều chế bằng cách hòa tan 38,19 g NH4Cl trong 1L nước cất (Liu và Chen, 2004). Nó được sử dụng để điều chỉnh nồng độ amoniac-N trong nước biển. Sau khi thích nghi, tôm được chia ngẫu nhiên thành 2 nhóm, nhóm phơi nhiễm với amoniac và nhóm đối chứng, mỗi nhóm có ba bể, 15 con trong mỗi bể với 50L nước biển. Nồng độ amoniac-N trong nhóm phơi nhiễm với amoniac được duy trì ở mức 20 mg/ L và nhóm đối chứng được nuôi trong cùng điều kiện mà không cần bổ sung amoniac. Trong quá trình thí nghiệm, nồng độ amoniac-N được đo và điều chỉnh sau mỗi 12 giờ bằng thuốc thử amoniac HACH (phương pháp axit salicylic, vận hành thủ công tham khảo) và dụng cụ quang kế cầm tay DR/ 850 (HACH, Hoa Kỳ). Nồng độ amoniac trong nước đã được điều chỉnh kịp thời để đảm bảo sự ổn định. Các điều kiện canh tác giống như mô tả ở trên. Sau 7 ngày thí nghiệm, 24 con đã được chọn ngẫu nhiên từ nhóm thử nghiệm và nhóm đối chứng tương ứng. Khoảng 400 mL hemolymph được thu thập từ mỗi con tôm tại xoang bụng nằm ở đoạn bụng đầu tiên với cùng một thể tích dung dịch thuốc chống đông máu (27 mM natri citrat, 336 mM NaCl, glucose 115 mM, 9 mM EDTA, pH 7) (Rodriguez và cộng sự, 1995). Hemolymph từ hai con được trộn thành một mẫu, và các tế bào máu và huyết thanh được tách ra bằng cách ly tâm ở 4ºC, 1000 g trong 5 phút. Toàn bộ 12 mẫu huyết thanh từ nhóm thí nghiệm hoặc nhóm đối chứng được bảo quản ở -80ºC để phân tích chất chuyển hóa. Các tế bào máu được bảo quản trong nitơ lỏng để phân tích phiên mã thêm. Ngoài ra, hemolymph của 5 con khác từ nhóm thí nghiệm và nhóm đối chứng đã được thu thập với cùng một phương pháp để đếm tổng số tế bào máu.
2.3. Phân tích bảng điểm
Các tế bào máu được thu thập từ 24 con trong mỗi nhóm được chỉ định ngẫu nhiên cho ba lần lặp lại. Các tế bào máu đã được thu thập để trích xuất RNA và phân tích giải trình tự phiên mã.
2.3.1. Phân lập RNA và giải trình tự illumina
Tổng RNA được chiết xuất từ các mẫu tế bào máu bằng thuốc thử RNAiso Plus (TaKaRa, Nhật Bản) theo hướng dẫn của nhà sản xuất. Chất lượng của tổng RNA được đánh giá bằng điện di trên gel agarose 1,0% và được định lượng bằng Máy đo quang phổ NanoDrop 2000 (Thermo Fisher Scientific Inc., Hoa Kỳ) để đảm bảo chất lượng cao của RNA. DNase I (Thermo scientific, Hoa Kỳ) đã được sử dụng để loại bỏ DNA bộ gen khỏi tổng số RNA.
Sau khi tổng số RNA được tách chiết, mRNA nhân chuẩn được làm giàu bằng các hạt Oligo (dT). Sau đó, mRNA đã làm giàu được phân mảnh thành các đoạn ngắn bằng cách sử dụng bộ đệm phân mảnh và phiên mã ngược thành cDNA với các mồi ngẫu nhiên. CDNA sợi thứ hai được tổng hợp thông qua việc thêm DNA polymerase I, RNase H, dNTP và bộ đệm. Sau đó, các mảnh cDNA được tinh chế bằng kit chiết xuất QiaQuick PCR, cuối cùng được sửa chữa, poly (A) được thêm vào và được gắn vào bộ điều hợp giải trình tự Illumina. Các sản phẩm liên kết có kích thước được lựa chọn bởi điện di gel agarose, khuếch đại PCR và giải trình tự bằng Illumina HiSeqTM 2000 bởi công ty công nghệ sinh học Gene Denovo (GENE DENOVO, Quảng Châu).
2.3.2. Phân tích tin sinh học
Trình tự bộ điều hợp, số lần đọc chất lượng thấp, RNA ribosome (rRNA) và các lần đọc trống đã bị xóa khỏi các lần đọc thô, và được chuyển thành các lần đọc sạch. Các lần đọc sạch chất lượng cao đã được ánh xạ tới bảng phiên mã tham chiếu bằng cách sử dụng công cụ căn chỉnh đọc ngắn Bowtie 2 (Li và cộng sự, 2009) và được chuyển đổi thành mảnh trên mỗi kilobase bảng phiên mã trên một triệu cặp cơ sở được sắp xếp (FPKM) (Mortazavi và cộng sự, 2008). Phân tích tương quan của 3 thí nghiệm song song cung cấp đánh giá độ tin cậy của kết quả thí nghiệm cũng như sự ổn định hoạt động. Phân tích thành phần chính (PCA) được thực hiện với các mô hình gói R (http://www.r-project.org/ ). Gói edgeR (http://www.rproject.org/ ) được sử dụng để xác định các gen biểu hiện khác nhau (DIG) trên 2 nhóm. Những gen có thay đổi 2 nếp gấp và tỷ lệ phát hiện sai (FDR) < 0,05 trong một so sánh được xác định là DEG quan trọng. Các DEG sau đó đã được phân tích làm giàu các chức năng của Bản thể học gen (GO) và các con đường dẫn tín hiệu của bộ bách khoa toàn thư về gen và bộ gen Kyoto (KEGG).
2.3.3. Phân tích định lượng real-time PCR của các gen được chọn từ bộ phiên mã
Để xác minh dữ liệu phiên mã, 6 DEG đã được chọn ngẫu nhiên để phân tích PCR định lượng thời gian thực. Gen housekeeping 18S rRNA được sử dụng làm tiêu chuẩn nội bộ (Sun và cộng sự, 2014). Thông tin về các mồi được sử dụng cho PCR thời gian thực đã được hiển thị trong Bảng 1. RNA được chiết xuất được sử dụng để tổng hợp cDNA bằng kit tổng hợp cDNA I PrimeScript™ với 6 mã phân tử ngẫu nhiên (TaKaRa, Nhật Bản). Phản ứng qPCR được thực hiện trong tổng thể tích 10 mL, chứa 5 mL SuperReal PreMix Plus (SYBR Green) (Tiangen, Trung Quốc), mồi trước 0,3 mM, mồi ngược 0,3 mM, mẫu cDNA 1 mL và nước không có RNase 3,4 mL. Chương trình được thiết lập như sau: 95ºC trong 15 phút; 40 chu kỳ 95ºC trong 15 giây, nhiệt độ ủ (thể hiện trong Bảng 1) trong 15 giây và 72ºC trong 20 giây, sử dụng Eppendorf Mastercycler® ep realplex (Eppendorf, Đức). Mức độ biểu hiện tương đối của gen đích được tính bằng phương pháp 2–rrCT (Livak và Schmittgen, 2001).
Bảng 1. Thông tin về mồi được sử dụng cho PCR thời gian thực.
2.4. Phân tích chuyển hóa
Huyết thanh của tôm từ nhóm thí nghiệm và đối chứng đã được sử dụng để phân tích chất chuyển hóa. Mỗi nhóm có 12 mẫu lặp lại. Các mẫu đông lạnh được rã đông ở 4ºC và 100 mL của mỗi mẫu được đồng nhất với 400 mL dung môi lạnh (methanol/ acetonitril 1/4 1:1, v/v), và đặt ở 20ºC trong 30 phút, sau đó ly tâm ở 14.000 g ở 4ºC trong 20 phút. Chất nổi trên bề mặt được chuyển đến một ống ly tâm mới, và sau đó được đông khô trong một bộ cô đặc chân không. Các mẫu khô được hòa tan và đồng nhất trong dung dịch nước acetonitril (acetonitril: nước 1/4 1: 1, v/ v) và ly tâm ở 14.000g ở 4ºC trong 15 phút. Chất nổi trên bề mặt được sử dụng để phân tích quang phổ khối lượng. Phân tích trao đổi chất được thực hiện tại công ty TNHH công nghệ protein thực nghiệm Thượng Hải (APTBIO, Trung Quốc).
2.4.1. Điều kiện sắc ký lỏng
Sắc ký lỏng hiệu suất cực cao (UHPLC) (Agilent, Hoa Kỳ) và cột sắc ký HILIC (ACQUITY UPLC BEH Amide 1,7 mm, cột 2,1 mm 100 mm, Waters, Hoa Kỳ) đã được sử dụng để phân tích sắc ký. Điều kiện làm việc cho cột được đặt như sau: nhiệt độ ở 25ºC, tốc độ dòng chảy ở 0,3 mL/ phút, thể tích phun ở 2 mL. Một pha di động (A) có chứa amoni axetat (25 mM) và amoniac nước (25 mM) trong nước; Pha di động B (B) là acetonitril. Chương trình giải nén gradient kéo dài 20 phút như sau: Sau khi bắt đầu trước với 85% di động giai đoạn B trong 1 phút, thay đổi tuyến tính giai đoạn B di động thành 65% từ 1 đến 12 phút, và sau đó lên 40% từ 12 đến 12,1 phút, ở mức 40% trong 3 phút và trở lại 85% từ 15 đến 15,1 phút, tiếp theo là giữ ở mức 85% cho đến 20 phút. Các mẫu được đặt trong bộ lấy mẫu tự động 4ºC trong toàn bộ quá trình. Cứ 5 mẫu kiểm tra chất lượng lại được thiết lập để đánh giá độ ổn định của hệ thống.
2.4.2. Điều kiện khối phổ kế
Sau khi các mẫu được tách ra bằng UHPLC, phép đo phổ khối lượng được thực hiện với máy quang phổ khối lượng Triple TOF 6600 (AB SCIEX, HOA KỲ). Phép đo phổ khối lượng ion hóa phun điện tử (ESI) (MS) được sử dụng để phát hiện ở cả chế độ ion dương và âm. Các điều kiện nguồn ESI như sau: Ion Source Gas1 (Gas1): 60 psi, Ion Source Gas2 (Gas2): 60 psi, Curtain gas (CUR): 30 psi, nhiệt độ nguồn: 600ºC, IonSapary Voltage Floating (ISVF) ± 5500V (Chế độ dương và âm); TOF MS quét m/ z phạm vi: 60-1000 Da, quét ion sản phẩm m/ z phạm vi: 25-1000 Da, thời gian tích lũy quét TOF MS 0,20 s/ quang phổ, thời gian tích lũy quét ion sản phẩm 0,05s/ quang phổ; Phổ khối lượng thứ cấp thu được bằng cách sử dụng thu nhận phụ thuộc thông tin (IDA) và với chế độ nhạy cao, Tiềm năng khử nhiễu (DP): ±60V (Chế độ dương và âm), Năng lượng va chạm: 35 ± 15 eV, cài đặt IDA như sau: Loại trừ các đồng vị trong 4 Da: 6 ion ứng cử viên để theo dõi mỗi chu kỳ.
2.4.3. Phân tích thống kê
Dữ liệu gốc đã được ProteoWizard chuyển đổi sang định dạng “.mzML”. Phần mềm XCMS được sử dụng để khớp đỉnh, căn chỉnh thời gian duy trì và khu vực đỉnh. Nhận dạng chất chuyển hóa được thực hiện bằng cách tìm kiếm cơ sở dữ liệu của công ty (APTBIO, Trung Quốc) trong kết quả trùng khớp khối lượng chính xác (50% trong nhóm đã bị xóa khỏi dữ liệu thu được từ XCMS. Phần mềm ứng dụng SIMCA-P 14.1 (Umetrics, Umea, Thụy Điển) được sử dụng để nhận dạng mẫu, dữ liệu được xử lý trước bằng chia tỷ lệ pareto và phân tích thống kê đa chiều, và phân tích thành phần chính không giám sát (PCA) đã được thực hiện.
2.4.5. Phân tích tin sinh học
Để đánh giá tính hợp lý của các chất chuyển hóa ứng cử viên, mối quan hệ giữa các mẫu và các mẫu biểu hiện của các chất chuyển hóa trong các mẫu khác nhau đã được hiển thị toàn diện và trực quan hơn. Sự khác biệt đáng kể về chất của biểu thức chất chuyển hóa đã được sử dụng để phân tích cụm phân cấp trên từng nhóm mẫu. Các chất chuyển hóa vi phân đã được gửi đến cơ sở dữ liệu KEGG (http://www.kegg.jp/kegg/pathway.html ) để phân tích con đường làm giàu.
2.5. Tổng số tế bào máu ở tôm
Hemolymph của năm con từ nhóm thí nghiệm và nhóm đối chứng được thu thập bằng phương pháp tương tự như được mô tả trước đây trong phần 2.2. Tổng số tế bào máu được tái sử dụng và pha loãng 10 lần trong hỗn hợp thể tích bằng nhau của môi trường L15 và thuốc chống đông máu. Tổng số lượng tế bào máu tính bằng đơn vị thể tích (mL) được phân tích bằng BD FACSAria II Flow Cytometer (Bection Dickinson, Hoa Kỳ). Đối với mỗi mẫu, 10.000 tế bào đã được tính. Nồng độ tế bào máu được tính theo tốc độ dòng chảy và thời gian ghi lại.
2.6. Xét nghiệm apoptosis cho các tế bào máu
Các tế bào máu apoptotic đã được nghiên cứu bằng bộ dụng cụ phát hiện quá trình apoptosis Annexin V-FITC/ PI (công nghệ sinh học Jiancheng Nam Kinh, Trung Quốc). 10 con từ mỗi nhóm được lấy mẫu ngẫu nhiên lần lượt vào 0, 1, 3, 5 và 7 ngày sau khi phơi nhiễm với amoniac. Hemolymph được thu thập từ xoang bụng nằm ở đoạn bụng đầu tiên với thể tích bằng nhau của dung dịch Alsever biến đổi thuốc chống đông máu. Tế bào máu được phân lập bằng cách ly tâm ở 4ºC, 1000 g trong 10 phút. Tế bào máu dạng viên được rửa bằng dung dịch chống đông máu 2 lần và được tái sử dụng ở khoảng 1 106 tế bào/ mL trong 500 mL đệm liên kết, và sau đó 5 mL Annexin V-FITC và 5 mL dung dịch làm việc PI đã được thêm vào. Huyền phù tế bào được trộn và ủ trong 10 phút ở nhiệt độ phòng trong bóng tối và ngay lập tức được phân tích bởi hệ thống tế bào học dòng chảy BD FACSAria II (Bection Dickinson, Hoa Kỳ). Đối với mỗi mẫu, 10.000 tế bào đã được tính. Các tế bào nhuộm màu âm tính với cả hai đầu dò đại diện cho các tế bào sống. Các tế bào nhuộm màu dương tính với Annexin V-FITC và âm tính với PI là các tế bào apoptotic sớm. Các tế bào nhuộm màu dương tính với cả Annexin V-FITC và PI đang ở giai đoạn cuối của quá trình apoptosis, trải qua hoại tử hoặc đã chết. Tỷ lệ tế bào apoptotic (AR) được định nghĩa là tỷ lệ phần trăm của tế bào máu apoptotic (Guo và cộng sự, 2013).
2.7. Tác dụng của các chất chuyển hóa phân biệt đối với quá trình apoptosis của tế bào máu
Bốn chất chuyển hóa cho thấy sự điều hòa đáng kể trong huyết thanh của tôm khi phơi nhiễm với amoniac, bao gồm L-proline (Sigma, Hoa Kỳ), 1, 2-Di- (9Z-octadecenoyl)-sn-glycero-3- phosphocholine (Sigma, Hoa Kỳ), triethanolamine (Thượng Hải Hushi, Trung Quốc), oxypurinol (Sigma, Hoa Kỳ) đã được chọn để phân tích chức năng. Tôm có trọng lượng trung bình 13,9 ± 2,1g đã được sử dụng để xử lý chất chuyển hóa. Mỗi nghiệm thức trao đổi chất chứa 10 con và bốn nghiệm thức trao đổi chất đã được thiết lập. Mỗi con tôm được tiêm một chất chuyển hóa hòa tan trong PBS với liều 100 mg/ g tôm. Tôm trong nhóm đối chứng được tiêm cùng một lượng PBS vô trùng. Tất cả tôm được cho ăn và nuôi trong nước biển để quản lý định kỳ. Sau 4 giờ tiêm, tế bào máu của năm cá thể được thu thập từ mỗi nghiệm thức trao đổi chất và nhóm đối chứng xét nghiệm apoptosis với cùng một phương pháp như được mô tả trong phần 2.7.
2.8. Phát hiện vi khuẩn đang bám trong hemolymph của tôm và nước biển ao nuôi
Hemolymph của năm con được thu thập từ nhóm thí nghiệm và nhóm đối chứng theo quy trình được mô tả trong phần 2.2 và được sử dụng để phát hiện vi khuẩn in vivo. Mỗi mẫu được pha loãng trong PBS vô trùng với tỷ lệ 1: 9 (v/v). Pha loãng thập phân nối tiếp đã được chuẩn bị từ 10-1 đến 10-4 . Tổng cộng 100 mL mỗi lần pha loãng được gieo vào muối mật thiosulfate citrate môi trường thạch sucrose (TCBS) và môi trường thạch đậu nành tryptic (với 2,0% natri clorua, TSA), và sau đó chúng được ủ ở 30ºC trong 18 giờ. Đồng thời, các mẫu 1 mL nước biển của mỗi ao được thu thập từ các ao chứa nhóm thí nghiệm và nhóm đối chứng, và được xử lý như mô tả ở trên để đếm vi khuẩn. Các khuẩn lạc trên tấm TCBS và TSA được tính riêng để phân tích thống kê.
3. Kết quả
3.1. Phân tích phiên mã trên tế bào máu của tôm khi phơi nhiễm với amoniac
3.1.1. Đọc chú thích lắp ráp và trình tự
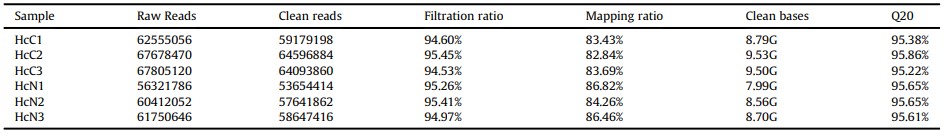
Tổng quan về thông tin trình tự của bảng phiên mã đã được liệt kê trong Bảng 2. Tổng cộng 53,654,414 đến 64,596,884 lần đọc sạch đã thu được cho mỗi mẫu, 82.84%-86.82% được so sánh so với bộ gen tham chiếu. Tất cả các lần đọc sạch được lắp ráp thành 61.283 unigenes, tỷ lệ GC là 40,92%, N50 là 1308 bp và chiều dài trung bình là 766 bp. Tất cả các unigenes đã được tìm kiếm dựa trên bốn cơ sở dữ liệu BLASTX. Tổng cộng 12,426 unigenes đã được nối với các protein đã biết trong cơ sở dữ liệu NR, 9,715 unigenes được nối với các tương đồng giả định trong cơ sở dữ liệu Swiss-Proton, 8,850 unigenes được chú thích trong cơ sở dữ liệu KOG và 6,935 unigenes được chú thích trong cơ sở dữ liệu KRA.
Bảng 2. Tổng quan về trình tự và lắp ráp bộ phiên mã tôm từ tôm thẻ chân trắng
3.1.2. Các gen biểu hiện khác biệt trong tế bào máu khi phơi nhiễm với amoniac
Tổng cộng có 516 gen biểu hiện khác biệt (DEGs) cho thấy các biểu hiện khác biệt trong tế bào máu của tôm khi phơi nhiễm với amoniac, bao gồm 145 DEG được điều chỉnh tăng và 371 DEG được điều chỉnh giảm (Bảng S1). Thông qua chú thích NR cho DEGs, chúng tôi nhận thấy rằng nhiều người trong số họ có liên quan đến quá trình apoptosis, thực bào, miễn dịch và chu kỳ tế bào và gen chuyển hóa lipid (Bảng 3). Trong số đó, 17 DEG liên quan đến quá trình chết rụng tế bào cho thấy các biểu hiện khác biệt sau khi phơi nhiễm với amoniac, bao gồm 12 gen liên quan đến ức chế quá trình chết rụng và 11 trong số đó có quy định thấp, 5 gen liên quan đến hoạt hóa quá trình chết rụng và ba trong số được điều chỉnh tăng, điều này chỉ ra rằng quá trình chết rụng tế bào máu có thể được kích hoạt ở tôm sau khi phơi nhiễm với amoniac. 7 DEG liên quan đến thực bào cho thấy sự điều hòa đáng kể trong tế bào máu của tôm khi phơi nhiễm với amoniac. 6 trong số 10 DEG liên quan đến khả năng miễn dịch cho thấy biểu hiện được điều chỉnh theo quy định và 4 DEG còn lại cho thấy biểu hiện giảm quy định trong nhóm phơi nhiễm với amoniac. 3 gen được điều chỉnh xuống đã tham gia vào con đường PI3K. 7 DEG liên quan đến chu kỳ tế bào và chuyển hóa lipid, chẳng hạn như tổng hợp axit béo, tổng hợp phospholipid và các quá trình khác liên quan đến tổng hợp thành phần tế bào, tất cả đều được kiểm soát trong nhóm phơi nhiễm với amoniac
Bảng 3. Các DEG chính liên quan đến quá trình apoptosis, miễn dịch, thực bào và chu kỳ tế bào và chuyển hóa lipid.



3.1.3. Xác minh dữ liệu bảng phiên mã bằng thử nghiệm qPCR
Sáu gen bao gồm 3 gen điều hòa xuống (XIAP, chất ức chế liên kết X của protein apoptosis; IAP, chất ức chế protein apoptosis; UBQ2, polyubiquitin 2) và 3 gen được điều chỉnh lên (MKNK, lập bản đồ serine/ threonine tương tác kinase; CPPED1, giống serine/ threonineprotein phosphatase CPPED1; C/ EBP, protein liên kết CCAAT/ chất tăng cường) đã được chọn để xác nhận các mẫu biểu hiện bằng thử nghiệm qPCR. Kết quả cho thấy hồ sơ biểu hiện của các gen này cho thấy xu hướng tương tự với các gen trong phân tích bảng phiên mã (Hình 1).
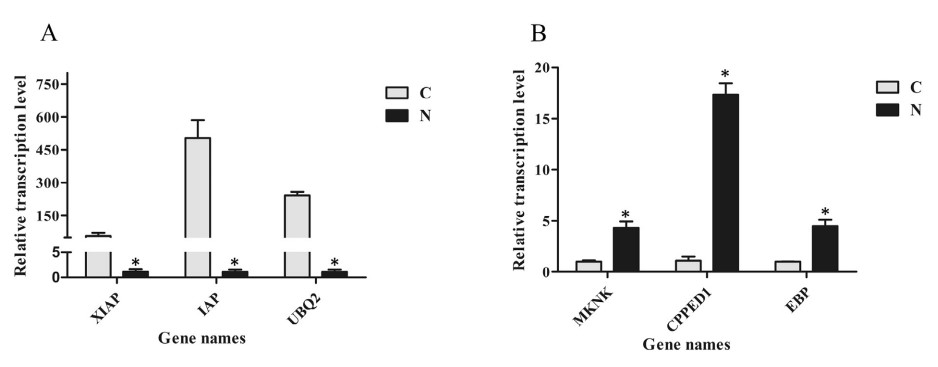
Hình 1. Định lượng kết quả phân tích PCR thời gian thực của 6 gen. XIAP, E3 ubiquitin-protein ligase XIAP; IAP, chất ức chế protein apoptosis; UBQ2, polyubiquitin 2; MKNK, bản đồ kinaseinteracting serine/threonine; CPPED1, serine/ threonine-protein phosphatase CPPED1 giống như; C/EBP, CCAAT/protein liên kết với chất tăng cường. C, nhóm đối chứng; N, nhóm tiếp xúc với amoniac. Các thanh dọc đại diện cho giá trị trung bình ± S.E. (n 1/4 3). Các ngôi sao (*) cho thấy sự khác biệt đáng kể về mức độ biểu hiện gen giữa nhóm căng thẳng amoniac và nhóm đối chứng ở P < 0,05.
3.2. Phân tích chất chuyển hóa của huyết thanh
3.2.1. Phân tích kiểm soát chất lượng
Độ ổn định của hệ thống được phân tích và đánh giá bằng cách kiểm soát chất lượng (QC) so sánh mẫu quang phổ và phân tích thành phần chính. Kết quả của quang phổ chồng chéo cho thấy cường độ phản ứng và thời gian lưu giữ của tất cả các đỉnh quang phổ về cơ bản là chồng chéo lên nhau, cho thấy rằng sự thay đổi gây ra bởi các lỗi thiết bị trong toàn bộ thí nghiệm là tương đối nhỏ (Hình S1). Tổng phân tích thành phần chính của mẫu cho thấy các mẫu QC được nhóm lại với nhau ở chế độ ion dương và âm, cho thấy khả năng lặp lại thử nghiệm là tốt (Hình. S2).
3.2.2. Các chất chuyển hóa phân biệt
Tổng cộng có 25 chất chuyển hóa vi phân đã được xác định ở chế độ ion dương và âm (Bảng 4). Ở chế độ ion dương, 22 chất chuyển hóa vi phân đã được xác định và 7 chất chuyển hóa vi phân được xác định ở chế độ ion âm, trong khi 4 chất chuyển hóa được xác định ở cả hai chế độ (Hình 2). Phân tích làm giàu KEGG cho thấy các chất chuyển hóa khác biệt chủ yếu được làm giàu trong các con đường chuyển hóa purin, sinh tổng hợp các chất chuyển hóa thứ cấp, chất vận chuyển ABC và chuyển hóa axit amin (Hình 3). Các chất chuyển hóa vi phân được phân thành bốn loại theo tính chất của chúng. Mười axit amin bao gồm Pro-Gly, LPhenylalanine, L-Glutamine, L-Anserine, D-Pyroglutamic acid, DProline, taurine, axit 3-Hydroxyanthranilic, creatinine và L-Proline cho thấy nội dung khác biệt khi phơi nhiễm với amoniac, trong khi hầu hết cho thấy hàm lượng ít hơn trong nhóm phơi nhiễm với amoniac, ngoại trừ L-Proline. 8 thành phần nucleotide liên quan đến chuyển hóa nucleotide cho thấy sự khác biệt sau khi phơi nhiễm với amoniac, bao gồm uracil, inosine, xanthine và oxypurinol với up-regulation, trong khi bốn thành phần khác bao gồm hypoxanthine, guanosine, guanine và deoxyinosine cho thấy sự điều hòa. 4 chất chuyển hóa lipid bao gồm acetylcarnitine, 1,2- Di-(9Z-octadecenoyl)-sn-glycero-3-phosphocholine, glycerophosphocholine và PC (16:0/ 16:0) (1-16: 0-2-16: 0-Phosphatidylcholine) cho thấy biểu hiện khác biệt. Hai chất chuyển hóa đầu tiên được điều chỉnh lên và hai chất chuyển hóa sau được điều chỉnh xuống trong nhóm phơi nhiễm với amoniac. Axit citric tham gia vào chu trình TCA cho thấy sự điều tiết rõ ràng dưới áp lực amoniac.
Bảng 4. Các chất chuyển hóa vi sai nhóm căng thẳng amoniac và nhóm đối chứng với chế độ ion dương hoặc âm
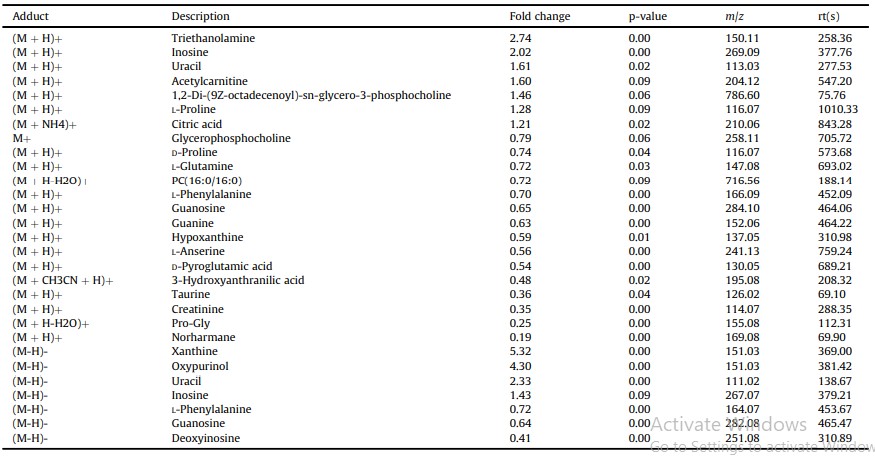
Hình 2. Phân cụm phân cấp của tất cả các chất chuyển hóa vi sai sau khi tiếp xúc với amoniac; Sự phân cụm cho thấy các kiểu biểu hiện tương tự giữa các mẫu của nhóm đối chứng (C) và nhóm tiếp xúc với amoniac (N) (trục x) và trong số các chất chuyển hóa vi phân (trục y). Màu sắc đại diện cho các mức biểu hiện chất chuyển hóa từ xanh lam (thấp) đến đỏ (cao). A, chế độ ion dương; B, chế độ ion âm. (Để giải thích các tham chiếu đến màu sắc trong chú thích hình này, người đọc được tham khảo phiên bản Web của bài viết này.)
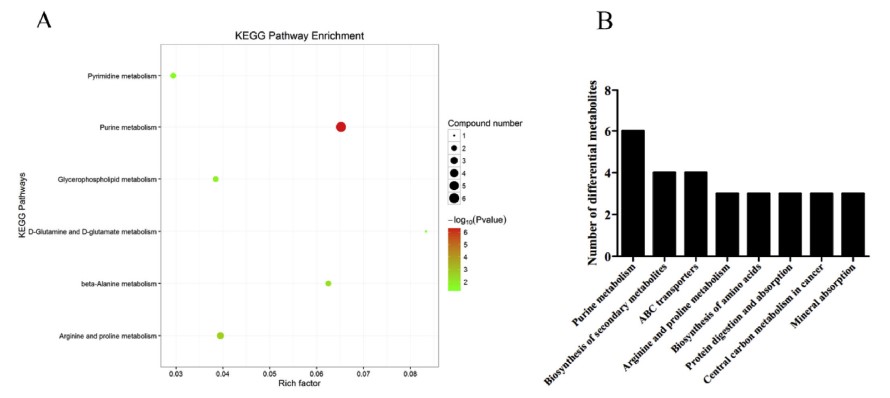
Hình 3. Kết quả làm giàu con đường KEGG của các chất chuyển hóa khác biệt giữa nhóm ứng suất amoniac và nhóm đối chứng. A đã cho thấy thông tin về kết quả làm giàu con đường KEGG của các chất chuyển hóa vi phân và giá trị P. B cho thấy số lượng các chất chuyển hóa khác biệt trong mỗi con đường trao đổi chất.
3.3. Ảnh hưởng của việc phơi nhiễm với amoniac đối với tế bào máu của tôm
Tổng số lượng tế bào máu (THC) ở tôm stress amoniac trong bảy ngày thấp hơn đáng kể so với ở tôm thuộc nhóm đối chứng (Hình 4). THC trong nhóm thử nghiệm giảm 56,04% so với nhóm đối chứng. Để hiểu thêm về ảnh hưởng của việc phơi nhiễm với amoniac đối với quá trình chết rụng tế bào máu trong các thời gian khác nhau, tỷ lệ tế bào máu apoptotic được phát hiện ở 0, 1, 3, 5 và 7 ngày khi phơi nhiễm với amoniac và dữ liệu được thể hiện trong Hình 5. Các tế bào máu apoptotic cũng được kiểm tra bằng kính hiển vi (Hình S3). Trong 5 ngày đầu tiên, tỷ lệ tế bào apoptotic tăng dần với việc kéo dài thời gian phơi nhiễm với N amoniac và nó đạt mức tối đa với giá trị 12,44% vào ngày thứ 5. Tuy nhiên, giá trị này đã giảm xuống còn 7,30% vào ngày thứ 7 (Hình 5).
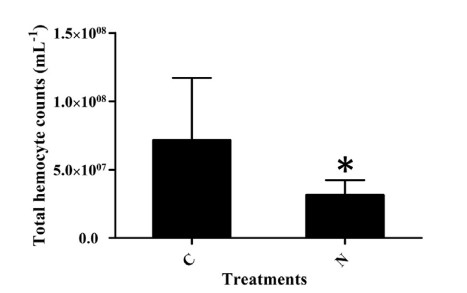
Hình 4. Phát hiện trên tổng số lượng tế bào máu của tôm từ nhóm tiếp xúc với amoniac và nhóm đối chứng. C, nhóm đối chứng; N, nhóm tiếp xúc với amoniac. Các thanh dọc đại diện cho giá trị trung bình ± S.E. (n 1/4 5). Các dấu sao (*) cho thấy sự khác biệt đáng kể đối với mức độ biểu hiện gen giữa nhóm căng thẳng amoniac và nhóm đối chứng ở P < 0,05.
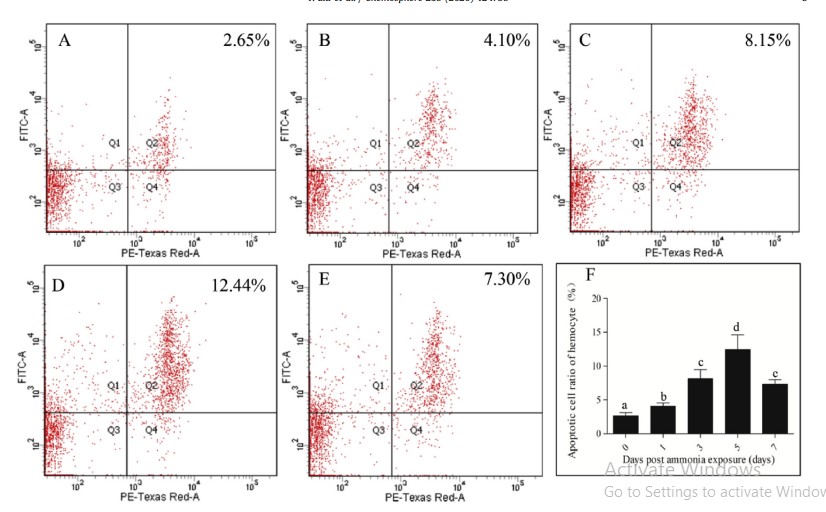
Hình 5. Phát hiện tỷ lệ tế bào apoptotic của hemocytes của tôm vào lúc 0, 1, 3, 5 và 7 ngày sau khi tiếp xúc với amoniac bằng phương pháp tế bào học dòng chảy. Apoptosis được phát hiện bởi bộ dụng cụ apoptosis Annexin V-FITC/ PI và phân tích tế bào học dòng chảy. Từ A đến E cho thấy kết quả xét nghiệm 0-7 ngày; Trục X hiển thị tín hiệu huỳnh quang PI, trục Y hiển thị tín hiệu huỳnh quang FITC; Q1, tế bào apoptotic sớm (Annexin V-FITC+/PI–); Q2, tế bào apoptotic muộn (Annexin V-FITC+/PI+); Q3, tế bào không apoptotic (Annexin V-FITC–/ FIT–); Q4, tế bào hoại tử (Annexin V-FITC– / PI+). F cho thấy kết quả phân tích thống kê. Các thanh dọc đại diện cho giá trị trung bình ± S.E. (n 1/4 10). Các chữ cái, ”a”, ”b ”, ”c ”, và ”d ” đại diện cho sự khác biệt đáng kể của tỷ lệ tế bào apoptotic trong các nhóm khác nhau ở P < 0,05.
3.4. Tác dụng của các chất chuyển hóa khác nhau đối với quá trình apoptosis của tế bào máu tôm
Để nghiên cứu mối quan hệ giữa các chất chuyển hóa phân biệt huyết thanh và quá trình chết rụng của tế bào máu, bốn chất chuyển hóa phân biệt được điều chỉnh tăng bao gồm L-proline, 1, 2-Di-(9Z-octadecenoyl)-sn-glycero-3-phosphocholine, triethanolamine, oxypurinol đã được chọn để tiêm tôm và tỷ lệ tế bào apoptotic của tế bào máu đã được phát hiện. Tỷ lệ tế bào apoptotic của hemocytes trong triethanolamine hoặc oxypurinol tiêm tôm cao hơn đáng kể so với nhóm đối chứng, trong khi không có sự khác biệt đáng kể giữa tôm tiêm L-proline hoặc 1, 2-Di-(9Z-octadecenoyl)-snglycero-3-phosphocholine và tôm từ nhóm đối chứng (Hình 6). Kết quả cho thấy một số chất chuyển hóa khác biệt trong huyết thanh có thể là một trong những nguyên nhân gây ra quá trình chết rụng tế bào máu.
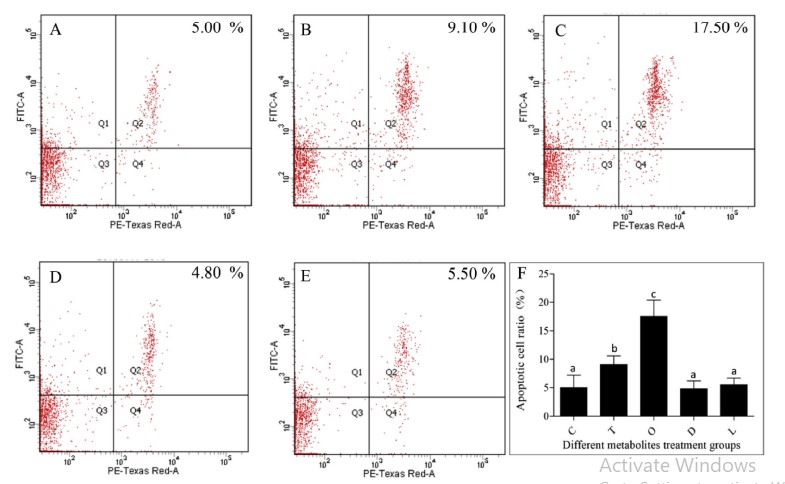
Hình 6. Tác dụng của việc tiêm các chất chuyển hóa khác nhau đối với quá trình apoptosis của tế bào máu ở tôm. Apoptosis được phát hiện bởi bộ dụng cụ apoptosis Annexin V-FITC/ PI và phân tích tế bào học dòng chảy. A cho thấy kết quả thử nghiệm của nhóm đối chứng. B cho thấy kết quả thử nghiệm được điều trị bằng triethanolamine. C cho thấy kết quả thử nghiệm được điều trị bằng oxypurinol. D cho thấy kết quả thử nghiệm được điều trị bằng 1, 2-Di- (9Z-octadecenoyl) -sn-glycero-3-phosphocholine. E cho thấy kết quả thử nghiệm được điều trị bằng L-proline. F cho thấy kết quả phân tích thống kê; L, L-proline; D, 1, 2-Di- (9Z-octadecenoyl) -sn-glycero-3-phosphocholine; T, triethanolamine; O, oxypurinol. Các thanh dọc đại diện cho giá trị trung bình ± S.E. (n 1/4 5). Các chữ cái, ”a”, ”b” và ”c” đại diện cho sự khác biệt đáng kể của tỷ lệ tế bào apoptotic trong các nhóm khác nhau ở P < 0,05.
3.5. Tải trọng vi khuẩn trong quá trình tan máu của tôm và nước biển ao nuôi dưới áp lực amoniac
Để biết liệu việc phơi nhiễm với amoniac có ảnh hưởng đến tải lượng vi khuẩn trong tôm và nước ao hay không, tải lượng vi khuẩn trong tôm và nước ao đã được phát hiện bằng cách nuôi vi khuẩn trên TCBS hoặc TSA. Tổng số TCBS trong nước biển từ ao cho nhóm thí nghiệm là khoảng 1,98 104 CFU/ mL, trong khi đó trong nhóm đối chứng là khoảng 2,33 103 CFU/ mL. Tổng số TSA trong nước biển từ ao của nhóm thí nghiệm là khoảng 3,15 104 CFU/ mL, trong khi đó trong nhóm đối chứng là 1,04 104 CFU/ mL. Tổng số TSA trong hemolymph của tôm thử nghiệm là 1,75 102 CFU/ mL, nhưng không có khuẩn lạc nào được TSA phát hiện trong quá trình tan máu của tôm từ nhóm đối chứng. Không có khuẩn lạc nào được phát hiện cả trong quá trình tan máu của tôm từ nhóm thí nghiệm và nhóm đối chứng TCBS (Hình 7).
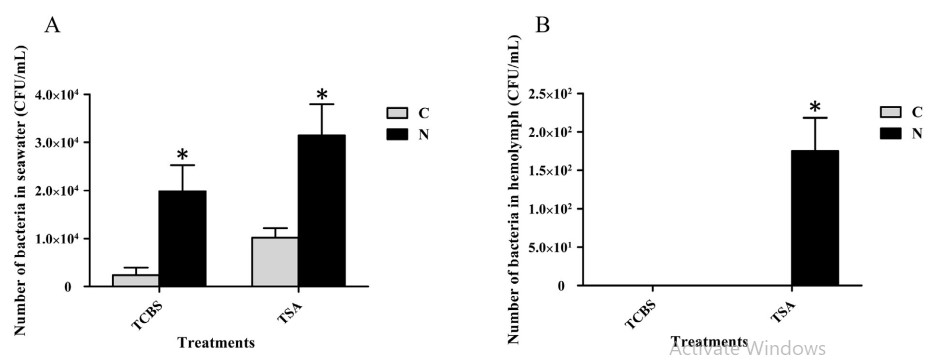
Hình 7. Phát hiện vi khuẩn trong nước biển nuôi và hemolymph của tôm. A cho thấy kết quả thử nghiệm bằng muối mật thiosulfate citrate môi trường thạch sucrose (TCBS), các thanh dọc đại diện cho giá trị trung bình ± S.E. (n 1/4 5). B cho thấy kết quả thử nghiệm bằng môi trường thạch đậu nành tryptic (với 2,0% natri clorua, TSA), các thanh dọc đại diện cho giá trị trung bình ± S.E. (n 1/4 3). C, nhóm đối chứng; N, nhóm tiếp xúc với amoniac. Các dấu sao (*) cho thấy sự khác biệt đáng kể đối với mức độ biểu hiện gen giữa nhóm căng thẳng amoniac và nhóm đối chứng ở P < 0,05.
4. Thảo luận
Amoniac là một yếu tố căng thẳng môi trường quan trọng trong nuôi trồng thủy sản. Tế bào máu là tế bào miễn dịch quan trọng nhất trong động vật giáp xác (Vazquez và cộng sự, 2009). Chúng đóng vai trò quan trọng trong các phản ứng miễn dịch như thực bào, đông máu, bao bọc, hình thành nốt sần, tạo melanine, sản xuất peptide kháng khuẩn (AMP), v.v., để chống lại sự xâm nhập của mầm bệnh (Söderhäll, 2016; Tassanakajon và cộng sự, 2013). Nó đã được báo cáo rằng tổng số lượng tế bào máu có thể được giảm ở một số loài giáp xác dưới áp lực stress amoniac (Hong và cộng sự, 2007; Giang và cộng sự, 2004; Pinto và cộng sự, 2016; Rodríguez-Ramos và cộng sự, 2008; Verghese và cộng sự, 2007). Tuy nhiên, cơ chế mà amoniac gây ra sự suy giảm của tế bào máu vẫn chưa được biết rõ. Kết quả của nghiên cứu này cung cấp dữ liệu quan trọng để làm sáng tỏ cơ chế ảnh hưởng của amoniac đến sức khỏe của tôm.
Phân tích bảng phiên mã trên tế bào máu của tôm cho thấy việc phơi nhiễm với amoniac làm giảm sự điều hòa của các gen liên quan đến ức chế quá trình chết rụng tế bào và tăng cường điều hòa các gen liên quan đến hoạt động quá trình chết rụng tế bào, điều này cho thấy rằng phơi nhiễm với amoniac làm tăng quá trình chết rụng tế bào máu. IAP, E3 ubiquitin-protein ligase XIAP và Baculoviral IAP lặp lại protein 2 (Birc2) cho thấy biểu hiện rõ ràng bị điều hòa xuống trong tế bào máu của tôm khi phơi nhiễm với amoniac. IEP, có chứa một khu vực được bảo tồn của miền lặp lại baculovirus IAP (BIR), là chất ức chế nội sinh cho quá trình apoptosis (Nagano và cộng sự, 2012; Salvesen và Duckett, 2002; Vaux và Silke, 2005). XIAP là một loại IAP, có thể liên kết trực tiếp với caspase-3, caspase-7 và caspase-9 để làm suy giảm chúng và do đó ức chế hoạt động của caspases (Morizane và cộng sự, 2005; Suzuki và cộng sự, 2001; Yang và cộng sự, 2000). Birc2 là một thành viên của họ gen chống apoptotic. Biểu hiện của Birc2 có thể được gây ra bởi stress mạng lưới nội chất để đóng một vai trò quan trọng trong việc thích ứng với stress tế bào (Hamanaka và cộng sự, 2009; Warnakulasuriyarachchi và cộng sự, 2004). Việc giảm quy định IAP, XIAP, Birc2 dưới amoniac có thể dẫn đến tăng quá trình apoptosis. Stress amoniac gây ra sự điều hòa MKNK và C/EBP trong tế bào máu của tôm. MKNK đã được báo cáo để giảm kích hoạt eIF4E (Lim và cộng sự, 2013), và các peptide liên kết với eIF4E có thể gây ra quá trình apoptosis nhanh chóng (Herbert và cộng sự, 2000). C/EBP là cần thiết cho quá trình apoptosis do Fas gây ra ở gan (Greenbaum và cộng sự, 2000). Do đó, biểu hiện được điều chỉnh của MKNK và C/ EBP cũng sẽ tạo điều kiện thuận lợi cho quá trình apoptosis. Việc phát hiện tỷ lệ tế bào máu apoptotic từ tôm khi phơi nhiễm với amoniac hỗ trợ thêm cho đề xuất rằng stress amoniac gây ra quá trình chết rụng tế bào máu và dẫn đến giảm tổng số lượng tế bào máu (THC). Hệ thống miễn dịch của tôm sẽ bị suy yếu nghiêm trọng.
Ngoài ra, chúng tôi cũng phát hiện ra rằng 7 DEG liên quan đến quá trình thực bào cho thấy các biểu hiện được điều chỉnh ở tôm từ nhóm phơi nhiễm với amoniac, điều này có thể tăng cường thực bào của tế bào máu. Thực bào là một phương pháp trung tâm và quan trọng để loại bỏ vi sinh vật hoặc các chất lạ (Bachere và cộng sự, 1995). Kiểm tra thêm số lượng vi khuẩn trong nước biển từ ao của nhóm phơi nhiễm với amoniac và trong quá trình tan máu của tôm phơi nhiễm với amoniac, chúng tôi nhận thấy rằng số lượng vi khuẩn trong cả nước biển và hemolymph của tôm cao hơn đáng kể so với nhóm đối chứng. Dữ liệu này có thể giải thích tại sao các DEG liên quan đến thực bào trong bộ phiên mã cho thấy các biểu hiện được điều chỉnh ở tôm khi phơi nhiễm với amoniac. Ngoài ra, 7 gen liên quan đến tổng hợp axit béo, tổng hợp phospholipid và các quá trình khác liên quan đến chu kỳ tế bào và gen chuyển hóa lipid cho thấy sự điều hòa ở tôm từ nhóm phơi nhiễm với amoniac. Sự điều hòa của các gen này có thể hữu ích cho quá trình nhân đôi mầm bệnh ở tôm. Nghiên cứu trước đây cho thấy yếu tố tăng trưởng nội mô mạch máu 1 (LvVEGF1) đóng một vai trò quan trọng trong nhiễm WSSV, và thúc đẩy sự nhân lên của WSSV (Wang và cộng sự, 2015). Protein phản ứng tăng trưởng sớm-1 có thể được gây ra bởi nhiễm vi-rút JC và liên kết và điều chỉnh chất kích thích vi-rút JC (Romagnoli và cộng sự, 2008). Do đó, mầm bệnh gia tăng trong tế bào máu có thể liên quan đến việc tăng tổng hợp thành phần tế bào. Những dữ liệu này có thể giải thích tại sao stress amoniac làm tăng tính nhạy cảm của tôm đối với mầm bệnh (Fang và cộng sự, 2017; Ge và cộng sự, 2014; Liu và Chen, 2004).
Kết quả phân tích các chất chuyển hóa huyết thanh (dựa trên LC-MS) cho thấy hàm lượng khác nhau của các chất chuyển hóa huyết thanh do phơi nhiễm với amoniac bao gồm axit amin, thành phần nucleotide và lipid. Trong số 10 axit amin trong các chất chuyển hóa vi phân huyết thanh, 9 trong số chúng được điều chỉnh xuống dưới áp lực amoniac. Các nghiên cứu trước đây đã chỉ ra rằng nồng độ amoniac tan máu có thể đạt tối đa trong L. vannamei phơi nhiễm với 20 mg/ L ammonia-N sau 24 giờ, và sau đó duy trì ở mức cao hơn trên 0,6 mmol/ mL, cao hơn đáng kể so với mức được phát hiện trong nhóm đối chứng với giá trị nhỏ hơn 0,3 mmol/ mL (Si và cộng sự, 2019). Nó đã được báo cáo rằng nồng độ amoniac cao cho thấy độc tính nhất định đối với động vật giáp xác (Lin và Chen, 2001; Romano và Zeng, 2013). Chúng tôi suy đoán rằng nồng độ amoniac tan máu cao có thể dẫn đến gián đoạn quá trình hấp thụ và trao đổi chất axit amin. Điều này sẽ dẫn đến việc không đủ nguyên liệu thô cho sự phát triển cơ thịt, và cuối cùng ảnh hưởng đến sự phát triển của tôm. Ngoài ra, stress amoniac có thể gây ra quá trình chết rụng trong các tế bào gan tụy (Liang và cộng sự, 2016). Quá trình apoptosis của các tế bào gan tụy gây ra rối loạn chuyển hóa nucleotide (Xiao và cộng sự, 2019). Đây có thể là nguyên nhân cho sự bất thường của các thành phần nucleotide trong huyết thanh, sẽ có tác dụng phụ đối với tế bào máu. Uracil, xanthine, taurine, Lanserine và guanosine đóng vai trò khác nhau trong quá trình apoptosis. Nó đã được báo cáo rằng sự tích tụ uracil và xanthine có thể gây ra quá trình apoptosis (Paone và cộng sự, 2014; Sola và cộng sự, 2004). Taurine đóng một vai trò quan trọng trong hệ thống miễn dịch như một chất chống oxy hóa để bảo vệ các tế bào khỏi stress oxy hóa (Schaffer và cộng sự, 2009). Sự tích tụ của taurine, L-anserine và guanosine có thể ức chế quá trình chết rụng (Jiang và cộng sự, 2007; Takatani và cộng sự, 2004; Tan và Candlish, 1998). Do đó, sự hiện diện của nồng độ uracil và xanthine cao, và mức độ thấp của taurine, L-anserine, guanosine và guanine trong huyết thanh của tôm khi phơi nhiễm với amoniac có thể thúc đẩy quá trình apoptosis. Giả thuyết này đã được xác nhận thêm thông qua việc phát hiện tỷ lệ tế bào apoptosis trong tế bào máu của tôm khi phơi nhiễm với amoniac. Glycerophosphocholine (GPC) có thể trải qua quá trình oxy hóa dẫn đến sự hình thành các GPCs bị oxy hóa (Ox-GPCs). Ox-GPCs có thể hoạt động như chất chủ vận mạnh cho thụ thể PAF (PAF-R) để tạo ra phối tử Ox-GPC PAF-R (Konger và cộng sự, 2008) có thể gây ức chế miễn dịch toàn thân (Sahu và cộng sự, 2012; Walterscheid và cộng sự, 2002). Đồng thời, người ta cũng phát hiện ra rằng việc tiêm hai chất chuyển hóa được điều chỉnh tăng triethanolamine và oxypurinol ở tôm bình thường cũng có thể gây ra quá trình chết rụng ở tôm bình thường. Những bằng chứng này cho thấy rằng những thay đổi của các chất chuyển hóa huyết thanh dưới áp lực amoniac có thể là một yếu tố quan trọng gây ra quá trình chết rụng của tế bào máu. Nó sẽ ảnh hưởng đến tình trạng sức khỏe của tôm, dẫn đến tăng trưởng chậm và khả năng miễn dịch kém (Chen và Lin, 1992; Wickins, 1976). Tình trạng sức khỏe tôm yếu có thể làm suy giảm lượng thức ăn, dẫn đến dư thừa thức ăn trong nước, điều này sẽ làm tăng hàm lượng dinh dưỡng trong nước nuôi trồng thủy sản và dẫn đến sự lan truyền cao của vi khuẩn. Đây có thể là cơ chế gây ra sự gia tăng vi khuẩn trong ao nước biển. Đồng thời, khả năng miễn dịch của tôm giảm và quá trình chết rụng của một số lượng lớn tế bào máu dẫn đến giảm khả năng của tế bào máu để loại bỏ vi khuẩn in vivo, dẫn đến số lượng vi khuẩn cao trong hemolymp, cuối cùng dẫn đến tôm dễ bị nhiễm bệnh hơn và tỷ lệ mắc bệnh cao hơn.
5. Kết luận
Tóm lại, stress amoniac dẫn đến rối loạn chuyển hóa axit amin và nucleotide, có thể là do quá trình chết rụng do amoniac và suy giảm chức năng của gan tụy. Nồng độ axit amin giảm trong huyết thanh đã ảnh hưởng đến sự phát triển bình thường của cơ bắp và cuối cùng làm tôm tăng trưởng chậm. Nồng độ amoniac trong hemolymph cao và mức độ bất thường của các chất chuyển hóa có thể gây ra quá trình chết rụng tế bào máu, làm giảm số lượng tế bào máu và cuối cùng làm giảm khả năng miễn dịch của tôm. Ngoài ra, nồng độ amoniac quá mức trong nước nuôi trồng thủy sản thường đi kèm với sự gia tăng của vi sinh vật. Những yếu tố này cuối cùng làm cho tôm dễ mắc bệnh hơn.
Theo Fei Liu, Shihao Li, Yang Yu, Mingzhe Sun, Jianhai Xiang, Fuhua Li
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Nguồn: https://www.sciencedirect.com/science/article/abs/pii/S00456535193199644
Xem thêm:
- Các chủng Probiotic được sử dụng trong nuôi trồng thủy sản
- Acinetobacter venetianus, Một Tác Nhân Tiềm Ẩn Gây Bệnh Đỏ Chân Ở Tôm Thẻ Chân Trắng Penaeus vannamei Nuôi Trong Môi Trường Nước Ngọt
- Nghiên Cứu Mới Xác Nhận Tác Động Tích Cực Của Dầu Krill Có Chứa Astaxanthin Lên Sự Tăng Trưởng Của Tôm Thẻ Chân Trắng Trong Điều Kiện Độ Mặn Cao

 English
English