Kỹ Thuật Nuôi, Tin tức
Phần 1: Vi Tảo Nước Ngọt (Schizochytrium sp.) Thay Thế Dầu Cá Làm Thức Ăn Cho Tôm
Tóm tắt
Vi tảo Schizochytrium sp. là nguồn giàu axit docosahexaenoic, DHA (66%-lipid với 27%-DHA). 8 khẩu phần cân bằng dinh dưỡng đã được xây dựng: khẩu phần 1 (đối chứng) chỉ bao gồm dầu cá (FO); khẩu phần 2 và 3 có lượng bột tảo và dầu đậu nành (SBO) tăng lên làm giảm FO; khẩu phần ăn 4 bao gồm sự kết hợp của bột tảo (37-g/kg), SBO (21-g/kg) và dầu hạt lanh (LSO) ở mức 4 g/kg mỗi loại; khẩu phần ăn 5 có bột vi tảo ở mức 50 g/kg và lượng LSO và SBO bằng nhau ở mức 8 g/kg; khẩu phần ăn 6 và 7 chứa lượng bột tảo bằng nhau ở mức 62 g/kg, nhưng với LSO hoặc SBO được thêm vào ở mức tương ứng là 8 mg/g; khẩu phần 8 chỉ chứa bột tảo ở mức 75 mg/g. Hiệu quả tăng trưởng và cho ăn của tôm thẻ chân trắng L. vannamei không khác biệt đáng kể giữa các nghiệm thức. Thành phần axit béo của cơ nói chung phản ánh thành phần của khẩu phần ăn. Lượng mô mỡ dưới biểu bì cơ cao hơn đáng kể đối với tôm ăn khẩu phần ăn 3 và 7, trong khi lipase đường ruột cao hơn đáng kể ở tôm ăn khẩu phần ăn 7 và 8. Quá trình peroxy hóa lipid cơ không bị ảnh hưởng bởi khẩu phần ăn, mặc dù hoạt động chống oxy hóa cao hơn đáng kể cho tôm ăn khẩu phần 7 so với khẩu phần ăn 1. Nhìn chung bột tảo có thể thay thế hoàn toàn dầu FO trong thức ăn tôm.
1. Giới thiệu
Nuôi trồng thủy sản hiện đang tăng trưởng nhanh hơn 10% so với đánh bắt thủy sản và tạo ra doanh thu 160,2 tỷ đô la Mỹ trong năm 2015. Hiện nay, thế giới sản xuất gần 44 triệu tấn sản phẩm cá có vây và gần 3 triệu tấn giáp xác tại các trang trại nuôi trồng thủy sản nội địa (Tổ chức Lương thực và Nông nghiệp Liên hợp quốc, FAO). Trong số các loài giáp xác được sản xuất trong nuôi trồng thủy sản, tôm thẻ chân trắng (Litopenaeus vannamei) được sản xuất với số lượng lớn nhất cho đến nay, có thể là do tốc độ tăng trưởng nhanh, giá trị thị trường cao và khả năng kháng bệnh cao hơn. Khi nuôi tôm tăng lên, nhu cầu đối với các thành phần có nguồn gốc từ biển, chẳng hạn như dầu cá (FO) cũng tăng lên. Tuy nhiên, nguồn tài nguyên này đang trở nên đắt đỏ hơn, nên nghiên cứu đang được tiến hành để tìm ra nguồn thay thế phù hợp mà không gây nguy hiểm cho sức khỏe của cá và động vật giáp xác. Trong số các lựa chọn thay thế FO tiềm năng, dầu từ vi tảo thraustochytrid, như Crypthecodinium sp. và Schizochytrium sp., đã được công nhận là nguyên liệu đầy triển vọng trong thức ăn thủy sản do hàm lượng axit béo không bão hòa đa chuỗi dài (LC-PUFA) cao và thực tế là chúng mang lại hiệu suất tăng trưởng tương tự hoặc tốt hơn so với FO ở các loài động vật thủy sinh khác nhau. Ví dụ, cá da trơn (Ictalurus punctatus) được cho ăn khẩu phần ăn với lượng bột Schizochytrium khô ngày càng tăng (0 đến 20 g/kg) thay vì dầu xuất chiết nội tạng cá da trơn đã tăng trọng lượng đáng kể khi cho ăn ở mức 10 hoặc 15 g/kg. Tương tự, khi Schizochytrium được sử dụng làm chất thay thế FO cho thức ăn cá hồi Đại Tây Dương (Salmo salar), tăng trưởng không bị ảnh hưởng và dầu vi tảo cũng dễ tiêu hóa như FO.
Việc bổ sung dầu vi tảo trong khẩu phần ăn của tôm thẻ chân trắng cũng cho thấy nhiều hứa hẹn. Thay thế hoàn toàn FO bằng các kết hợp khác nhau của dầu Schizochytrium, dầu Mortierella, dầu đậu nành (SBO) và dầu lanh trong khẩu phần ăn dựa trên protein thực vật đã mang lại sự tăng trưởng và tỷ lệ sống tương tự như khẩu phần ăn thương mại (đối chứng). Một nghiên cứu tiếp theo cho thấy rằng sự kết hợp giữa khẩu phần ăn Schizochytrium và dầu Mortierella đã cải thiện tăng trưởng ở tôm thẻ chân trắng L. vannamei một chút so với khẩu phần ăn dựa trên dầu ăn FO. Tương tự, việc sử dụng duy nhất khẩu phần ăn Schizochytrium dẫn đến sự tăng trưởng tương tự ở tôm thẻ chân trắng L. vannamei như FO mà không ảnh hưởng đến tỷ lệ sống hoặc hoạt tính của enzyme tiêu hóa trong ruột và gan tụy. Ngoài ra, Nonwachai và cộng sự đã phát hiện ra rằng bột Schizochytrium trong khẩu phần ăn đã tăng cường các phản ứng miễn dịch bẩm sinh ở L. vannamei, bao gồm hoạt động thực bào, hoạt tính của enzyme chống oxy hóa và tổng số lượng tế bào máu, cũng như khả năng chống lại mầm bệnh Vibrio harveyi. Những phát hiện này, cùng với dữ liệu cho thấy bột vi tảo thường dẫn đến hàm lượng LC-PUFA cao ở L. vannamei được cho ăn khẩu phần ăn dựa trên dầu thực vật hoặc FO, cho thấy nguồn tài nguyên bền vững giàu axit béo omega-3 này có thể mang lại nhiều lợi ích hơn cho cả cá và người tiêu dùng.
Hiện tại, tác động của việc sử dụng bột vi tảo trong khẩu phần ăn đối với các thông số liên quan đến chuyển hóa lipid như hoạt tính lipase, cholesterol toàn phần và mô mỡ dưới biểu bì vẫn chưa được khám phá. Mục đích của nghiên cứu này là đánh giá tác động của việc thay thế FO trong khẩu phần ăn bằng bột Schizochytrium đơn thuần hoặc kết hợp với SBO và/hoặc LSO đối với tỷ lệ sống, tăng trưởng, thành phần axit béo trong cơ, tình trạng chống oxy hóa trong cơ và hoạt tính lipase đường ruột của tôm thẻ chân trắng L .vannamei.
2. Vật liệu và phương pháp
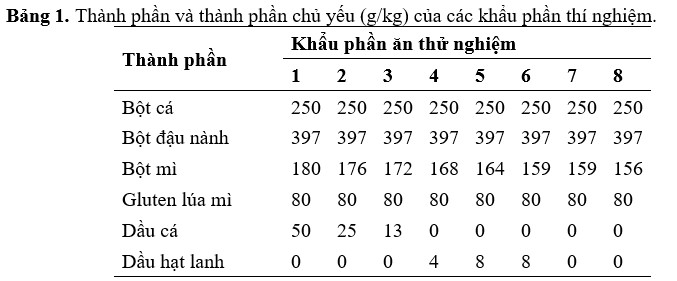
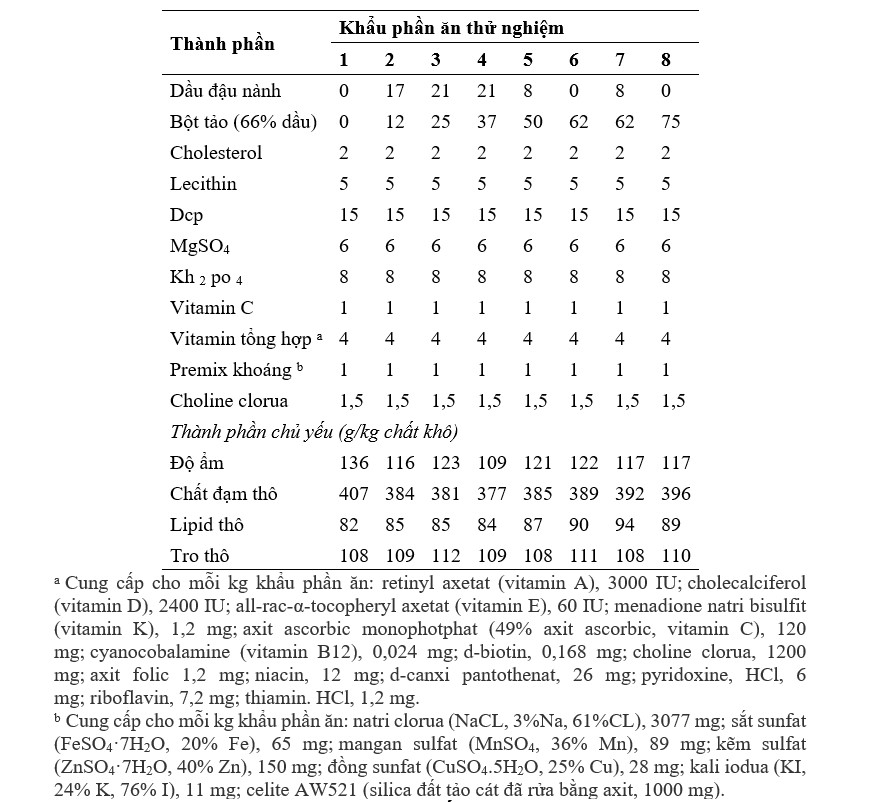
2.1. Chuẩn bị bột tảo và khẩu phần thí nghiệm
Tảo lên men Schizochytrium sp., đã được sử dụng trong nghiên cứu này (Nguồn: Alltech Lexington, KY, USA). Tảo lên men được ly tâm liên tục (5.000 g) để thu được chất rắn sau đó được phun sấy khô thu được bột tảo mịn. Máy sấy phun Kochiwa [sử dụng nguyên tử hóa li tâm (4.500 g) ở nhiệt độ đầu vào (140–150°C), buồng trung tâm (130–135°C) và nhiệt độ đầu ra là (80–85°C)] đã được sử dụng để chuẩn bị bột khô phun. Mất 6–8 giây để tạo thành bột tảo sau khi bơm. Thành phần quan trọng được đo theo phương pháp tiêu chuẩn của Hiệp hội các nhà hóa học phân tích chính thức, cho thấy bữa ăn này chứa hàm lượng lipid là 66%. Thành phần quan trọng của các thành phần như SBM, bột mì và gluten lúa mì cũng được đo lường tương tự. Tổng cộng có 8 khẩu phần ăn giàu nitơ (chứa 40% protein) và giàu năng lượng (9,0% lipid) được xây dựng để chứa lượng bột tảo ngày càng tăng (chứa 660 g/kg lipid có thể chiết xuất được; Bảng 1). Bất kể khẩu phần ăn nào, bột cá (FM) và bột đậu nành (SBM) là nguồn protein chiếm ưu thế và được bổ sung vào tất cả các khẩu phần ăn thử nghiệm ở mức tương ứng là 250 và 397 g/kg. Hàm lượng protein thô, lipid, vitamin và khoáng chất được điều chế đáp ứng nhu cầu của tôm He. Ngoài ra, cholesterol, choline clorua và lecithin được đưa vào tất cả các khẩu phần ăn để đáp ứng yêu cầu của L. vannamei. Khẩu phần đối chứng (khẩu phần 1) có 6% FO là nguồn lipid chính, tương tự như lượng sử dụng trong khẩu phần thương mại (Bảng 1). Khẩu phần 2 và 3 có lượng bột tảo và SBO ngày càng tăng, thay vào đó là FO. FO được thay thế hoàn toàn trong khẩu phần 4 bằng sự kết hợp của bột tảo, SBO và LSO. Khẩu phần ăn 5–8 cũng không chứa FO, nhưng có các kết hợp lipid khác nhau: khẩu phần ăn 5 có lượng LSO và SBO bằng nhau ở mức 8 g/kg; khẩu phần ăn 6 và 7 chứa lượng bột tảo bằng nhau, nhưng bổ sung thêm LSO hoặc SBO ở mức tương ứng là 8 g/kg; khẩu phần 8 chỉ chứa bột tảo là nguồn lipid bổ sung duy nhất, với hàm lượng cao nhất là 75 g/kg. Bột mì được điều chỉnh trong các khẩu phần thí nghiệm để bù đắp cho một lượng nhỏ protein thô trong bột tảo (Bảng 1). Trong khi đó, khẩu phần ăn Schizochytrium có ít EPA, nhưng có thể được tổng hợp bởi một số động vật thủy sinh từ tiền chất, ALA. Do đó, LSO, có hàm lượng ALA cao, đã được bổ sung vào khẩu phần ăn 4–6 để xác định xem liệu điều này có thể dẫn đến mức EPA cao trong tôm hay không. Nguyên liệu thức ăn khô được nghiền kỹ và trộn trong máy trộn (Hobart A200, Hobart, Troy, OH, USA) để chuẩn bị thức ăn cho tôm. Tiếp theo là thêm nước ấm để duy trì độ ẩm 35% và trộn thêm 10 phút nữa. Bột này của mỗi khẩu phần ăn được đưa qua máy tạo viên thức ăn chăn nuôi (máy xay thịt, Glen Mills Inc., Clifton, NJ, USA) với khuôn 2 mm, sau đó được sấy khô trong không khí trong 24 giờ. Các sợi dài của khẩu phần ăn được nghiền thành bột bằng máy xay (Glen Mills Inc., Clifton, NJ, USA) và thu được kích thước viên 2 mm bằng cách sử dụng rây. Sau khi sàng lọc, lượng thích hợp của LSO, SBO, và FO được thêm thủ công để ức chế sự phá hủy của các axit béo không bão hòa cao trong quá trình tạo hạt. Sau khi các khẩu phần được làm khô, thành phần hóa học bao gồm axit béo của các khẩu phần được xác định (Bảng 1).
2.2. Động vật thí nghiệm và bố trí thí nghiệm
Tôm thẻ post (Litopenaeus vannamei) được mua từ trại sản xuất tôm giống tư nhân (Shrimp Improvement Systems, LLC, Islamorada, FL, USA) và dần dần được thuần trong hệ thống ương tôm tại khoa nuôi trồng thủy sản, Đại học bang Kentucky, Frankfort, KY, Hoa Kỳ. Bể ương 1.000 lít (dùng làm hệ thống ương tuần hoàn) kết nối với bể lắng rắn và bể lọc sinh học (Red-Ewald, Karnes City, TX, USA) để duy trì điều kiện thông số nước tối ưu cho ấu trùng tôm. Nước biển nhân tạo được tạo ra bằng cách trộn hỗn hợp muối Crystal Sea Marine (Marine Enterprises International, LLC, Baltimore, MD) với nước máy đã khử Clo đến độ mặn 34 phần nghìn (ppt). Các bể nuôi được sục khí nhẹ (khuếch tán gốm). Độ mặn dần dần giảm xuống 27–28 ppt bằng cách bổ sung nước ngọt trong thời gian thích nghi hai tuần và được cho ăn thức ăn cho tôm có bán trên thị trường (Zeigler Brothers Inc.).
Tổng số 600 tôm con (3,15 ± 0,08 g) được cân riêng, chia thành 24 nhóm, mỗi nhóm 25 con và đặt vào bể kính 110 L. Sau khi thả tôm, 8 khẩu phần ăn điều trị được phân bổ ngẫu nhiên thành 3 lần. Bể được kết nối với hệ thống lọc hạt sinh học và cơ học 2000L (Red-Ewald, Karnes City, TX, USA) ở độ mặn 27–28 ppt. Mỗi bể được cung cấp nước biển với tốc độ 4,0 L/phút và sục khí tối ưu được cung cấp bởi các bộ khuếch tán không khí 12 inch duy nhất bằng máy thổi Rotron (Ametek, Kent, OH, USA).
Trong suốt thí nghiệm, tôm được cho ăn 5% tổng trọng lượng cơ thể hàng ngày, được chia đều và cho ăn vào lúc 08:00, 11:30, 15:30 và 18:00. Lượng thức ăn đưa vào được cân nhắc và làm quen 4 tuần/ lần dựa trên đánh giá sinh khối sau khi đo tổng trọng lượng tôm trong mỗi bể; số lượng thức ăn cho ăn mỗi ngày được ghi nhận trên mỗi bể cá. Tôm được cho ăn tổng cộng 8 khẩu phần ăn (1 đối chứng và 7 khẩu phần ăn thử nghiệm) trong thời gian 12 tuần.
Trong suốt quá trình thử nghiệm cho ăn, nhiệt độ nước được duy trì ở khoảng 29°C bằng thiết bị gia nhiệt nhúng. Độ mặn được duy trì bằng cách bổ sung nước sạch để thay thế lượng nước mất đi do bay hơi hoặc bổ sung muối để thay thế lượng nước mất đi. Độ pH, nhiệt độ, độ mặn và oxy hòa tan được đo một lần mỗi ngày bằng máy đo Hydrolab Quanta (Hydrolab Corporation, Loveland, CO). Quang kỳ 12 giờ sáng: 12 giờ tối bằng đèn trần huỳnh quang trên cao. Vào buổi sáng và buổi tối, tất cả các bể được hút hàng ngày để loại bỏ thức ăn thừa và phân. Tổng nồng độ nitơ amoniac (TAN) và nitrit-N (NO2-N) được đo mỗi tuần 1 lần trên máy đo quang phổ Hach DR 3800 theo hướng dẫn của nhà sản xuất (Hach, Hoa Kỳ). Nếu TÂN hoặc NO2-N vượt quá 0,5 mg/L, tiến hành thay nước một phần.
2.3. Lấy mẫu và phân tích
Sau 12 tuần, tôm được thu hoạch từ mỗi bể nuôi; được cân và đếm số lượng lớn để tính tốc độ tăng trưởng, hiệu quả cho ăn và tỷ lệ sống bằng cách sử dụng các phương trình sau:
Trọng lượng cơ thể (BMG; %) = [(trọng lượng cơ thể cuối cùng – trọng lượng cơ thể ban đầu) / trọng lượng cơ thể ban đầu]
Tỷ lệ chuyển đổi thức ăn (FCR) = lượng thức ăn khô đưa vào g / trọng lượng cơ thể g
Tỷ lệ hiệu quả protein (PER) = trọng lượng cơ thể g / lượng protein thô đưa vào g
Giá trị sản xuất protein (PPV, %) = [( lượng protein cơ thể tôm cuối cùng g – lượng protein cơ thể tôm ban đầu) / tổng lượng protein tiêu thụ g]
Giá trị sản xuất lipid (LPV, %) = [( lượng lipid cơ thể tôm cuối cùng g – lượng lipid cơ thể tôm ban đầu) / tổng lượng lipid tiêu thụ g] ×100
Sau khi cân và đếm, tôm được gây mê trong bể nước đá (0–4°C) và các mẫu được thu thập và bảo quản ở -20°C để phân tích thêm. Năm con tôm từ mỗi bể nuôi được sử dụng cho thành phần gần đúng của toàn bộ cơ thể theo AOAC. Các mẫu gan tụy, ruột và cơ đuôi được thu thập từ những con tôm còn lại và được bảo quản đông lạnh (-80°C) cho đến khi phân tích thêm.
2.4. Thành phần lipid của khẩu phần và cơ, chất chống oxy hóa và enzyme phân hủy lipid
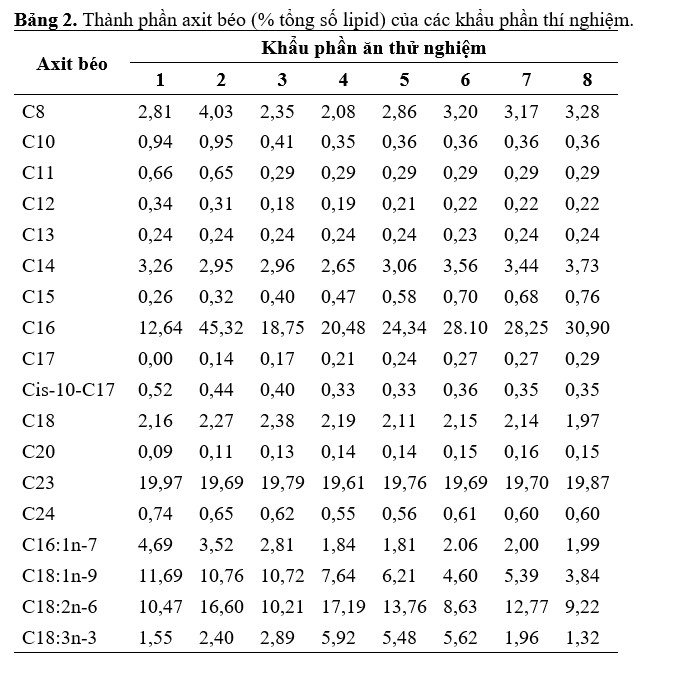
Khẩu phần ăn (Bảng 2) và các mẫu cơ của 5 con tôm trong mỗi bể được phân tích thành phần axit béo bằng sắc ký khí định lượng (sử dụng C23:0 làm chất chuẩn nội). Tổng lượng cholesterol từ cơ bắp được phân tích bằng cách sử dụng bộ xét nghiệm cholesterol toàn phần so màu theo hướng dẫn của nhà sản xuất (Cell Biolabs Inc., San Diego, CA). Độ hấp thụ được đọc trên Máy đọc đa chế độ Synergy HTX (BioTek, Instruments, Inc., Winooski, VT). Các mẫu cơ (với chất tiêu hóa) từ 6 con tôm trong mỗi lần lặp lại ngay lập tức được bảo quản ở -80°C. Để phân tích, các mẫu được làm tan băng trong bể nước đá và được đồng nhất hóa bằng bộ xử lý siêu âm (Chuyên gia khoa học Cole Parmer, Vernon Hills, IL, Hoa Kỳ) trong 5 phút trong bể nước đá. Các mẫu sau đó được đặt trong ống siêu nhỏ 1,5 ml (Eppendorf, Hamburg, Đức) với dung dịch muối đệm phốt phát (PBS; Fisher Bioreagents, Fair Lawn, NJ, USA) và giải pháp ly giải tế bào (Promega Corporation, Madison, WI, USA).
Bảng 2. Thành phần axit béo (% tổng số lipid) của các khẩu phần thí nghiệm.

Các hoạt động của lipase, catalase (CAT) và superoxide dismutase (SOD) cũng như hàm lượng lipid peroxide và quá trình tạo mỡ được phân tích bằng cách sử dụng Synergy HTX Multi-Mode Reader (BioTek, Instruments, Inc., Winooski, VT, USA). Hoạt động của lipase đường ruột được đo bằng bộ xét nghiệm lipase QuantiChrom (DLPS-100; BioAssay Systems, Hayward, CA, USA) theo hướng dẫn của nhà sản xuất; độ hấp thụ đã được đọc ở 412 nm. Các hoạt động CAT và SOD trong cơ đuôi được đo bằng bộ dụng cụ thử nghiệm thương mại (Cayman Chemical, Ann Arbor, MI, USA); độ hấp thụ được đọc ở bước sóng 540 nm và 460 nm tương ứng. Lipid peroxide trong cơ đuôi được đo bằng cách phân tích mức độ malondialdehyd (MDA) bằng cách sử dụng bộ xét nghiệm đo màu/đo huỳnh quang (BioVision Incorporated, Milpitas, CA, USA) theo hướng dẫn của nhà sản xuất; độ hấp thụ được đọc ở bước sóng 532 nm. Quá trình tạo mỡ được đo bằng cách định lượng sự tích tụ chất béo trung tính trong mô cơ. Lượng mô mỡ dưới biểu bì được phân tích bằng cách sử dụng bộ Xét nghiệm Adipogenesis (Abnova, Thành phố Đài Bắc, Đài Loan); độ hấp thụ được đọc ở bước sóng 570 nm.
2.5. Phân tích thống kê
Tất cả dữ liệu được phân tích bằng phân tích phương sai một chiều (ANOVA) bằng phần mềm SAS/STAT (SAS, 1988). Nếu phát hiện thấy sự khác biệt đáng kể (p < 0,05), giá trị trung bình của các biến phụ thuộc được so sánh bằng cách sử dụng phép kiểm tra sự khác biệt có ý nghĩa trung thực (HSD) của Tukey. Dữ liệu của chúng tôi được biểu diễn dưới dạng trung bình ± SEM.
Theo Kristy M. Allen, Habte-Michael Habte-Tsion, Kenneth R. Thompson, Keith Filer, James H. Tidwell, Vikas Kumar
Nguồn: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6467892/
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Aeromonas hydrophila, Tác Nhân Gây Bệnh Trên Tôm Thẻ Chân Trắng Litopenaeus vannamei Nuôi Nước Ngọt
- Aeromonas schubertii, Một Loại Vi Khuẩn Mới Được Phát Hiện Từ Các Trang Trại Bị Ảnh Hưởng Bởi AHPND, Có Khả Năng Gây Chết Tôm Thẻ Chân Trắng (Penaeus vannamei)
- Nấm Men Biến Đổi Gen – Nguồn Astaxanthin Đầy Hứa Hẹn Cho Thức Ăn Tôm

 English
English