Kỹ Thuật Nuôi, Tin tức
Phần 2: Vi Bào Tử Trùng Enterocytozoon hepatopenaei Không Phải Là Nguyên Nhân Gây Ra Hội Chứng Phân Trắng Ở Tôm Thẻ Chân Trắng Penaeus (Litopenaeus) vannamei
Kết quả
Phân tích tiểu đơn vị nhỏ đoạn gen RNA ribosome
Khi các đoạn mồi MF được thiết kế từ trình tự ssu rRNA của loài Enterocytozoon được sử dụng với các chiết xuất DNA gan tụy khuôn mẫu từ P. vannamei bị nhiễm vi bào tử trùng, một amplicon 951 bp đã thu được (Tệp bổ sung 1). Điều này nằm trong phạm vi kích thước dự kiến khoảng 900–1000 bp, dựa trên các vùng được bảo tồn của trình tự ssu rRNA của Enterocytozoon được liệt kê tại GenBank (FJ496356) và amplicon trước đó dài 886 bp thu được từ P. monodon bị nhiễm Enterocytozoon hepatopenaei. Việc nhân bản và giải trình tự 3 bản sao cho thấy trình tự giống hệt nhau 100% đối với 2 bản sao và chỉ có 2 nucleotide biến đổi đối với bản sao thứ ba. Một trình tự đồng thuận đã được kết luận từ hai bản sao giống hệt nhau và một phần 913 bp của trình tự amplicon (không bao gồm trình tự mồi, số hiệu Genbank KF362130) đã được đưa vào tìm kiếm BLASTN chung chỉ mang lại các kết quả tìm kiếm cho các bản ghi trình tự vi bào tử trùng. Các kết quả tìm kiếm hàng đầu từ tìm kiếm BLASTN bao gồm Enterocytozoon được phân lập từ P. monodon (GenBank FJ496356) với độ đồng nhất 96%, Nucleospora salmonis (GenBank U10883) với độ đồng nhất 89% và E. bieneusi (GenBank: AY257180) với độ đồng nhất 89%. Các mồi MF1 và MR1 cũng được sử dụng để khuếch đại mục tiêu gen rRNA ssu từ vật liệu lưu trữ của P. monodon bị nhiễm bệnh được sử dụng trong công trình đã công bố trước đây đã tạo ra bản ghi GenBank FJ496356. Một trình tự đồng thuận đã được thiết lập từ 3 bản sao cũng có 913 bp mỗi bản và được đặt tên là Pm-Entero (mã số Genbank KF362129). Sự sắp xếp clustal của trình tự 913 bp của chúng tôi từ P. vannamei với trình tự 913 bp của chúng tôi từ P. monodon cho thấy 99% tính đồng nhất, cho thấy các bệnh nhiễm trùng phát sinh từ cùng một loài vi bào tử trùng (Hình 1).

Phát hiện vi bào tử trùng bằng PCR và lai in Stu ở P. vannamei
Với mẫu thực địa sơ bộ gồm 11 con tôm lấy từ một ao WFS và 10 con từ một ao bình thường gần đó, các xét nghiệm PCR sử dụng các đoạn mồi đặc hiệu cho E. hepatopenaei (Bảng 1) cho thấy 10/11 con tôm từ ao WFS có kết quả dương tính trong khi tất cả 10 con từ ao bình thường đều có kết quả âm tính (Bảng 2). Tuy nhiên, một bộ mẫu sau đó (Bảng 3) cho kết quả ít rõ ràng hơn, trong đó một số ao không có dấu hiệu nhiễm WFS cao (9/10 tôm) dương tính với E. hepatopenaei bằng PCR (chủ yếu là PCR lồng nhau), trong khi các ao khác có dấu hiệu WFS cho tôm ít nhiễm dương tính bằng PCR (4/10). Ngoài ra, một ao phục hồi không có dấu hiệu WFS (Bảng 4) có tôm (8/9) bị nhiễm trùng lan rộng được xác định bằng lai in situ. Điều này tạo nên mối tương quan kém giữa các dấu hiệu WFS và mức độ nghiêm trọng của nhiễm trùng E. hepatopenaei.
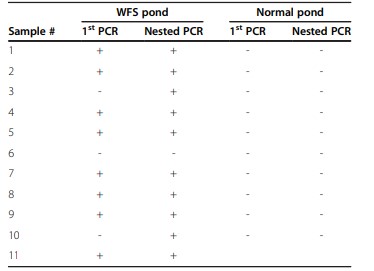
Sử dụng đầu dò được gắn nhãn digoxygenin (DIG) để xác nhận tính hợp lệ của xét nghiệm PCR, hầu hết (4/6) mẫu dương tính in situ rộng rãi đều có PCR dương tính bước 1 (2 ngoại lệ Bảng 3, Pond7 YOT4 & Pond6 YOT). Các mẫu cho phản ứng lai in situ dương tính nhẹ (n = 7) chỉ dương tính với bước 2 (PCR lồng nhau) (n = 4) hoặc cho phản ứng PCR âm tính (n = 2), trong khi một mẫu cho kết quả dương tính với bước 1 (Pond 13 BAP-1). Trong số 11 mẫu cho kết quả xét nghiệm lai in situ âm tính, 6 mẫu cho kết quả xét nghiệm PCR âm tính và 5 mẫu cho kết quả PCR dương tính với bước 2.
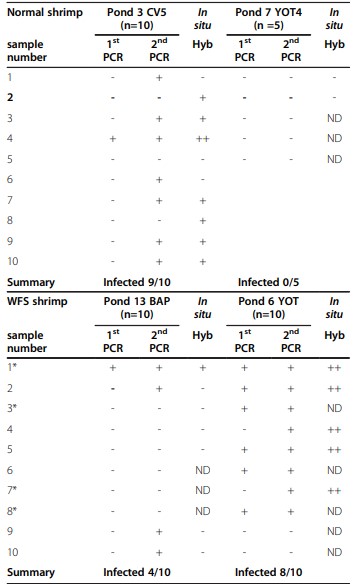
* Mô học của tôm trong các ao này không cho thấy dấu hiệu nhiễm vi bào tử trùng nhưng 4 mẫu cho thấy dấu hiệu nhiễm vi khuẩn nghiêm trọng ở HP có thể đã che khuất bất kỳ vi bào tử trùng nào hiện diện. 6 mẫu còn lại trông bình thường, không có dấu hiệu nhiễm vi bào tử trùng.
Phát hiện vi bào tử trùng bằng PCR và lai in situ trong 2 ao bình thường và 2 ao WFS. Hyb ++ chỉ ra phản ứng lai in situ dương tính rộng rãi trong mô HP trong khi Hyb + chỉ ra phản ứng dương tính cục bộ nhẹ và Hyb – chỉ ra không có phản ứng. ND Chưa thực hiện.
Bệnh học mô học và lai in situ của các bệnh nhiễm trùng ở tôm thẻ chân trắng P. vannamei
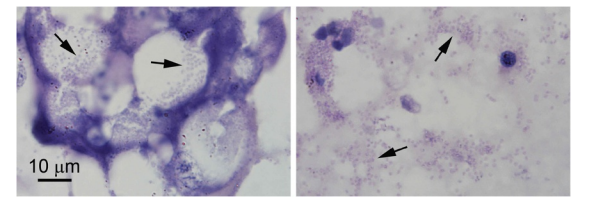
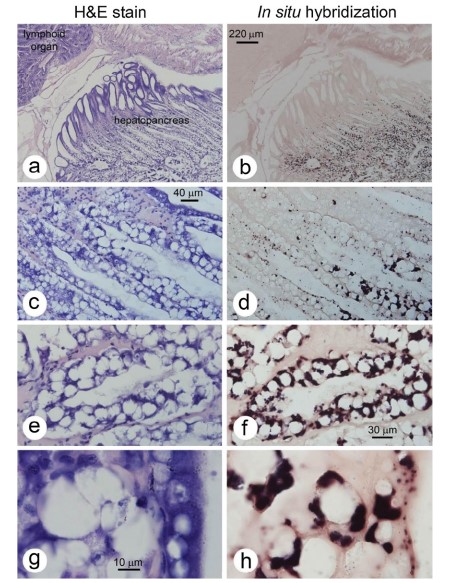
Như đã báo cáo trước đây về nhiễm trùng E. hepatopenaei ở P. monodon, số lượng tế bào gan tụy biểu hiện sự hình thành bào tử ở P. vannamei (Hình 2) là nhỏ, tạo ra ấn tượng hời hợt rằng mức độ nhiễm trùng rất hạn chế. Kích thước của bào tử (dài khoảng 1 μm và rộng dưới 1 μm) và vị trí tế bào chất cũng tương tự như những mô tả trước đây đối với E. hepatopenaei ở P. monodon. Tuy nhiên, sự khác biệt ở P. vannamei bao gồm sự hình thành bào tử chỉ ở tế bào B (Hình 2) và nhiễm trùng rộng rãi ở các tế bào biểu mô ống giữa và gần của gan tụy khi không có bào tử, như được phát hiện bằng lai in situ (Hình 3). Đây không phải là tình huống của các báo cáo trước đây về E. hepatopenaei ở P. monodon, trong đó tương đối ít tế bào tạo ra bào tử hoặc cho thấy ký sinh trùng sốt rét có thể nhận biết được và chỉ những tế bào đó mới dương tính với lai in situ. Các tế bào cho phản ứng lai in situ dương tính ở P. vannamei bị giới hạn ở vùng trung tâm của HP và không mở rộng đến vùng xa bao gồm các tế bào E. Ở vùng chuyển tiếp giữa các tế bào trung gian và xa, phản ứng lai in situ dương tính chỉ điểm cho thấy giai đoạn nhiễm trùng sớm xảy ra khi các tế bào HP biệt hóa từ tế bào E thành tế bào B, F và R. Các tiêu bản đối chứng âm tính sử dụng đầu dò gắn nhãn GFP-DIG không cho phản ứng lai in situ dương tính (không hiển thị). Ở độ phóng đại thấp và trung bình bằng nhuộm H&E (Hình 3a, c, e), không có đặc điểm tế bào chất đặc biệt nào cho thấy các thành phần vi bào tử tạo ra phản ứng lai in situ dương tính ở các lát cắt mô liền kề. Ở độ phóng đại cao nhất bằng phương pháp nhuộm H&E (thấu kính nhúng dầu), các thể vùi tế bào chất ưa kiềm có hình dạng, kích thước và số lượng rất khác nhau (Hình 3g) có mặt trong các tế bào nhuộm H&E và một số trong số này có thể có nguồn gốc từ vi bào tử trùng nhưng không thể phân biệt rõ ràng với các cấu trúc tế bào chất ưa kiềm bình thường khác của vật chủ. Do hiện tượng này, đánh giá mô bệnh học về mức độ nghiêm trọng của các bệnh nhiễm trùng này bằng phương pháp nhuộm H&E có thể gây hiểu lầm, nếu tiêu chí được sử dụng là số lượng tế bào có bào tử trùng hoặc các cấu trúc vi bào tử trùng dễ nhận biết khác.
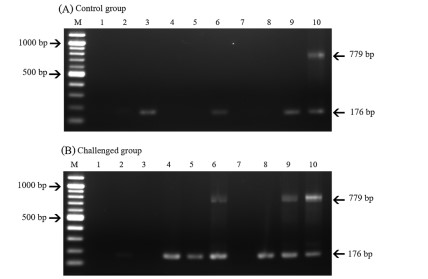
Các thử nghiệm cảm nhiễm trong phòng thí nghiệm
Do mối liên quan giữa nhiễm trùng Enterocytozoon với WFS ở P. vannamei (nghiên cứu này) và P. monodon, một xét nghiệm cảm nhiễm trong phòng thí nghiệm sơ bộ đã được tiến hành để xác định khả năng lây truyền trực tiếp bằng cách sử dụng P. vannamei bình thường được cho ăn mô gan tụy của tôm có nguồn gốc từ ao nuôi tôm đang xảy ra dịch WFS. Tôm đối chứng được cho ăn mô gan tụy của tôm bình thường. Khi lấy mẫu tôm đối chứng vào ngày 2, 4 và 7 sau cảm nhiễm, 1 trong 3 con tôm được lấy mẫu vào mỗi ngày cho ra đoạn khuếch đại vi bào tử trùng yếu khi phân tích PCR bước 2 (Hình 4), cho thấy rằng khoảng 1/3 tôm đã bị nhiễm vi bào tử trùng nhẹ trước khi thí nghiệm bắt đầu. Tương tự như vậy, trong nhóm thử nghiệm, 1 trong 3 con tôm được lấy mẫu cho ra đoạn khuếch đại vi bào tử trùng yếu khi phân tích PCR bước 2 sau 2 ngày cảm nhiễm, trong khi phản ứng mạnh hơn thu được vào ngày 4 và 7, với hai trong số những phản ứng này cho kết quả dương tính ở bước 1 (Hình 4). Không có con tôm nào trong nhóm thử nghiệm hoặc nhóm đối chứng cho thấy dấu hiệu rõ ràng của WFS hoặc không có tôm chết trong thời gian thử nghiệm 7 ngày. Những kết quả này chỉ ra rằng E. hepatopenaei có thể được truyền theo chiều ngang ở P. vannamei thông qua hành vi ăn thịt đồng loại, và điều này trái ngược với Agmasoma penaei lây truyền sang tôm qua con đường gián tiếp từ vật chủ thay thế.
Thảo luận
Do đặc tính mô giống hệt nhau, kích thước bào tử giống hệt nhau và tính đồng nhất trình tự đạt 99% khi so sánh các đoạn gen ssu rRNA dài 913 bp, chúng tôi kết luận rằng vi bào tử trùng mới tìm thấy ở P. vannamei giống hệt với E. hepatopenaei đã được báo cáo trước đó từ P. monodon. Tuy nhiên, chúng tôi chỉ giải trình tự 3 bản sao (98-99% giống hệt nhau) từ mỗi loài tôm để có được trình tự đồng thuận mà chúng tôi sử dụng để so sánh phát sinh loài. Do đó, theo bảng lấy mẫu thú y, có thể đã bỏ sót trình tự của các bản sao khác của gen ssu rRNA có thể có mặt dưới mức phổ biến 64% trong DNA khuôn mẫu và có thể khác với trình tự đồng thuận của chúng tôi hơn 1 hoặc 2%. Do đó, cần có phân tích di truyền chi tiết hơn về toàn bộ, gen RNA tiểu đơn vị nhỏ và lớn, vùng ITS và có lẽ là các gen khác để xác nhận hoàn toàn kết luận của chúng tôi rằng E. hepatopenaei lây nhiễm cho cả hai loài tôm này.
Chúng tôi không có lời giải thích nào về sự khác biệt giữa kết quả xét nghiệm PCR dương tính mạnh ở bước 1 mặc dù có phản ứng lai in situ nhẹ ở một trong các mẫu vật từ Ao 13 BAP. Đặc biệt quan trọng là bộ mẫu thứ ba từ ao WFS đã phục hồi, trong đó hầu hết tôm (8/9) cho thấy nhiễm E. hepatopenaei nặng từ phân tích lai in situ (Bảng 4) mặc dù không có dấu hiệu phân trắng. Thật không may, không có mẫu HP nào của những con tôm sau này được chuẩn bị phân tích PCR. Nhìn chung, những kết quả này và kết quả của thử nghiệm cảm nhiễm qua đường miệng không chỉ ra mối liên hệ chắc chắn giữa WSF và nhiễm E. hepatopenaei. Mặt khác, có khả năng mức độ nghiêm trọng của nhiễm E. hepatopenaei có thể tăng lên do các nguyên nhân cơ bản chưa biết của WFS, do đó tạo ra ít dấu hiệu về nguyên nhân.

Bản chất lan rộng của nhiễm E. hepatopenaei ở nhiều mẫu vật được kiểm tra cho thấy sẽ có nhu cầu năng lượng cao đối với ký sinh trùng đang phát triển và điều này sẽ có tác động tiêu cực đến sự phát triển của vật chủ. Do khó khăn trong việc đánh giá mức độ nghiêm trọng của nhiễm trùng bằng phương pháp nhuộm H&E thông thường, do đó cần thận trọng khi theo dõi ao nuôi để tìm E. hepatopenaei bằng phân tích PCR, đặc biệt là nếu tốc độ tăng trưởng thấp hơn dự đoán khi không có nguyên nhân rõ ràng khác. Có thông tin lan truyền rằng một hoạt động nuôi trồng ở Thái Lan hiện đã áp dụng chính sách chấm dứt và thả lại ao nuôi có tỷ lệ nhiễm E. hepatopenaei cao và mức độ nghiêm trọng được chỉ ra bằng phản ứng PCR dương tính bước 1 trong tháng đầu tiên nuôi, vì hồ sơ của họ cho thấy những ao này có tốc độ tăng trưởng tôm không có lãi.
Mặc dù nghiên cứu của chúng tôi ghi nhận sự hiện diện phổ biến của vi bào tử trùng Enterocytozoon hepatopenaei ở tôm thẻ chân trắng (Penaeus vannamei) biểu hiện hội chứng WFS, nhưng không có bằng chứng cho thấy ký sinh trùng này có mối liên quan trực tiếp đến nguyên nhân gây ra WFS. Tuy nhiên, mức độ nghiêm trọng của tình trạng nhiễm E. hepatopenaei có xu hướng gia tăng do các yếu tố nền liên quan đến WFS. Do loài vi bào tử trùng này không được phát hiện trong đàn tôm SPF của Thái Lan, nguồn nhiễm trong ao nuôi nhiều khả năng bắt nguồn từ sự lây truyền từ một hoặc nhiều loài vật chủ bản địa. Vì vậy, chiến lược kiểm soát hiệu quả nhất là xác định chính xác các loài vật chủ trung gian và loại trừ chúng khỏi hệ thống sản xuất tôm. Các kỹ thuật PCR và lai tại chỗ (in situ hybridization) được phát triển trong nghiên cứu này được kỳ vọng sẽ là những công cụ hữu ích trong việc nhận diện các loài vật chủ nói trên.
Kết luận
Mặc dù nghiên cứu của chúng tôi cho thấy vi bào tử trùng E. hepatopenaei thường được phát hiện ở tôm thẻ chân trắng P. vannamei nuôi có biểu hiện WFS, nhưng không có bằng chứng cho thấy ký sinh trùng này có mối liên hệ trực tiếp với WFS. Tuy nhiên, mức độ nhiễm E. hepatopenaei có xu hướng nghiêm trọng hơn do các yếu tố nền liên quan đến WFS. Do vi bào tử trùng này không được ghi nhận trong các đàn tôm SPF của Thái Lan, nhiều khả năng sự nhiễm bệnh trong ao nuôi bắt nguồn từ sự lây truyền từ một hoặc nhiều loài vật chủ tại địa phương. Vì vậy, chiến lược kiểm soát hiệu quả nhất là xác định chính xác các loài vật chủ này và loại trừ chúng khỏi hệ thống sản xuất tôm. Các phương pháp PCR và lai tại chỗ (in situ hybridization) được phát triển trong nghiên cứu này sẽ là công cụ hữu ích trong việc nhận diện các loài vật chủ liên quan.
Theo Amornrat Tangprasittipap, Jiraporn Srisala, Saisunee Chouwdee, Montagan Somboon, Niti Chuchird, Chalor Limsuwan, Thinnarat Srisuvan, Timothy W Flegel và Kallaya Sritunyalucksana
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Các Nhà Nghiên Cứu Khám Phá Protein Đơn Bào Từ Nước Thải Chế Biến Đậu Nành Làm Nguyên Liệu Thức Ăn Thủy Sản
- Phân Tích Bệnh Phân Trắng (WFD) do Vibrio sp. Và Dinoflagellata Ở Tôm Thẻ Chân Trắng (Litopenaeus vannamei) Ở Ao Nuôi Nước Lợ
- Ảnh Hưởng Của Việc Cho Ăn Trong Quá Trình Loại Bỏ Mùi Vị Khó Chịu Đến Sự Bài Tiết Geosmin Ở Cá Rô Phi

 English
English