Kỹ Thuật Nuôi, Tin tức
Phần 2 – BỆNH DO VI BÀO TỬ TRÙNG Enterocytozoon hepatopenaei (EHP) GÂY RA TRÊN TÔM: Sinh thái, Bệnh học, Chẩn đoán và Kiểm soát
3/ Bệnh học EHP:
3.1 Dấu hiệu lâm sàng của nhiễm EHP:
Các dấu hiệu lâm sàng có thể nhìn thấy bên ngoài thường được sử dụng để chẩn đoán giả định nghi ngờ nhiễm trùng trên tôm. Tuy nhiên, trong trường hợp của EHP, các dấu hiệu bên ngoài thường không có, ngoại trừ sự chậm phát triển theo thời gian (Thitamadee và cộng sự, 2016). Ngoài ra mặc dù có ý nghĩa rất lớn, nhưng hệ số cho mối tương quan giữa mức độ nghiêm trọng của việc nhiễm EHP và kích thước rất thấp và được xác định bởi qPCR (Liu và cộng sự, 2018). Chỉ số tốt nhất cho tác động của nó đối với sản xuất là hệ số sự thay đổi về kích thước hoặc trọng lượng tôm trong ao sản xuất. Trong một ao bình thường sẽ nằm trong khoảng 10% hoặc ít hơn. Những ao bị nhiễm nặng sẽ nằm trong khoảng 30% hoặc hơn mà khi thu hoạch sẽ không có lợi nhuận. Ngoài ra, các dấu hiệu mô học của EHP có thể không được giải đáp (Lavanchy và cộng sự, 2016) do các lý do thảo luận dưới đây. Do đó, chúng tôi khuyến cáo thực hiện song song mô học và kỹ thuật phân tử để xác nhận sự hiện diện và mức độ nghiêm trọng của các trường hợp nhiễm EHP.
3.2 Mô bệnh học EHP:
Các đặc điểm mô bệnh học đặc trưng của nhiễm trùng EHP bao gồm sự hiện diện của các giai đoạn sống của nó trong các tế bào biểu mô ống của HP và bào tử tự do đã được giải phóng vào ống lumen HP do bị ly giải hoặc tế bào biểu mô bong tróc. Các đặc tính này có thể được quan sát bằng cách sử dụng kĩ thuật nhuộm H&E (Bell và Lightner, 1988) để kiểm tra sự hiện diện của các giai đoạn đầu ưa bazơ và tăng bạch cầu ái toan (eosinophilic) đối với bào tử ưa bazơ hoặc các bào tử phân tán trong cytoplasm của tế bào biểu mô HP (Tourtip và cộng sự, 2009; Tangprasittipap và cộng sự, 2013; Tang và cộng sự, 2015; Sanguanrut và cộng sự, 2018). Thật không may, giai đoạn đầu và bào tử rất nhỏ và cần sử dụng thấu kính soi dầu. Ngay cả khi đó, chúng cũng không thể dễ dàng phân biệt được từ các hàm lượng tế bào vật chủ thông thường nếu không có các phương pháp nhuộm cụ thể, đặc biệt là ở mức độ nhiễm thấp.
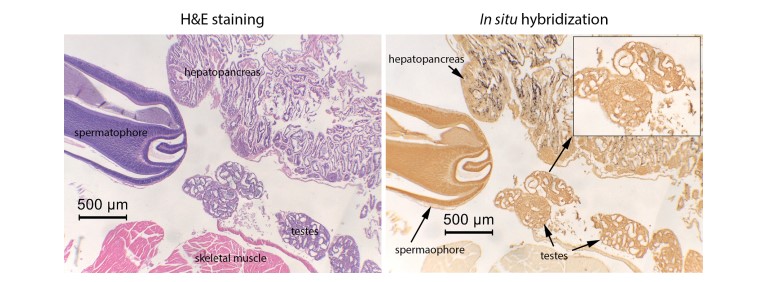
Hình 3. Các kết quả chụp ảnh vi mô của kiểm tra H&E và ISH ở một con tôm đực bị nhiễm EHP cho thấy tinh hoàn không dương tính với EHP theo kiểm tra ISH (tức là, tín hiệu ISH tối) ngay cả khi HP có biểu hiện nhiễm trùng nặng. Kết quả tương tự cũng thu được khi sử dụng tôm cái.
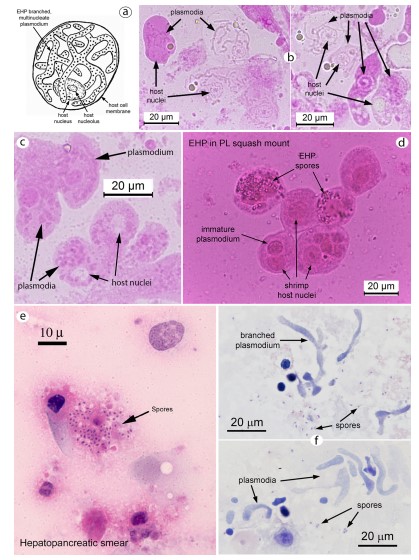
Hình 4. Bào tử và mô tế bào của EHP trong các “vết ép” hoặc “vết phết” của mô HP. Trong phương pháp squash mounts (ép), các tế bào trương lên trong nước cất. (một) Hình minh họa tế bào biểu mô ống HP đơn lẻ cho thấy bản chất phân nhánh của plasmodium EHP trong tế bào chất, bao quanh nhân vật chủ. (b) Hai hình ảnh chụp tế bào vi khuẩn HP được nhuộm màu phloxine B một cách nhẹ nhàng và hiển thị plasmodia phân nhánh và nhân vật chủ. (c) Hình ảnh điện cực đồ cho thấy dày lên plasmodia (phân nhánh khó phân biệt). (d) Chụp ảnh vi khuẩn HP nhuộm H & E cho thấy một cụm bào tử EHP từ một tế bào biểu mô bị vỡ. (e), (f) Hai ảnh chụp vi khuẩn HP nhuộm màu H&E và hiển thị bạch cầu và bào tử EHP.
Để sàng lọc tại chỗ ấu trùng và PL để kiểm tra tình trạng nhiễm EHP nặng bằng phương pháp squash mounts (phương pháp ép tiêu bản), toàn bộ HP (tức là từ PL) hoặc các phần của tôm lớn hơn được cho lên lam kính với 1 giọt nước cất, sau đó nhỏ thêm một giọt dung dịch phloxine B 2%. Xanh Malechite hoặc thuốc nhuộm eosin cũng có thể được sử dụng, hoặc mô có thể được quan sát trực tiếp mà không cần nhuộm. Chọt nhẹ lên mô HP trên lam kính bằng hai kim nhỏ và thêm một tấm lamen, các giai đoạn bào tử và mô tế bào của EHP có thể quan sát được (Hình 4a-d).
Đối với tôm lớn hơn (con non đến con trưởng thành), phương pháp squash mounts cũng có thể được sử dụng, nhưng khả năng phát hiện EHP (và các microsporidians HP khác) có thể được cải thiện bằng cách tạo vết “phết” mô trên các lam kính, sau đó được làm khô và nhuộm bằng H&E bình thường. Nếu có EHP, có thể quan sát thấy các bào tử và plasmodia (Hình 4e – f). Các cấu trúc này cũng đã được mô tả bằng cách sử dụng các phần mô HP được xử lý và nhuộm bằng H&E để phân tích mô học thông thường (Bell và Lightner, 1988) (Hình 5a). Các phần mô bán mỏng (Hình 5b) và siêu mỏng dưới kính hiển vi điện tử (Hình 6) cung cấp xác định chắc chắn về vi bào tử EGM, bao gồm cả EHP (xem Tourtip và cộng sự, 2009). Các phương pháp này cũng có thể tiết lộ các nhóm bệnh khác của HP có thể đi kèm với EHP.
Do khó nhận biết các giai đoạn sống của EHP trong các phần mô H&E, một phương pháp nhuộm chromotrope đặc biệt đã được phát triển để phát hiện bào tử microsporidian (Moura và cộng sự, 1997; Weber và cộng sự, 1992) và nó hoạt động tốt với EHP và các bào tử nổi bật ngay cả với vật kính x40. Tuy nhiên, như thể hiện trong Hình 7, nơi các phần mô liền kề ở độ phóng đại thấp và cao được nhuộm màu bằng cách sử dụng phương pháp chromotrope (cột bên trái) và sử dụng phương pháp ISH (cột bên phải), phương pháp chromotrope có thể đánh giá mức độ của nhiễm trùng nghiêm trọng vì các tế bào HP bị nhiễm mà không có bào tử thì không được xác định.
Do đó, ISH được phát triển để kiểm tra EHP bằng cách sử dụng các đầu dò DNA được đánh dấu DIG cụ thể đối với gen rRNA SSU của nó (Tangprasittipap và cộng sự, 2013; Tang và cộng sự, 2015). Đây được xem là một lựa chọn tốt hơn để ước tính đáng tin cậy mức độ nghiêm trọng của sự lây nhiễm EHP trong các phần mô. Điều đó là do tất cả các giai đoạn phát triển của EHP từ mô thịt giai đoạn đầu và bệnh mô tế bào thần kinh cho đến bệnh mô tế bào gen thể bào, nguyên bào bào tử và bào tử có thể được phát hiện ngay cả khi có mức độ thấp. Vì vậy, nó có tiềm năng cung cấp một mức độ đặc hiệu để bổ sung cho việc kiểm tra bằng mô học tiêu chuẩn. Tuy nhiên, phương pháp ISH tương đối phức tạp nên rất hữu ích cho việc nghiên cứu trên EHP nhưng không phù hợp để sử dụng thực tế trong môi trường trang trại. Để giải quyết vấn đề, các nỗ lực để phát triển các phương pháp đơn giản hơn bằng cách sử dụng phương pháp hóa mô miễn dịch, và đặc biệt là những phương pháp sử dụng các kháng thể đơn dòng.
Tóm lại, vì nhiều lý do khác nhau liên quan đến kích thước rất nhỏ của các giai đoạn EHP, sự phân bố không đồng đều trong HP và các trường hợp thường gặp khi rất ít tế bào bị nhiễm cho thấy sự hiện diện của bào tử, chúng tôi khuyên bạn nên sử dụng các phương pháp phát hiện phân tử nhanh chóng, thân thiện, phù hợp hơn so với các phương pháp mô học để phát hiện EHP thông thường.
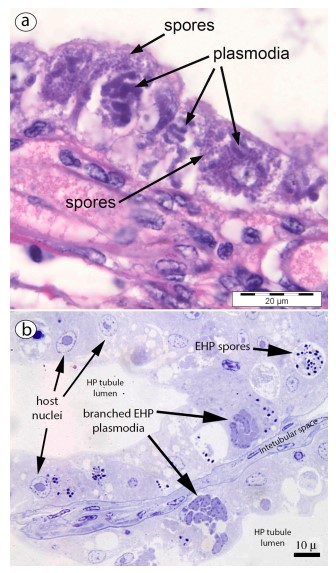
Hình 5. Ảnh chụp của EHP trong các đoạn parafin 4 µm và các phần bán mỏng epoxy (a) Phần parafin nhuộm H & E của mô HP cho thấy các bào tử và plasmodia. (b) Phần bán mỏng nhuộm xanh Toluidine cho thấy bào tử và plasmodia.
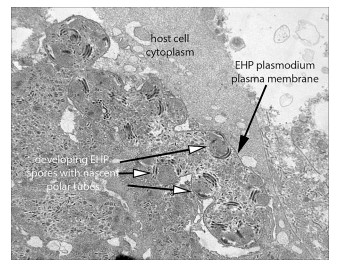
Hình 6. Ảnh chụp qua kính hiển vi điện tử của một phần mỏng HP nhiễm EHP cho thấy giai đoạn phát triển tiền bào tử của một plasmodium chứa nhiều hạt nhân được bao quanh bởi các phần thông qua phân cực dày đặc, sợi phân cực. So sánh các hạt nhân trong plasmodium này với các “dấu chấm” ở mức phóng đại thấp hơn trong plasmodia ở Hình 4b.
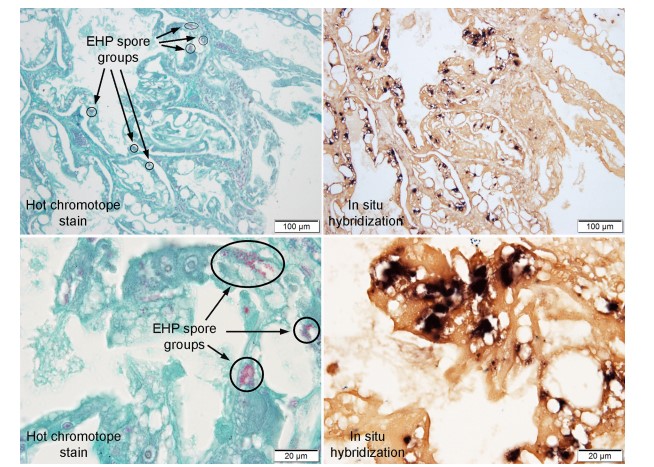
Hình 7. Hình ảnh chụp vi khuẩn của mô HP bị nhiễm EHP được nhuộm bằng phương pháp chromotrope để phát hiện các bào tử EHP tương phản với các phần mô lân cận được nhuộm bằng ISH để tạo điều kiện thuận lợi cho việc phát hiện các tế bào nhiễm EHP cho dù đang sản sinh bào tử hay không. Cột bên trái hiển thị hình ảnh hiển vi độ phóng đại thấp và cao của cùng một phần mô được nhuộm bởi chromotrope, trong khi cột bên phải hiển thị hình ảnh quang vi của các phần mô lân cận, tương tự được nhuộm bởi ISH. Chúng cho thấy rõ ràng rằng ước tính mức độ nghiêm trọng của nhiễm EHP chỉ bằng cách phát hiện bào tử có thể dẫn đến đánh giá thấp. Ba nhóm bào tử bao bọc ở đỉnh của tế bào đầu tiên được nhuộm màu photomicrograph cũng giống như những thứ được khoanh tròn trong photomicrograph ở độ phóng đại cao hơn.
3.3 Mối quan hệ giữa EHP và Hội chứng phân trắng (WFS)
Một số nghiên cứu đã đặt ra câu hỏi về mối liên quan giữa EHP và ‘hội chứng phân trắng’ (WFS). Điều này đề cập đến sự xuất hiện của ruột giữa màu trắng và sự tích tụ của các mảng trắng, các chuỗi phân nổi trong ao nuôi tôm. Tình trạng này đôi khi được quan sát thấy trên tôm nhiễm EHP cả trên ao và hiếm hơn là trong phòng thí nghiệm ở thí nghiệm cảm nhiễm (Ha và cộng sự, 2010; Tangprasittipap và cộng sự, 2013), nhưng cả hai triệu chứng không phải lúc nào cùng xuất hiện đồng thời. Ví dụ, một ao vẫn có thể kiểm tra dương tính với EHP ngay cả sau khi không còn xuất hiện chuỗi phân trắng, cho thấy mối liên hệ giữa EHP và WFS là gián tiếp (Tangprasittipap và cộng sự, 2013).
Ngược lại, có những ao không có EHP thể hiện các mảng màu trắng, các chuỗi phân nổi lên có chứa cấu trúc vermiform được gọi là vi nhung mao biến đổi tổng hợp (ATM) (Sriurair atana và cộng sự, 2014). Hơn nữa, người ta biết rằng tôm có thể có phân trắng do các nguyên nhân khác như bị nhiễm trùng gregarine nặng, nhiễm khuẩn Vibrio và bệnh HE. Kết quả là, việc quan sát phân trắng trong các hệ thống ao nuôi không thể được coi là một dấu hiệu của nhiễm EHP. Kiểm tra bằng kính hiển vi để tìm sự hiện diện của bào tử EHP trong các sợi phân trắng có thể giúp phân biệt giữa EHP và ATM hoặc nhiễm trùng gregarine. Nếu không có những điều này, phân tích mô học của các phần mô nên được thực hiện để kiểm tra vi khuẩn Vibrio và HE.
Vì mối quan hệ giữa EHP và WFS dường như không giống nhau và các trường hợp nhiễm EHP nặng thường đi kèm với sự sinh sôi của vi khuẩn, người ta đã đề xuất rằng sự hiện diện của các vi khuẩn có thể kích hoạt WFS ở tôm bị nhiễm bệnh nặng. Ví dụ, một nghiên cứu siêu vi khuẩn gần đây trên tôm WFS đã cho thấy các loại vi khuẩn chưa được báo cáo trước đây ngoài EHP (Hou và cộng sự, 2018). Bao gồm các vi khuẩn kỵ khí mà trước đây có thể được phát hiện do kĩ thuật bình thường bằng cách sử dụng các điều kiện hiếu khí để phân lập vi khuẩn từ tôm bị nhiễm bệnh.
Khi xem xét cơ chế cơ bản có thể có, nhờ đó vi khuẩn có thể kích hoạt WFS, chúng ta cần xem xét các trường hợp nhiễm EHP nghiêm trọng thường không đặc trưng bởi số lượng lớn, sự sản xuất bào tử bởi plasmodia EHP trong HP (tức là số lượng của plasmodia tích cực sản xuất bào tử tại bất kỳ thời điểm thường là tương đối nhỏ). Mặt khác, tôm WFS thường chứa một lượng lớn plasmodia sản sinh bào tử và biểu hiện bong tróc biểu mô ống HP đáng kể (Hình 8). Dựa trên những quan sát này, chúng tôi giả thuyết rằng một đơn vị phân loại vi khuẩn cụ thể (hoặc ‘Bệnh lý – pathobiome’, xem Bass và cộng sự 2019) có khả năng kích hoạt sản xuất bào tử bằng một số lượng lớn các plasmodia, dẫn đến giải phóng số lượng lớn các bào tử kèm theo các mảnh vỡ tế bào bị tách ra và bởi sự phát triển của vi khuẩn nặng, biểu hiện rõ ràng trong phương pháp squash mount có các sợi phân trắng hoặc ruột giữa trắng của tôm WFS (Hình 9).
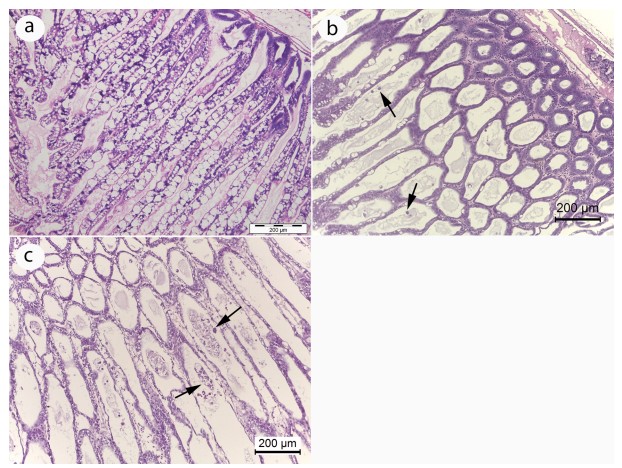
Hình 8. Hình ảnh chụp ảnh bình thường đối lập với mô HP bị nhiễm EHP nặng từ một ao nuôi tôm có WFS. (a) Mô HP bình thường (b) Mô HP cho thấy biểu mô ống HP mỏng vừa phải và một số tế bào bong ra (mũi tên) trong lòng ống. (c) Mô HP với ống lượn mỏng nghiêm trọng biểu mô và số lượng lớn hơn các tế bào bong tróc trong lòng ống (mũi tên).
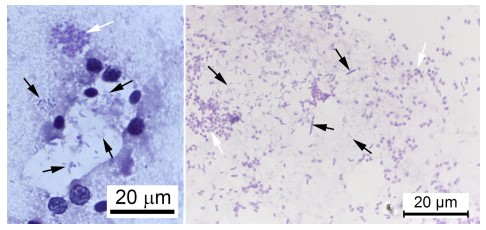
Hình 9. Hình ảnh chụp vết phết của tế bào HP và các sợi phân trắng từ tôm WFS cho thấy các bào tử EHP với các vi khuẩn hỗn hợp. (a) mô HP được phết cho thấy bào tử EHP (mũi tên trắng) cùng với vi khuẩn có hình thái hỗn hợp (mũi tên đen). (b) vết phết phân trắng từ ruột giữa cho thấy có bào tử EHP (mũi tên trắng) cùng với vi khuẩn có hình thái hỗn hợp (mũi tên đen).
Nhóm tác giả: Thawatchai Chaijarasphong a,b, Natthinee Munkongwongsiri c, Grant D. Stentiford d,e, Diva J. Aldama-Cano a,c, Kwanta Thansa c, Timothy W. Flegel a,f, Kallaya Sritunyalucksana c, Ornchuma Itsathitphaisarn a,g,*
Biên dịch: Thùy Linh – Công ty TNHH PTTS Bình Minh
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Phần 1 – BIỂU HIỆN LÂM SÀNG CỦA HỘI CHỨNG PHÂN TRẮNG White feces syndrome (WFS) VÀ MỐI LIÊN QUAN CỦA NÓ VỚI VI BÀO TỬ TRÙNG Enterocytozoon hepatopenaei (EHP) TRONG CÁC TRANG TRẠI NUÔI TÔM THẺ CHÂN TRẮNG THƯƠNG PHẨM: MỘT CUỘC ĐIỀU TRA BỆNH HỌC
- (Phần 1) Biofilm Và Các Biện Pháp Kiểm Soát Chúng
- Tiềm Năng Của Nghề Nuôi Tôm Hùm Gai Châu Âu Có Thể Giúp Khôi Phục Ngành Thủy Sản

 English
English