Kỹ Thuật Nuôi, Tin tức
Hoạt Tính Sinh Học Của Bột Ấu Trùng Ruồi Lính Đen
Xác định khả năng kháng viêm và sinh miễn dịch trong thử nghiệm in vitro

Các tác giả đã sử dụng các thử nghiệm in vitro (trong ống nghiệm) dựa trên tế bào để so sánh khả năng sinh miễn dịch và kháng viêm của bột ruồi lính đen nguyên con và ép đùn so với bột cá, bột dế và quercetin (một chất kháng viêm có nguồn gốc từ thực vật). Hình ảnh ấu trùng 14 ngày tuổi.
Việc sử dụng bột côn trùng, chủ yếu có nguồn gốc từ ấu trùng của ruồi lính đen (BSF, Hermetia illucens) để làm nguyên liệu thức ăn thủy sản đang được nghiên cứu trong khi ngành thức ăn thủy sản đang ngày càng được áp dụng. Hầu hết các nghiên cứu đều tập trung vào tiềm năng của bột côn trùng như một thành phần protein thay thế cho một số loài cá – bao gồm cá hồi vân, cá hồi, cá chép, cá vược và cá da trơn – nhưng chỉ có một số nghiên cứu điều tra về lợi ích miễn dịch của bột côn trùng.
Ở đây chúng tôi trình bày kết quả của một dự án với mục đích nghiên cứu khả năng sinh miễn dịch (hoặc tiền viêm) và kháng viêm trong thử nghiệm in vitro đối với bột hữu cơ ruồi lính đen so với các nguyên liệu thương mại sẵn có khác.
Thiết lập nghiên cứu
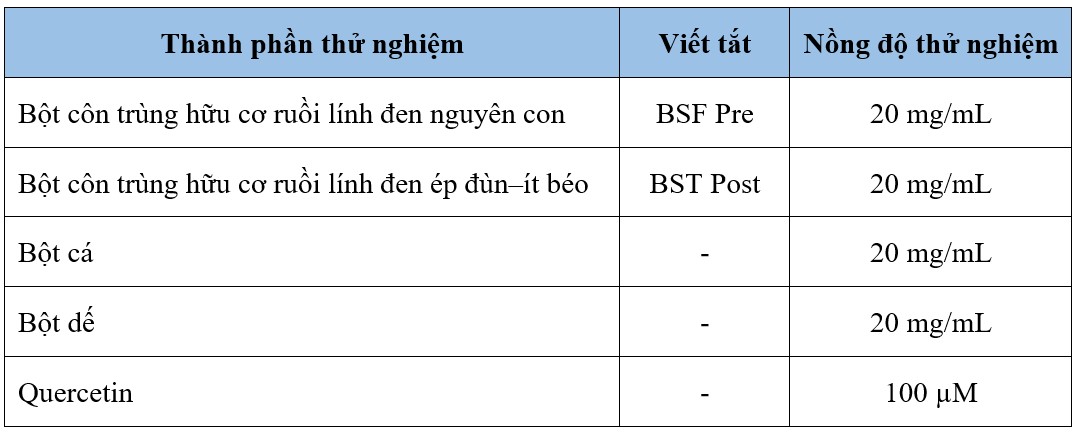
Thành phần thử nghiệm
Các thành phần được nghiên cứu trong suốt dự án này được mô tả trong Bảng 1. Tất cả các mẫu được hòa tan trong nước, trộn ở nhiệt độ phòng trong 1 giờ và ly tâm để tách vật liệu hòa tan (nổi trên bề mặt) khỏi vật liệu (dạng viên) không hòa tan. Phần nổi phía trên, chứa các thành phần hòa tan, được lọc 0,22 µm và bảo quản ở -20°C cho đến khi cần dùng cho các xét nghiệm tế bào.
Bảng 1. Các mẫu nghiên cứu in vitro.
Xét nghiệm dựa trên tế bào
Mô hình đại thực bào RAW264.7 được nuôi cấy trong ống nghiệm để tạo ra oxit nitric (NO), một phân tử tín hiệu đóng vai trò quan trọng trong việc phát hiện tình trạng viêm. Kích thích sản xuất NO đại diện cho các phản ứng miễn dịch hoặc tiền viêm, trong khi giảm sản xuất NO cho thấy hoạt động kháng viêm. Mô hình đại thực bào RAW264.7 được nuôi cấy để tạo ra hai thử nghiệm dựa trên hai tế bào khác nhau.
Khả năng miễn dịch (tiền viêm) trong thử nghiệm in vitro

Quá trình chế biến ấu trùng ruồi lính đen thành bột.
Các tế bào được xử lý bằng lipopolysacarit vi khuẩn (LPS) hoặc các thành phần thử nghiệm để kích thích sản xuất NO và quan sát bất kỳ phản ứng sinh miễn dịch (hoặc tiền viêm) nào. Để đảm bảo rằng không xảy ra độc tính (có thể dẫn đến kết quả dương tính giả), khả năng sống của tế bào được xét nghiệm để phản ứng với tất cả các mẫu của dự án và nằm trong khoảng từ 106–124 % (được biểu thị bằng phần trăm so với các tế bào không được xử lý).
Các phương pháp đã được thực hiện bao gồm:
- 7 tế bào được nuôi cấy trong bình và duy trì ở 37°C với 5% CO2 trong môi trường tăng trưởng (DMEM, 10% huyết thanh bào thai bò).
- Các tế bào được nuôi cấy cho đến khi hợp lại khoảng 90% trước khi được thu thập và đếm.
- 6×105 7 tế bào/mL được mạ vào các đĩa 96 giếng trong suốt và nuôi cấy trong 2 ngày với sự có mặt của dịch chiết nước được chuẩn bị từ các mẫu thử (xem Bảng 1) và pha loãng trong môi trường tăng trưởng.
- Sau 2 ngày, môi trường nuôi cấy tế bào được chuyển sang các đĩa 96 giếng màu đen để sản xuất nitrit (tức là phát hiện oxit nitric) bằng cách sử dụng DAN (2,3-Diaminonaphtaline).
- Sau 10 phút, đo huỳnh quang (Ex 360 nm; Em 430 nm) và vẽ đồ thị theo đường chuẩn nitrit.
- Kết quả được ngoại suy thêm bằng cách sử dụng đường chuẩn sản xuất LPS-nitrit.
- Các tế bào còn lại trong các đĩa trong suốt được rửa sạch trước khi đo khả năng sống của tế bào ở bước sóng 490nm bằng cách sử dụng xét nghiệm tăng sinh tế bào CellTiter96 Aqueous One Solution (Promega).
Khả năng kháng viêm trong thử nghiệm in vitro
Trong thử nghiệm này, các tế bào được xử lý đồng thời với LPS (để sản xuất NO) và một mẫu thử nghiệm để xác định xem có mẫu nào có thể ức chế sản xuất NO phù hợp với hoạt động kháng viêm hay không. Hoạt động kháng viêm được so sánh với hoạt động của quercetin tinh khiết (một phytosterol có nguồn gốc từ thực vật) và các hợp chất kháng viêm đã biết khác. Một lần nữa, để đảm bảo rằng không có bất kỳ nghiệm thức nào liên quan đến độc tính, khả năng sống của tế bào được đo trong xét nghiệm để phản ứng với tất cả các mẫu của dự án và nằm trong khoảng từ 70–85% (được biểu thị bằng phần trăm so với các tế bào không được xử lý).
Các phương pháp sau đây đã được thực hiện:
- 7 tế bào được nuôi cấy trong bình và duy trì ở 37°C với 5% CO2 trong môi trường tăng trưởng (DMEM, 10% huyết thanh bào thai bò).
- Các tế bào được nuôi cấy cho đến khi hợp lại khoảng 90% trước khi được thu thập và đếm.
- 6×105 7 tế bào/mL được mạ vào các đĩa 96 giếng trong suốt và nuôi cấy trong 2 ngày với sự có mặt của dịch chiết nước được chuẩn bị từ các mẫu dự án (xem Bảng 1) và LPS được pha loãng trong môi trường tăng trưởng.
- Sau 2 ngày, môi trường nuôi cấy tế bào được chuyển sang các đĩa 96 giếng màu đen để sản xuất nitrit (tức là phát hiện oxit nitric) bằng cách sử dụng DAN (2,3-Diaminonaphtaline).
- Sau 10 phút, đo huỳnh quang (Ex 360 nm; Em 430 nm) và vẽ đồ thị theo đường chuẩn nitrit.
- Kết quả được ngoại suy thêm bằng cách sử dụng đường chuẩn sản xuất LPS-nitrit và được so sánh với đáp ứng liều quercetin.
- Các tế bào còn lại trong các đĩa trong suốt được rửa sạch trước khi đo khả năng sống của tế bào ở bước sóng 490nm bằng cách sử dụng Xét nghiệm tăng sinh tế bào CellTiter96 Aqueous One Solution (Promega).
Phân tích thống kê
Phân tích sự khác biệt đáng kể bằng cách sử dụng phân tích phương sai một chiều (ANOVA), sau đó là phương pháp so sánh của Tukey hoặc Dunnett. Trước khi phân tích, các giả định ANOVA về tính quy tắc của phần dư và tính đồng nhất của phương sai đã được kiểm tra bằng cách sử dụng các phép thử Shapiro-Wilk và Levene tương ứng. Sự khác biệt được coi là đáng kể khi P <0,05. Tất cả các phân tích thống kê được thực hiện bằng phần mềm GraphPad Prism 9.
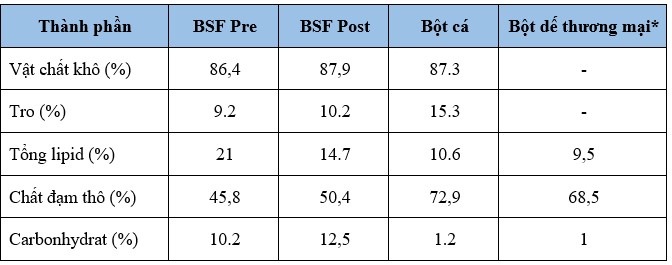
Thành phần hóa học của các thành phần thử nghiệm

Ấu trùng BSF và bột ấu trùng.
Tất cả các thành phần thức ăn thủy sản trong thử nghiệm, ngoại trừ bột dế thương mại, đã được nhân viên CSIRO phân tích bằng những phương pháp tốt nhất được thiết lập tại Phòng thí nghiệm Phân tích Khu vực Khoa học Sinh học Queensland. Thành phần bột dế do nhà cung cấp cung cấp. Các phân tích dựa trên Hiệp hội các nhà hóa học nông nghiệp chính thức (AOAC, 2016).
Hàm lượng vật chất khô được xác định bằng phân tích khối lượng sau khi sấy khô ở 105°C trong 16 giờ. Hàm lượng tro được xác định dựa trên sự thay đổi khối lượng sau khi đốt trong lò múp (1521CAF Ashing Furnace, S.E.M Equipment, Australia) ở 550°C trong 16 giờ. Tổng lipid được chiết xuất theo phương pháp được đề xuất bởi Folch và cộng sự (1957) và được sử dụng để xác định hàm lượng lipid thô. Tổng hàm lượng nitơ (N) được đo bằng máy phân tích nguyên tố hữu cơ CHNS/O (Thermo Fisher Scientific, Waltham, Mass., Hoa Kỳ) và được sử dụng để tính hàm lượng protein thô của mẫu dựa trên N x 6,25. Hàm lượng carbohydrate được tính bằng sự khác biệt. Thành phần hóa học của các mẫu khác nhau được thể hiện trong Bảng 2.
Kết quả và thảo luận
Dựa trên những phát hiện trong thử nghiệm in vitro từ nghiên cứu này, ấu trùng BSF chứa các phân tử sinh miễn dịch, có khả năng điều chỉnh khả năng miễn dịch trong cơ thể, và các phân tử kháng viêm có thể làm giảm phản ứng viêm trong cơ thể. Các phát hiện từ dự án này cho thấy rằng các sản phẩm hữu cơ BSF có thể được sử dụng làm phụ gia chức năng cho thức ăn thủy sản, và việc tinh chế thành phần hóa học của các sản phẩm hữu cơ BSF có thể cải thiện giá trị của nó như một nguồn protein thay thế, tùy thuộc vào các loài nuôi trồng thủy sản mục tiêu.
Khả năng sinh miễn dịch (hoặc tiền viêm) trong thử nghiệm in vitro
Khả năng sinh miễn dịch (hoặc gây viêm) (được biểu thị bằng ng LPS tương đương trên mỗi gam nguyên liệu ban đầu) được thể hiện trong Hình 1 và cao hơn đáng kể trong các mẫu BSF Pre và BSF Post so với các thành phần thử nghiệm khác. Hơn nữa, BSF Post thể hiện khả năng sinh miễn dịch cao hơn đáng kể so với BSF Pre.
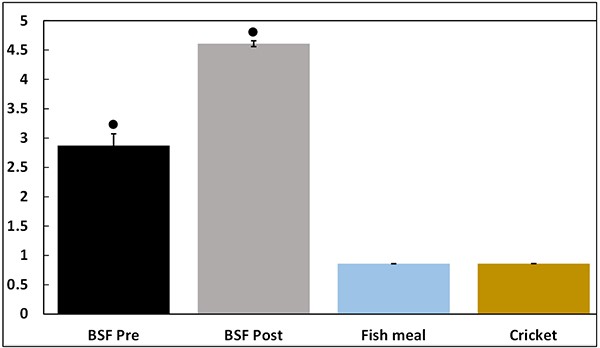
Hình 1: Khả năng sinh miễn dịch (hoặc tiền viêm) trong thử nghiệm in vitro đối với tế bào RAW264.7 (được biểu thị bằng đương lượng lipopolysacarit trong một gam nguyên liệu ban đầu).
Dấu * biểu thị sự khác biệt đáng kể so với bột dế bằng cách sử dụng phân tích phương sai một chiều, sau đó là thử nghiệm so sánh của Tukey.
Các nghiên cứu in vivo gần đây đã khám phá khả năng sinh miễn dịch của việc bổ sung ấu trùng BSF vào thức ăn chăn nuôi (các tài liệu tham khảo có sẵn từ tác giả tương ứng) và quan sát thấy tác động tích cực đến sự tăng trưởng, sức khỏe đường ruột và phản ứng miễn dịch. Các nghiên cứu in vitro gần đây cũng đã điều tra khả năng sinh miễn dịch của ấu trùng BSF. Ví dụ, Ali và cộng sự đã khám phá ra các tế bào RAW264.7 đã sản xuất ra NO để phản ứng với chiết xuất ấu trùng BSF và một loại polysacarit hoạt tính sinh học mới (có tên là dipterose-BSF) được tinh chế từ chiết xuất ấu trùng BSF. Dipterose-BSF thậm chí còn kích thích sản xuất NO tương tự như LPS. Do đó, những phát hiện được công bố này ủng hộ các kết quả từ nghiên cứu hiện tại và gợi ý rằng bột hoặc chất chiết xuất từ ấu trùng ruồi lính đen có thể cải thiện sức khỏe động vật thông qua điều hòa miễn dịch khi được đưa vào chế độ ăn.
Trong nghiên cứu hiện tại, BSF Pre và BSF Post thể hiện hoạt tính sinh miễn dịch cao hơn so với bột dế và bột cá. Hơn nữa, BSF Post đã sản xuất NO nhiều hơn đáng kể so với BSF Pre, cho thấy rằng việc ép đùn có thể cải thiện khả năng sinh miễn dịch của BSF. Điều này có thể là do sự phong phú của các phân tử sinh miễn dịch hoặc khả năng hòa tan được cải thiện sau khi ép đùn. Quá trình xử lý bổ sung có thể cải thiện nhiều hơn nữa khả năng sinh miễn dịch của BSF Post. Mặc dù người ta có thể suy đoán rằng đặc tính gây viêm của BSF có thể khiến tỷ lệ bổ sung cao trở nên thấp hơn, đặc biệt nếu hệ thống miễn dịch bị kích thích quá mức, nhưng tài liệu hiện tại cho thấy không có sự suy yếu nào trong bối cảnh này (như được mô tả bên dưới).
Khả năng kháng viêm trong thử nghiệm in vitro
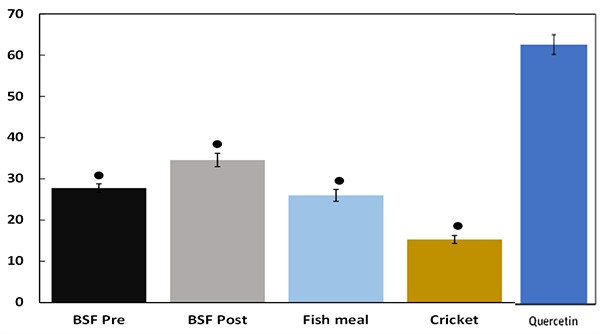
Hình 2: Khả năng kháng viêm trong thử nghiệm in vitro khi ức chế (phần trăm) sản xuất oxit nitric trong tế bào RAW264.7. Biểu thị sự khác biệt thống kê đáng kể so với quercetin bằng cách sử dụng phân tích phương sai một chiều, sau đó là thử nghiệm so sánh của Tukey.
Khả năng kháng viêm (được biểu thị bằng phần trăm ức chế sản xuất NO) được thể hiện trong Hình 2 và phản ứng tương tự với các mẫu BSF Pre, BSF Post và bột cá. So với điều trị tế bào bằng quercetin (một phân tử kháng viêm có nguồn gốc từ thực vật), khả năng kháng viêm thấp hơn đáng kể khi phản ứng với BSF Pre, BSF Post, bột cá và bột dế. Tuy nhiên, các mẫu BSF Pre và BSF Post thể hiện hoạt tính kháng viêm cao hơn đáng kể so với bột dế.
Một nghiên cứu in vivo gần đây đã khám phá tác động của việc bổ sung BSF trong thức ăn thủy sản ở cá hồi vân, cho thấy bằng chứng giảm viêm ruột, đặc biệt khi bổ sung chế độ ăn dựa trên đậu nành được biết là gây viêm và giảm tính toàn vẹn của hàng rào ruột. Trong nghiên cứu hiện tại, khả năng kháng viêm tương tự như phản ứng với BSF Pre, BSF Post và các mẫu bột cá, đồng thời thấp hơn đáng kể so với phản ứng của tế bào đối với quercetin. Tuy nhiên, các mẫu BSF Pre và BSF Post thể hiện hoạt tính kháng viêm cao hơn đáng kể so với bột dế.
Thành phần hóa học
Thành phần hóa học của bột hữu cơ BSF làm cho chúng trở thành thành phần mong muốn đối với thức ăn thủy sản và nằm trong phạm vi được báo cáo trong tài liệu. Những sản phẩm này rất giàu protein, chứa hàm lượng tro và carbohydrate tương đối thấp so với các nguồn protein thay thế khác. Việc giảm hàm lượng lipid trong các bột BSF nên được xem xét để giúp đạt được giá trị dinh dưỡng tốt hơn cho thị trường thức ăn thủy sản (ví dụ: mức lipid trong khoảng 5–12% tùy thuộc vào các loài nuôi trồng thủy sản mục tiêu). Do đó, mức lipid thấp hơn trong bột BSF sẽ làm tăng hàm lượng protein và carbohydrate, có khả năng làm tăng khả năng sinh miễn dịch và kháng viêm, như được thảo luận dưới đây.
Bảng 2. Thành phần hóa học của các nguyên liệu thức ăn thủy sản trong thử nghiệm (tính theo vật chất khô).
* Thành phần mẫu được cung cấp kèm theo mẫu.
Kết luận cuối cùng
Bột côn trùng hữu cơ BSF có chứa các phân tử sinh miễn dịch tiền viêm và sản xuất NO cao hơn đáng kể so với bột cá và bột dế. Đáng chú ý, ép đùn đã cải thiện đáng kể khả năng sinh miễn dịch của bột côn trùng hữu cơ BSF lên đến 60%. Bột hữu cơ BSF dường như phù hợp làm nguyên liệu và có thể có các đặc tính chức năng phù hợp đối với thức ăn thủy sản. Tối ưu hóa thành phần của bột BSF, đặc biệt là bằng cách khử chất béo để tăng hàm lượng protein, được khuyến nghị để tinh chế sản phẩm này cho nhu cầu dinh dưỡng của các loài nuôi trồng thủy sản ăn thịt.
Các nghiên cứu in vitro sâu hơn có thể khám phá các kỹ thuật chế biến khác nhau và kiểm tra các thành phần dinh dưỡng đa lượng khác nhau giúp tăng cường tốt nhất khả năng sinh miễn dịch của bột côn trùng hữu cơ BSF. Các nghiên cứu trên động vật cũng có thể được xem xét để điều tra tiềm năng của bột côn trùng hữu cơ BSF ở các tỷ lệ bổ sung khác nhau (phụ gia chức năng <10%; nguồn protein 10–40%) để cải thiện sức khỏe đường ruột, giảm mức độ nghiêm trọng của các bệnh do vi khuẩn/virus, và được sử dụng như một nguồn protein thay thế hiệu quả về mặt thương mại.
Theo Tiến sĩ Artur Rombenso, Anca Rusu, Andrew Porter, Nicholas Bourne, Tiến sĩ Ha Truong, Tiến sĩ Cedric Simon, và Tiến sĩ Simone Osborne.
Nguồn: https://www.globalseafood.org/advocate/bioactivity-of-black-soldier-fly-larvae-meal/
Biên dịch: Huyền Thoại – Bình Minh Capital
Xem thêm:
- Axit béo trong thức ăn cải thiện tăng trưởng và thành phần lipid của tôm thẻ chân trắng khi nuôi ở độ mặn cao
- Bằng chứng quan trọng tác động đến lợi nhuận
- Sơ Lược Về Hệ Thống Nuôi Tôm Trong Nhà

 English
English