Kỹ Thuật Nuôi, Tin tức
Phần 2: Hướng dẫn nuôi sinh khối Rotifer
CHƯƠNG 3
DINH DƯỠNG VÀ STRESS CỦA ROTIFER
Chế độ ăn quyết định luân trùng
Luân trùng Brachionid là loài ăn lọc với kích thước miệng cho phép chúng ăn các hạt 5-10 µM. Luân trùng đã tiến hóa qua hàng triệu năm nhờ chế độ ăn bao gồm nhiều loại vi tảo, vi khuẩn và mảnh vụn. Những kẻ săn mồi ăn luân trùng cũng được hưởng lợi từ nguồn dinh dưỡng đa dạng và vi lượng có trong cơ thể chúng.
Trong chương này chúng tôi trình bày hai giao thức vận hành tiêu chuẩn. Một quy trình sử dụng tảo bổ sung Amplifeed(tm) Replete Rotifer và Artemia Feed và quy trình thứ hai chỉ sử dụng Amplifeed Replete. Chúng tôi sẽ mô tả Amplifeed Replete và giải thích động lực phát triển thức ăn luân trùng của riêng chúng tôi.
Chúng tôi cũng sẽ đề cập đến mật độ nuôi luân trùng tối ưu mà nếu vượt quá sẽ gây ra căng thẳng làm ảnh hưởng đến sức khỏe, khả năng sinh sản và sự ổn định cũng như giá trị dinh dưỡng của chúng đối với ấu trùng cá.
Khi mới thành lập, chúng tôi đã hợp tác với một đơn vị hàng đầu trong ngành nuôi luân trùng được tất cả mọi người biết đến. Họ bán cho chúng tôi lò phản ứng sinh học, luân trùng sống và bột tảo để nuôi luân trùng.
Tuy nhiên, chúng tôi đã trải qua những sự cố liên tục trong quá trình nuôi luân trùng dẫn đến tỷ lệ chết của ấu trùng cao.
Cuối cùng, chúng tôi đã phát hiện ra ba vấn đề khi sử dụng thức ăn dạng bột tảo: 90% thức ăn quá lớn khiến luân trùng không thể ăn được, bột tảo kết tụ và làm tắc nghẽn bộ lọc thoát ra và bột tảo thiếu vi chất dinh dưỡng quan trọng đối với sức khỏe của luân trùng và những “kẻ săn mồi” ăn chúng.
Chúng tôi bắt đầu Chương 1 với cụm từ “cắn những gì bạn có thể nhai”. Sau một vụ tai nạn khác, chúng tôi tự hỏi liệu luân trùng chết vì chất lượng nước hay do một nguyên nhân nào khác, chẳng hạn như “chết đói”. Các tác giả của hướng dẫn này có quyền truy cập vào phòng thí nghiệm gốm sứ được trang bị để đo kích thước hạt từ micron đến <100 nanomet. Chúng tôi sử dụng phòng thí nghiệm để đo sự phân bổ kích thước hạt của thức ăn làm từ tảo. Hơn 90% các hạt có kích thước trên 10 µM, 80% trên 20 µM và nhiều hạt có kích thước trên 50 µM.
Chúng tôi choáng váng.
90% lượng tảo mà chúng tôi thêm vào đang nuôi dưỡng thứ gì đó không phải luân trùng, có thể là vi khuẩn và sự bùng nổ trong hoạt động trao đổi chất đã tạo ra amoniac gây độc cho luân trùng. Luân trùng của chúng tôi bị bỏ đói và chết vì ngộ độc amoniac.
Quan sát tiếp theo rất đơn giản. Sàng 50 µM của hệ thống dòng chảy của chúng tôi (Chương 2 “múc ra”) đã bị liên tục tắc nghẽn và kích thước hạt lớn cộng với xu hướng tảo kết tụ lại theo thời gian là nguyên nhân gây ra.
Chúng tôi ném hỗn hợp tảo vào đống phân trộn, xây một căn phòng sạch sẽ và bắt đầu nuôi tảo sống. Tảo sống đã cải thiện năng suất của chúng tôi nhưng vẫn không đạt được gần 99%.

Chúng tôi nghi ngờ mình vẫn gặp vấn đề về dinh dưỡng. Những động vật ăn luân trùng được nuôi bằng chế độ ăn chỉ có tảo vẫn biểu hiện các khuyết tật và chết. Tetraselmis hoặc Tetraselmis cộng với Isochrysis hoạt động tốt nhất nhưng chúng tôi vẫn chưa đạt được mục tiêu năng suất 99%.
Luân trùng hoang dã ăn các loại vi tảo, vi khuẩn và mảnh vụn. Cho luân trùng ăn chế độ ăn chỉ có một loài tảo sẽ hạn chế sự phát triển và sinh sản của chúng. Những động vật ăn luân trùng theo chế độ ăn này đã không tiêu thụ đầy đủ các vi chất dinh dưỡng mà chúng cần để sinh trưởng và phát triển hợp lý.
Chúng tôi đã phát triển Amplifeed(tm) Replete để giải quyết các vấn đề về dinh dưỡng, sinh khả dụng và tránh tắc nghẽn trong việc sử dụng tảo sống hoặc thức ăn dạng bột tảo.
Thức ăn luân trùng và Artemia Amplifeed(tm) Replete

Nhiệt độ là kẻ thù của nhiều vi chất dinh dưỡng và axit béo. Hầu hết thức ăn dành cho trại giống thương mại đều được ép đùn hoặc nấu chín ở nhiệt độ làm mất đi giá trị dinh dưỡng bên trong chúng. Chúng tôi bắt đầu với chất nền được xử lý ở nhiệt độ thấp chứa nhiều loại tảo khô, protein biển và men bia. Sau đó, chúng tôi phủ lên vật liệu đó bằng Amplifeed Topcoat (Chương 4). Vật liệu này được nghiền thành bột trong môi trường không có oxy ở nhiệt độ thấp đến kích thước <10 micron. Amplifeed Replete có sinh khả dụng đối với luân trùng trong cột nước ít nhất 6 giờ.
https://snextracts.com/collections/for-rotifers-and-artemia/products/amplifeedtm-replete- rotifer-and-artemia-feed-1kg
Luân trùng được cho ăn Amplifeed Replete bơi nhanh hơn và sinh sản nhiều hơn. Động vật ăn luân trùng này phát triển nhanh hơn và có hệ thống miễn dịch mạnh hơn, dẫn đến tỷ lệ sống của ấu trùng tăng lên. Luân trùng cũng có màu sắc đậm hơn giúp động vật săn mồi dễ dàng nhìn thấy và bắt mồi hơn.
Nhiều ví dụ trong hướng dẫn này sử dụng chủng Brachionus manjavacas Nga để minh họa. Đối với loài luân trùng này, chúng tôi khuyên bạn nên cho ăn 0,25 gam Amplifeed Replete trên một triệu luân trùng mỗi ngày. Bạn có thể chọn điều chỉnh lượng thức ăn tăng hoặc giảm dựa trên kích thước tương đối của loài luân trùng của bạn so với B. manjavacas.
Đây là cách thực hiện phép tính.
Luân trùng có hình dạng gần như hình trụ. Thể tích của hình trụ = 3,1459 * Bán kính * Bán kính * Chiều cao.
Đối với luân trùng:
Chiều cao = Chiều dài Bán kính= Chiều rộng /2
Sử dụng các bảng ở chương 1
Kích thước trưởng thành của chủng Brachionus manjavacas-Nga là Chiều dài = 254 µm
Chiều rộng = 202 µm
Vậy Thể tích= 8,151,197 µm3
Đối với chủng Brachionus rotundiformis – Italy, luân trùng trưởng thành là Chiều dài = 137 µm
Chiều rộng = 133 µm
và Thể tích= 1,905,938 µm3
Tỷ lệ thức ăn cho B. manjavacas là 0,25 gram/triệu.
Tỷ lệ thức ăn cho B. rotundiformis = 0,25 gam/triệu lần thể tích tương đối của B. rotundiformis so với B. manjavacas hoặc 0,06 gam/triệu.
Muốn bằng chứng?
Đây là hình ảnh một đàn cá hề ở ở giai đoạn 14 ngày sau thụ tinh (PH), được cho ăn luân trùng ăn Tetraselmis.

Và đây là một nhóm cá hề ở giai đoạn 14 ngày sau thụ tinh (PH), được cho ăn luân trùng được cho ăn Amplifeed(tm) Replete trong hai ngày trước khi thu hoạch.

Muốn có thêm bằng chứng? Hãy đến thăm trại giống của chúng tôi và đi dạo xung quanh vào buổi sáng. Chúng tôi có 300 nghìn động vật và sẽ mời bạn bữa sáng nếu bạn tìm thấy một con cá chết.
Mật độ luân trùng
Mật độ nuôi luân trùng khỏe mạnh tối ưu là bao nhiêu?
Mật độ dày và căng thẳng là những yếu tố được biết đến rộng rãi trong nuôi cá, tuy nhiên tài liệu về stress ở luân trùng vẫn còn hạn chế.
Ước tính mật độ luân trùng trong môi trường nuôi cấy
- Đảo trộn kỹ môi trường nuôi cấy để luân trùng phân bố đều
- Loại bỏ bốn mẫu lặp lại bằng micro Thể tích mẫu phụ thuộc vào mật độ luân trùng: 250 µL cho 10-50 luân trùng/ml, 100 µL cho 50-200 luân trùng/ml, 50 µL cho 200-500 luân trùng/ml, 10 µL cho >500 luân trùng/ml.
- Quan sát từng mẫu sao chép dưới kính hiển vi ở độ phóng đại 10-20X, đếm số lượng luân trùng bơi trong mỗi mẫu.
- Tính số lượng luân trùng trung bình trong mỗi mẫu và nhân với giá trị thích hợp để thu được số lượng luân trùng trong mỗi ml.
- Việc quan sát và lập biểu đồ mật độ luân trùng mỗi ngày sẽ cung cấp dữ liệu về sức khỏe của quần thể luân trùng và mức sản lượng dự kiến trong vài ngày tới.
Chương 2 cung cấp các quy trình nhằm tăng cường chất lượng nước và nhiệt độ có thể là nguyên nhân gây căng thẳng. Ở trên chúng tôi đã cung cấp các quy trình để loại bỏ căng thẳng về dinh dưỡng.
Phần này đề cập đến mật độ luân trùng và căng thẳng về mật độ dày đi kèm với mật độ quần thể cao hơn.
Căng thẳng do mật độ dày là kết quả của việc một con luân trùng va chạm với một con luân trùng khác khi nó tìm kiếm thức ăn. Khi mật độ quần thể tăng lên thì xác suất va chạm cũng tăng theo. Ngoài ra, khi luân trùng chuyển hóa thức ăn, chúng bài tiết amoniac dưới dạng chất thải. Nếu chất thải tích tụ trong môi trường thì nồng độ amoniac ngày càng tăng cũng gây ra phản ứng căng thẳng.
Một loài động vật có xương sống “điển hình” giải phóng hormone cortisol để phản ứng lại tình trạng căng thẳng do mật độ dày. Chúng tôi đã tìm kiếm tài liệu và không thể tìm thấy tài liệu tham khảo trực tiếp nào về việc liệu cortisol có trong luân trùng hay không. Tuy nhiên, chúng tôi biết rằng một số hormone steroid ở động vật có xương sống có trong luân trùng và có thể điều chỉnh quá trình sinh sản (Snell 2011).
Jones và cộng sự (2013) cung cấp thêm bằng chứng cho thấy luân trùng, giống như nhiều động vật không xương sống thủy sinh, có phản ứng căng thẳng giống như động vật có xương sống. Các tác giả này lưu ý rằng sự hình thành các căng thẳng để phản ứng với căng thẳng có lịch sử tiến hóa lâu dài ở nhiều sinh vật nhân chuẩn, từ trypanosomatids, côn trùng, nấm men và tế bào động vật có vú. Luân trùng là thành viên của siêu ngành lophotrochozoans. Phản ứng căng thẳng được mô tả ở các động vật không xương sống
lophotrochozoan khác có thể có cơ chế tương tự ở luân trùng (Adamo 2012, Binder và cộng sự 2019).
Trong số các tài liệu ít ỏi, căng thẳng do mật độ dày có thể dễ dàng nhận ra bằng cách quan sát tốc độ và hành vi bơi lội của chúng.
Nếu chúng ta cho ấu trùng cá hề ăn luân trùng bị căng thẳng, chúng sẽ chết trong vòng vài ngày. Chúng tôi tin rằng tỷ lệ chết này là do hai yếu tố gây ra; luân trùng bị căng thẳng cung cấp ít giá trị dinh dưỡng hơn và chúng tôi tin rằng các hormone gây căng thẳng trong luân trùng hoặc được truyền sang ấu trùng hoặc kích hoạt sự giải phóng hormone gây căng thẳng ở ấu trùng.
Luân trùng bị căng thẳng cũng là một dấu hiệu ban đầu cho thấy việc nuôi luân trùng có thể sẽ sớm chết hàng loạt.
Do đó, chúng tôi đề xuất nên có một mật độ nuôi luân trùng tối ưu, nếu vượt quá sẽ gây ra căng thẳng làm ảnh hưởng đến sức khỏe, khả năng sinh sản và sự ổn định cũng như giá trị dinh dưỡng của chúng đối với ấu trùng cá.
Chúng tôi bắt đầu khám phá mật độ tối ưu để tránh căng thẳng về số lượng luân trùng, luân trùng chết hàng loạt và tỷ lệ chết do cho ấu trùng cá ăn luân trùng bị căng thẳng. Chúng tôi cũng nhận ra rằng cũng có mối tương quan giữa xác suất va chạm và kích thước của luân trùng được nuôi trồng.
Bảng sau đây cung cấp hướng dẫn hữu ích về mật độ thu hoạch tối ưu cho các loài luân trùng khác nhau:
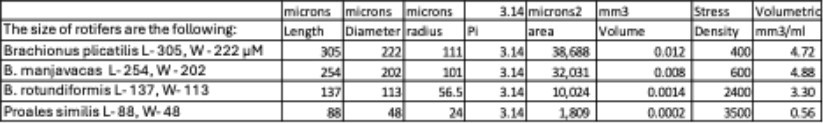
Việc duy trì mật độ ở mức này sẽ giúp loại bỏ căng thẳng do mật độ dày và cùng với các quy trình khác trong Chương 2 và 3 sẽ tạo ra luân trùng khỏe mạnh, giàu dinh dưỡng cho ấu trùng của bạn. SOP cho nuôi luân trùng đại trà
Phần tiếp theo này trình bày bốn quy trình vận hành tiêu chuẩn khác nhau cho các hoạt động của lò phản ứng sinh học, Dòng chảy hoặc nuôi theo lô sử dụng tảo + Amplifeed Replete hoặc chỉ sử dụng Amplifeed Replete.
Chương 4 sẽ giúp bạn điều chỉnh kích thước lò phản ứng sinh học để đáp ứng nhu cầu dự đoán ấu trùng của bạn.
SOP #1
Lò phản ứng sinh học dòng chảy có bổ sung tảo + Amplifeed Replete
Bước 1: Chuẩn bị nước đã được khử Clo. Sau đó đổ đầy vào túi vô trùng hoặc bình đã khử trùng
Bước 2: Cấy tảo và môi trường F2 vào túi hoặc bình Bước 3:
Túi: Khuấy mạnh nước từ sục khí phía dưới, lọc không khí qua Bộ lọc HEPA
Bình chứa: Sục khí mạnh từ đáy bằng cách sử dụng đá khí lọc không khí qua bộ lọc HEPA. Bước 4: Chiếu sáng bằng đèn LED
Bước 5: Khuếch đại tảo nuôi cấy cho đến khi tảo khá xanh, thường là 8-12 ngày tùy thuộc vào mật độ chế phẩm ban đầu 100-110 tế bào/ml.
Bước 6: Thêm luân trùng hoặc trứng luân trùng.
(Ban đầu, các chất chuyển hóa của luân trùng ăn tảo để giữ cho nước sạch. Cuối cùng, luân trùng tiêu thụ hết tảo và màu nhạt dần)
Bước 7: Khi màu tảo nhạt dần, bổ sung lượng Amplifeed Replete thích hợp 0,25 g/triệu luân trùng
Bước 8: Thu hoạch 40% luân trùng sau một hoặc hai ngày với tỷ lệ 600-800 luân trùng/ml Bước 9: thêm Amplifeed Replete và đợi 24-48h.
Bước 10 : Lặp lại 9/10 trong tối đa 3 tháng hoặc cho đến khi bạn thấy có dấu hiệu nhiễm. Tháo dỡ và làm sạch hệ thống rồi khởi động lại bước 1.
SOP #2
Lò phản ứng sinh học dòng chảy chỉ bổ sung Amplified Replete.
Bước 1: Chuẩn bị nước đã khử Clo và đổ đầy túi vô trùng hoặc bình khử trùng Bước 2:
Túi: Khuấy mạnh nước bằng sục khí phía dưới, lọc không khí qua Bộ lọc HEPA
Bình chứa: Sục khí mạnh từ đáy bằng cách sử dụng đá khí lọc không khí qua bộ lọc HEPA. Bước 3: Thêm luân trùng hoặc trứng luân trùng.
Bước 4: Thêm lượng Amplifeed Replete thích hợp 0,25 g/triệu luân trùng. Cho ăn 2 lần/ngày cho đến khi mật độ quần thể đạt 600-800 luân trùng/ml
Bước 5: Thu hoạch 40% túi hoặc thùng. Điều này sẽ làm giảm mật độ xuống khoảng 400/ml
Bước 6: Tiếp tục cho Amplifeed ăn đầy đủ 2 lần/ngày và thu hoạch hàng ngày ở mức 600- 800 luân trùng/ml.
Bước 7: Lặp lại bước 5/6 trong tối đa 3 tháng hoặc cho đến khi bạn thấy có dấu hiệu nhiễm. Tháo dỡ và làm sạch hệ thống rồi khởi động lại bước 1.
SOP #3
Lò phản ứng sinh học theo lô có bổ sung Tảo + Amplifeed Replete
Bước 1: Chuẩn bị nước và cho vào túi vô trùng Bước 2: Cấy tảo và F2 vào túi
Bước 3: Khuấy mạnh nước từ dưới lên bằng máy thổi đưa không khí qua màng lọc HEPA Bước 4: Chiếu sáng bằng đèn LED
Bước 5: Khuếch đại tảo cho đến khi tảo khá xanh, thường là 8-12 ngày tùy thuộc vào mật độ chế phẩm ban đầu.
Bước 6: Thêm luân trùng hoặc trứng luân trùng.
(Ban đầu, các chất chuyển hóa của luân trùng ăn tảo để giữ nước sạch. Cuối cùng, luân trùng hoạt động tốt hơn tảo và màu sắc nhạt dần khi tảo được tiêu thụ.)
Bước 7: Khi màu tảo nhạt dần, thêm lượng Amplifeed Replete thích hợp. Làm theo hướng dẫn trên chai, cho ăn theo mật độ luân trùng.
Bước 8: Thu hoạch luân trùng sau một hoặc hai ngày với tốc độ 400-500 luân trùng/ml và chuyển sang bước 1.
Lưu ý: Đối với thiết kế mô hình sản xuất theo lô 1 tỷ luân trùng/ngày mà chúng tôi đã trình bày ở Chương 2, quy trình hàng ngày sẽ là
3 túi được cấy tảo
3 túi được cấy luân trùng hoặc trứng
Cho ăn 3 túi Amplifeed Replete (hoặc 6 túi) nếu cho ăn 2 ngày trước khi thu hoạch.
Thu hoạch 3 túi (400-500 luân trùng/ml)
SOP #4
Lò phản ứng sinh học theo lô chỉ bổ sung Amplifeed Replete
Bước 1: Chuẩn bị nước và cho vào túi vô trùng
Bước 2: Khuấy mạnh nước từ dưới lên bằng máy thổi đưa không khí qua màng lọc HEPA Bước 3: Thêm luân trùng hoặc bào tử luân trùng.
Bước 4: Thêm lượng Amplifeed Replete thích hợp. Làm theo hướng dẫn trên túi, cho ăn theo mật độ luân trùng, cho ăn 2 lần/ngày cho đến khi mật độ đàn đạt 600-800/ml.
Bước 5: Thu hoạch túi ở mức 400-500 luân trùng/ml và chuyển sang bước 1.
Lưu ý: Đối với thiết kế mô hình sản xuất theo lô 1 tỷ luân trùng/ngày mà chúng tôi đã trình bày ở Chương 2, quy trình hàng ngày sẽ là:
3 túi được cấy luân trùng hoặc bào tử
Tất cả các túi được cho ăn Amplifeed Replete theo hướng dẫn 2X mỗi ngày Thu hoạch 3 túi (400-500 luân trùng/ml)
Theo John Carberry, Matthew Carberry, Dr. Terry Snell, Tim Wilson
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Phần 1: Hướng dẫn nuôi sinh khối Rotifer
- Ảnh hưởng của chiết xuất tỏi trong khẩu phần đến tăng trưởng, các thông số cho ăn, chỉ số huyết học và thành phần cơ thể của tôm thẻ chân trắng Litopenaeus vannamei
- Các nhà nghiên cứu công nghệ sinh học cho biết xét nghiệm nhanh phát hiện mầm bệnh hải sản Vibrio chỉ sau 30 phút

 English
English