Kỹ Thuật Nuôi, Tin tức
Phần 1: Protein (Đạm) Lên Men Từ Ngô (CFP) Trong Sản Xuất Khẩu Phần Ăn Cho Tôm Thẻ Chân Trắng Litopenaeus vannamei: Cải Thiện Năng Suất Sinh Trưởng, Tình Trạng Sức Khỏe Và Sức Chống Chịu Mầm Bệnh
Điểm nổi bật
- Tỷ lệ 12% protein (đạm) lên men từ ngô (CFP) có thể hỗ trợ hiệu suất tăng trưởng tốt của tôm thẻ chân trắng Litopenaeus vannamei.
- Các chỉ số liên quan đến sức khỏe như số lượng tế bào máu đã tăng lên đối với tôm nhận CFP trên các phép đo của nhóm đối chứng.
- Tỷ lệ sống trung bình của tôm được tiêm vi khuẩn Vibrio harveyi cao hơn ở nhóm tôm thẻ chân trắng L vannamei được cho ăn CFP so với nghiệm thức đối chứng.
- Hoạt tính của phenoloxidase đã tăng lên ở tôm được cho ăn CFP ở tất cả các mức độ sau cảm nhiễm.
Tóm tắt
Hai thử nghiệm riêng biệt đã được thực hiện để đánh giá việc sử dụng một loại Protein lên men từ ngô (CFP) mới đối với hiệu suất tăng trưởng và sử dụng thức ăn của tôm thẻ chân trắng Litopenaeus vannamei trong điều kiện ao ngoài trời cũng như cảm nhiễm mầm bệnh độc lập (Vibrio harveyi) trong các điều kiện được kiểm soát sau thử nghiệm cho ăn với các hàm lượng CFP khác nhau. Trong các ao ngoài trời, mức bổ sung 12% CFP để thay thế hoàn toàn việc sử dụng bột gluten ngô (CGM) đã được chứng minh là hỗ trợ tôm tăng trưởng trong ao trước đây đã bị nhiễm mầm bệnh nặng nề, bao gồm cả vi rút gây bệnh đốm trắng (WSSV) và bệnh hoại tử gan tụy cấp tính (AHPND). Trong một thử nghiệm tăng trưởng trong nhà song song với nghiên cứu cảm nhiễm trong ao, CFP ở mức 6%, 12% và 18% với chi phí bột cá (FM), bột đậu nành (SBM) và CGM cũng có thể cải thiện tăng trưởng và một số các thông số liên quan như trọng lượng cơ thể cuối cùng, phần trăm tăng cân và hệ số tăng trưởng nhiệt (TGC). Hệ số chuyển đổi thức ăn (FCR) đối với tôm được nuôi bằng CFP cũng thấp hơn so với tôm không được cho ăn CFP. Về mặt định lượng, mặc dù không có sự khác biệt thống kê, khả năng sống sót và tổng số lượng tế bào máu cũng tăng đối với tôm nhận CFP. Kết quả thử nghiệm cảm nhiễm cho thấy tỷ lệ sống tích lũy trung bình của tôm được tiêm V. harveyi ở liều 5 × 104 CFU/ tôm cao hơn ở nhóm tôm được cho ăn CFP so với nghiệm thức đối chứng. Các giá trị cho hoạt động thực bào trung bình cao hơn đối với tôm ăn ngô lên men. Trong khi đó, tế bào máu vẫn đồng nhất trong các nghiệm thức và chỉ số thực bào đã giảm đáng kể ở mức độ bao gồm 18% của CFP. Hoạt tính của phenoloxidase sau cảm nhiễm với đã tăng lên ở tôm được cho ăn CFP ở tất cả các mức độ. Những phát hiện này cho thấy rằng 6 – 12% CFP có thể được sử dụng như một thành phần mới cho thức ăn cho tôm. Việc ủng hộ các thành phần chức năng với các đặc tính có thể hỗ trợ sức khỏe và an toàn cho tôm nuôi thâm canh sẽ có tầm quan trọng chiến lược trong tương lai để sản xuất tôm bền vững trong điều kiện thâm canh.
1. Giới thiệu
Sự cân bằng các chất dinh dưỡng trong thức ăn thủy sản hỗn hợp hiện đại có thể đáp ứng các yêu cầu dinh dưỡng cụ thể của sản xuất thủy sản nhằm tối ưu hóa sự tăng trưởng và tình trạng sức khỏe, đây là một trong những yếu tố thiết yếu để hỗ trợ tăng trưởng nhanh sản lượng nuôi trồng thủy sản trên toàn thế giới (Li và cộng sự, 2009; Nates, 2015; Novriadi và Davis, 2018; Novriadi và cộng sự, 2019b). Thông qua nỗ lực giảm hàm lượng bột cá (FM) vào công thức khẩu phần ăn, việc cung cấp chất dinh dưỡng có thể đạt được bằng cách phối trộn hợp lý một số nguồn protein thay thế để tạo ra đủ protein, axit amin tiêu hóa và mức năng lượng (Hodar và cộng sự, 2020,Kaushik và cộng sự, 2004, Luo và cộng sự, 2006; Novriadi và cộng sự, 2019a). Một số nguồn protein thay thế đã được đánh giá để bổ sung trong công thức khẩu phần ăn, bao gồm bột đậu nành, bột hạt bông và protein ngô (Lim, 1996; Novriadi, 2018; Novriadi và cộng sự, 2019b; Novriadi và cộng sự, 2017). Trong số các nguyên liệu, các sản phẩm có nguồn gốc từ ngô là một trong những sản phẩm hứa hẹn nhất do giàu hàm lượng protein (Molina‐Poveda và cộng sự, 2015), giá cả, thành phần protein và hàm lượng axit amin cao (Novriadi và cộng sự, 2022b) và không có các yếu tố kháng dinh dưỡng (Hisano và cộng sự, 2016).
Các thành phần mới được phát triển có nguồn gốc từ quy trình sản xuất ethanol nghiền khô hiện đã có trên thị trường và có thể được sử dụng để tạo công thức thức ăn cho tôm (Galkanda‐Arachchige và cộng sự, 2021, Novriadi và cộng sự, 2022a; Novriadi và cộng sự, 2022c). Dựa trên các kết quả trước đây (Novriadi và cộng sự, 2022c), việc bổ sung 12% CFP để thay thế một phần SBM và thay thế hoàn toàn CGM có thể thúc đẩy sự tăng trưởng của tôm thẻ chân trắng Litopenaeus vannamei so với nhóm đối chứng. Ngoài ra, việc sử dụng 12% protein lên men từ ngô (CFP) có thể cải thiện sinh khối, trọng lượng trung bình cuối cùng và tỷ lệ chuyển đổi thức ăn tốt hơn (FCR) so với nghiệm thức đối chứng (Novriadi và cộng sự, 2022c). Nghiên cứu của Guo và cộng sự (2019) đã chứng minh thêm rằng việc bổ sung CFP có thể được sử dụng lên đến 20% để thay thế hiệu quả protein ngô cô đặc (CPC) hoặc bổ sung 15% để thay thế việc sử dụng FM trong công thức khẩu phần ăn điển hình cho tôm thẻ chân trắng L. vannamei. Hàm lượng protein thô vượt trội có trong CFP thu được từ quá trình chưng cất ngô có thể giải thích cho sự tăng trưởng tốt hơn của tôm trong hệ thống nuôi (Novriadi và cộng sự, 2022c).
Một ưu điểm khác của việc sử dụng CFP trong công thức thức ăn thủy sản là sự hiện diện của men, lên đến 25% và những vi sinh vật này đã cho thấy tiềm năng tạo ra một số hoạt chất sinh học, chẳng hạn như glucan, enzyme và vitamin để tăng cường khả năng miễn dịch, tăng trưởng và bảo vệ chống lại sự lây nhiễm mầm bệnh (Ernesto Ceseña và cộng sự, 2021, Lara-Flores và cộng sự, 2003; Li và Gatlin III, 2003; Sarkar và Rao, 2016). Cụ thể ở tôm, việc bổ sung men vào thức ăn đã cho thấy cải thiện tốc độ tăng trưởng, hệ vi sinh vật đường ruột và phản ứng miễn dịch chống nhiễm trùng Vibrio harveyi (Ayiku và cộng sự, 2020). Vai trò chức năng của nấm men cũng đã được quan sát là làm tăng tổng số lượng tế bào máu (THC) ở giai đoạn trước và sau khi nhiễm vi-rút gây hội chứng đốm trắng (WSSV) (Sajeevan và cộng sự, 2006) và nâng cao hoạt tính của phenoloxidase (PO) và lysozyme điều này cho thấy khả năng bảo vệ chống lại mầm bệnh xâm nhập (Ernesto Ceseña và cộng sự, 2021, González và cộng sự, 2009).
Do đó, nghiên cứu này được thực hiện để đánh giá tác động của CFP (NexPro™. POET Bioproducts. Sioux Falls, SD. USA) đối với hiệu suất tăng trưởng của tôm nuôi trong môi trường ao bị nhiễm bệnh nặng trong khi thay thế một phần các thành phần đắt tiền trong khẩu phần ăn của tôm thẻ chân trắng L. vannamei. Một thử nghiệm cho ăn riêng biệt, sau đó là thử nghiệm lây nhiễm trong điều kiện phòng thí nghiệm với V. harveyi cho phép xác thực dữ liệu về tác động của khẩu phần ăn cô lập. Những phát hiện của nghiên cứu này có thể cung cấp thông tin hữu ích về sự phát triển của các thành phần loại thức ăn chức năng cho mục đích kép trong việc hỗ trợ hiệu suất tăng trưởng tốt hơn đồng thời giảm thiểu nhiễm trùng và bệnh ở tôm nuôi thâm canh.
2. Vật liệu và phương pháp
2.1. Chuẩn bị khẩu phần ăn
2.1.1 Chuẩn bị khẩu phần ăn cho thử nghiệm thương mại
Đối với thử nghiệm thương mại, tôm được cho ăn một trong hai khẩu phần ăn: (Khẩu phần ăn 1) 12% CFP (NexPro™. POET Bioproducts . Sioux Falls, SD. USA) thay thế hoàn toàn thành phần bột gluten ngô (CGM) dựa trên nghiên cứu từ Novriadi và cộng sự (2022c) hoặc (Khẩu phần ăn 2) thức ăn cho tôm thương mại có độ đạm từ 34% đến 36% (CJ Feed code SA, East Java, Indonesia). Đối với 12% CFP, quá trình nấu-đùn được sử dụng để sản xuất khẩu phần thí nghiệm ở dạng bột, vụn và viên với kích thước 0,2 – 0,8 mm và 0,8 – 1,2 mm. Nhiệt độ trong máy điều hòa là 98–100°C và thời gian lưu của máy điều hòa là 120 – 150 giây. Thức ăn viên được sấy khô trong không khí đến độ ẩm khoảng 10%, niêm phong trong túi nhựa đóng gói chân không. Đối với thức ăn công nghiệp, quy trình nấu-đùn cũng được sử dụng để sản xuất thức ăn dạng vụn và thức ăn viên có kích thước 0,2 – 0,8 mm và 0,8 – 1,4 mm. Tất cả thức ăn thử nghiệm và thức ăn thương mại được bảo quản trong phòng được kiểm soát nhiệt độ cho đến khi sử dụng tiếp.
2.1.2. Chuẩn bị khẩu phần ăn cho thử nghiệm cho ăn đối chứng
Đối với thử nghiệm tăng trưởng sử dụng môi trường được kiểm soát, khẩu phần thử nghiệm được xây dựng giống như nghiên cứu trước đó được mô tả bởi Novriadi và cộng sự (2022) trong đó khẩu phần ăn đối chứng được thiết kế dựa trên cách tiếp cận tương tự với thị trường thức ăn tôm Indonesia bằng cách sử dụng 10% FM, 47,2% SBM, 8,0% bột gluten ngô (CGM) và 17% bột mì (WF) (Bảng 1). Ba khẩu phần ăn thử nghiệm đã được xây dựng để sử dụng các mức bổ sung đã được chuẩn độ của protein lên men từ ngô (CFP, NexPro™, POET Bioproducts, SD, USA) để bổ sung vào khẩu phần ăn cơ bản ở mức 6% và 12%. Khẩu phần ăn kiêng thứ 4 được thiết kế để thay thế một phần việc sử dụng FM và thay thế hoàn toàn việc sử dụng CGM với 18% CFP. Tất cả các khẩu phần ăn thử nghiệm được sản xuất tại Trung tâm phát triển nuôi trồng hải sản chính Lampung (Lampung, Indonesia) sử dụng quy trình nấu-đùn. Tóm lại, tất cả các thành phần được trộn trong một máy trộn cánh chèo (Marion Mixers, Inc., Marion, IA, USA) trong lô 100 kg, sau đó nghiền thành kích thước hạt < 200 µm bằng máy nghiền đĩa (Jinan Shengrun, Trung Quốc). Các khẩu phần ăn kiêng nấu-đùn tiếp xúc với nhiệt độ trung bình 100–110 °C trong khoảng 14 giây ở phần năm thùng và phần cuối cùng được duy trì ở 62 °C. Áp suất ở đầu khuôn xấp xỉ 50 bar và tốc độ trục vít được duy trì ở mức 423 vòng/phút. Thức ăn thử nghiệm được sản xuất thông qua khuôn 1 và 2 mm để tạo ra các hạt khẩu phần 1,5 và 2,5 mm. Khẩu phần ăn đã được làm khô trong một xung máy sấy tầng chất lỏng (Jinan Shengrun, Trung Quốc) cho đến khi độ ẩm dưới 10%. Các viên nhỏ được sấy khô ở nhiệt độ xấp xỉ 107°C với nhiệt độ không khí thổi ra giới hạn trên là khoảng 88°C trong 8 – 10 giờ. Tất cả các khẩu phần ăn đã hoàn thành được đóng gói và bảo quản trong phòng được kiểm soát nhiệt độ cho đến khi sử dụng tiếp. Các phân tích gần đúng về khẩu phần ăn đã được phân tích tại Trang trại Cá Tích hợp SUA. Đại học Nông nghiệp Bogor. Bogor, Tây Java. Indonesia.
Bảng 1. Thành phần (% nguyên trạng) của khẩu phần ăn có chứa protein lên men từ ngô (CFP) vào khẩu phần ăn cơ sở và cho L. vannamei ăn trong 60 ngày trong điều kiện môi trường được kiểm soát. 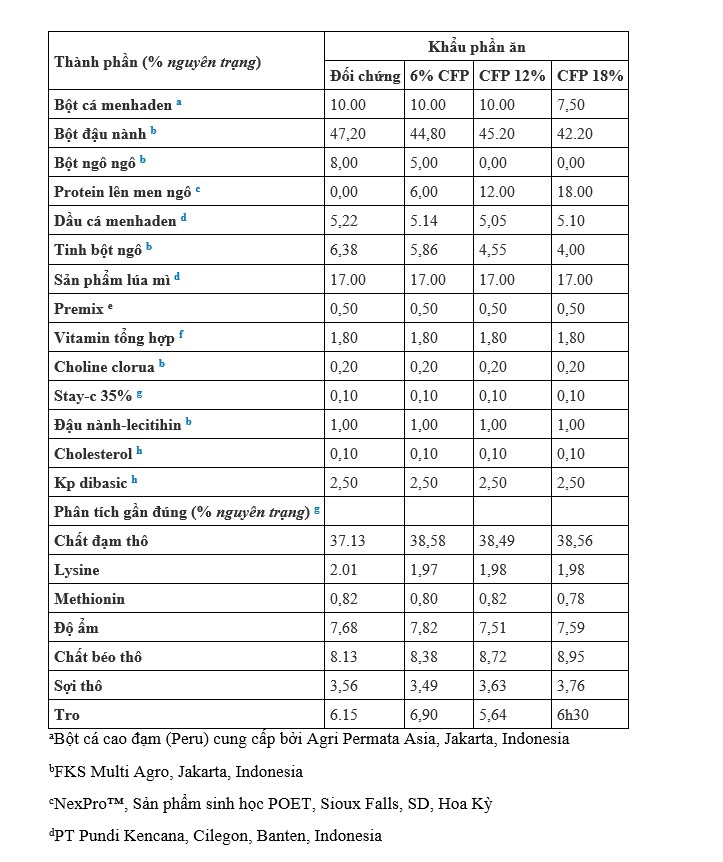

2.2. Thử nghiệm cho ăn
2.2.1. Thử nghiệm thức ăn công nghiệp
Thử nghiệm nuôi thương mại được tiến hành trong 4 hệ thống ao ngoài trời với kích thước 50 × 40 × 1,5 m mỗi ao tại CV Horas Tambak Sanjaya (Langkat, Bắc Sumatera, Indonesia) và được dán nhãn là C1, C2, C3 và C4. Các ao được sử dụng trong nghiên cứu này đã từng bị nhiễm mầm bệnh nặng. Trong số các ao, có 2 ao không cho năng suất sản xuất tốt do bị nhiễm bệnh, đó là ao C2 và C4 và được sử dụng để thử nghiệm khẩu phần ăn chứa 12% CFP. Các ao khác, C1 và C3, có điều kiện ít khắc nghiệt hơn nên được sử dụng để nuôi tôm ăn theo khẩu phần ăn công nghiệp (CJ Feed code SA, East Java, Indonesia). Mật độ được sử dụng trong nghiên cứu này là 100 PL/ m3 và được coi là một hệ thống nuôi thâm canh. Hai nhóm tôm xử lý lặp lại được cho ăn bằng tay 4 lần mỗi ngày vào lúc 7:00; 11:00; 15:00; và 20:00 giờ theo phác đồ tiêu chuẩn nghiên cứu dinh dưỡng. Dựa trên kết quả tiền sử, đầu vào thức ăn đã được lập trình sẵn với giả định tôm tăng trưởng bình thường và tỷ lệ chuyển đổi thức ăn là 1,5. Lượng thức ăn cho phép hàng ngày được điều chỉnh dựa trên mức tiêu thụ thức ăn quan sát được và số lượng tôm chết hàng tuần.
2.2.2. Thử nghiệm cho ăn đối chứng
Thử nghiệm cho ăn đối chứng và thử nghiệm cảm nhiễm sau đó được tiến hành tại Phòng thí nghiệm Sức khỏe Môi trường và Cá (Đại học Gadjah Mada, Yogyakarta, Indonesia) và Cơ sở Nuôi trồng Thủy sản Sundak (Yogyakarta, Indonesia) và duy trì theo chính sách chăm sóc động vật. Tôm post L. vannamei (PL) được lấy từ trại sản xuất giống tôm thương mại tư nhân PT. Maju Tambak Sumur (Kalianda, Lampung, Indonesia) và được nuôi dưỡng trong hệ thống tuần hoàn bán trong nhà. Chất lượng nước được duy trì bằng cách tuần hoàn qua bộ lọc cát thẳng đứng (Dab Pumps SpA, Mestrino, Italy). Oxy hòa tan được duy trì ở mức gần bão hòa bằng cách sử dụng đá không khí trong mỗi bể nuôi cấy và nhiệt độ được duy trì trong khoảng 20–30°C. Tôm post được cho ăn thức ăn công nghiệp (Evergreen Feed, Lampung, Indonesia) trong 3 tuần cho đến khi đạt kích cỡ phù hợp. Tôm (1,04 ± 0,05 g trọng lượng trung bình ban đầu) được thả vào bể 70 × 35 × 40 cm3 (98 L) với 15 con tôm mỗi bể. Năm nhóm tôm lặp lại được cung cấp khẩu phần ăn thử nghiệm sử dụng quy trình tiêu chuẩn nghiên cứu dinh dưỡng trong 60 ngày. Dựa trên kết quả trước đó (Novriadi và cộng sự, 2022c), lượng thức ăn đầu vào đã được lập trình sẵn với giả định tôm tăng trưởng bình thường và sử dụng tỷ lệ chuyển đổi thức ăn tiêu chuẩn là 1,5. Lượng thức ăn cho phép hàng ngày được điều chỉnh dựa trên mức tiêu thụ thức ăn và số lượng tôm hàng tuần được quan sát.
2.2.3. Lấy mẫu chất lượng nước và tăng trưởng
Đối với tất cả các thử nghiệm cho ăn, các thông số về pH, oxy hòa tan (DO), nhiệt độ nước và độ mặn được đo 4 lần mỗi ngày bằng thiết bị Sonde đa thông số Aqua TROLL 500 và được kết nối với các ứng dụng AquaEasy (Bosch, Singapore) cho hệ thống theo dõi và ghi dữ liệu. Tổng amoniac-nitơ (TAN), nitrat và nitrit được đo hàng tuần bằng phương pháp quang phổ hấp thụ (DR890, HACH, USA). Vào cuối các giai đoạn cho ăn, tôm trong nghiên cứu ao thương mại được cân theo nhóm và đối với nghiên cứu đối chứng, tôm được phân nhóm và cân riêng để tính sinh khối cuối cùng, trọng lượng cuối cùng, tỷ lệ tăng trọng (PWG), tỷ lệ chuyển đổi thức ăn (FCR), tỷ lệ sống (SR), và hệ số tăng trưởng đơn vị nhiệt (TGC) như sau:

2.3. Thử nghiệm cảm nhiễm
Song song với thử nghiệm cho ăn đối chứng, một thử nghiệm cảm nhiễm đã được thực hiện bằng cách sử dụng 20 con tôm cho mỗi bể nuôi đã được thích nghi với điều kiện phòng thí nghiệm. Trước khi cảm nhiễm, tôm có trọng lượng trung bình ban đầu là 4,01 ± 0,04 g được phân bố ngẫu nhiên vào 20 đơn vị bể kính có kích thước 70 × 35 × 40 cm3 (98 L/bể) và được nuôi bằng khẩu phần ăn thử nghiệm theo tiêu chuẩn nghiên cứu dinh dưỡng trong 30 ngày. Tôm được cho ăn bằng tay 4 lần mỗi ngày vào lúc 07:00, 11:00, 15:00 và 20:00 giờ. Vào ngày thứ 30 của khẩu phần ăn, thử nghiệm cảm nhiễm được thực hiện bằng cách tiêm huyền phù V. harveyi với mật độ tế bào cuối cùng là LD50 (5 × 104 CFU/ tôm). Tỷ lệ chết được theo dõi trong 96 giờ sau cảm nhiễm. Tác dụng bảo vệ của thức ăn thử nghiệm được đánh giá dựa trên giá trị tỷ lệ sống tương đối (RPS) sau đây (Sửa đổi, 1981). Các thông số liên quan đến miễn dịch đã được kiểm tra ngay lập tức sau khi kết thúc thử nghiệm cảm nhiễm.
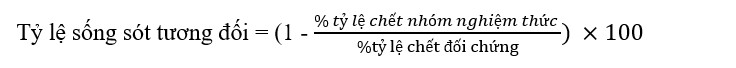
2.4. Quan sát phản ứng miễn dịch của tôm
Các thông số miễn dịch đã được xác định cho hai sơ đồ quan sát: (1) đo lường THC khi kết thúc thử nghiệm tăng trưởng có kiểm soát trong 60 ngày và (2) đo lường THC, hoạt động thực bào, chỉ số thực bào và hoạt tính phenoloxidase khi kết thúc thử nghiệm cảm nhiễm.
2.4.1. Tổng số tế bào máu (THC)
Tổng số lượng tế bào máu (THC) được xác định trực tiếp sau 60 ngày thử nghiệm cho ăn trong môi trường được kiểm soát và ngay sau khi kết thúc thử nghiệm cảm nhiễm. Để xác định THC sau 60 ngày thử nghiệm cho ăn, 2 con tôm mỗi bể hoặc 10 con tôm mỗi khẩu phần ăn được thu thập ngẫu nhiên, trong khi để xác định THC khi kết thúc thử nghiệm cảm nhiễm, tối đa 4 con tôm mỗi bể hoặc 16 con tôm mỗi khẩu phần ăn được thu thập. Tính toán tổng số lượng tế bào máu (THC) đã được hoàn thành bằng cách trộn 20 µL dung dịch tan máu và 80 µL dung dịch muối đệm phốt phát (PBS, pha loãng 5 lần). Sau khi trộn, 20 µL từ hỗn hợp được đưa vào máy đo hemocytometer (Hausser Scientific, USA) và quan sát dưới kính hiển vi có độ phóng đại 40 lần (Campa-Cordova Modification, 2002). Tổng số lượng tế bào máu được xác định như sau:
THC = số lượng tế bào máu (1/5 × 25 × tỷ lệ pha loãng × 104 tế bào/ mL.
2.4.2. Hoạt tính thực bào (PA) – chỉ số thực bào (PI)
Thử nghiệm hoạt động thực bào được thực hiện bằng cách pha loãng 20 µL tan máu trong 10 µL dung dịch muối đệm phốt phát (PBS), với việc bổ sung 30 µL tế bào diệt Vibrio bằng formalin (mật độ 1 × 108 tế bào/ mL) . Mẫu sau đó được ủ ở nhiệt độ phòng trong 30 phút. Sau khi ủ, 5 µL từ hỗn hợp được bôi lên vật kính, cố định bằng glutaraldehyde 2,5% trong 20 phút, sau đó rửa bằng NaCl 0,85% để loại bỏ các tế bào không dính, sau đó để khô trong không khí qua đêm và bảo quản ngoài không khí trong tối. Các mẫu được nhuộm bằng thuốc nhuộm wright 10% (Chotigeat và cộng sự, 2004) trong 20 phút, rửa sạch bằng nước máy, và sấy khô trong không khí. Các mẫu sau đó được quan sát dưới kính hiển vi với độ phóng đại 100 × để tính số lượng thực bào nhấn chìm trên mỗi thực bào được quan sát. Chỉ số thực bào, xác định số lượng hạt nhấn chìm trung bình trên mỗi thực bào, cũng được tính theo công thức:
2.4.3. Hoạt tính phenoloxidase (PO)
Hoạt tính của phenoloxidase (PO) được đo bằng đo quang phổ bằng cách ghi lại sự hình thành dopachrom được tạo ra từ L -dihydroxyphenylalanine (L -DOPA). Tổng cộng 100 µL hemolymp được pha loãng trong PBS (1:1) và ly tâm ở 700 g ở 4°C trong 20 phút. Phần nổi phía trên được loại bỏ trong khi phần còn lại được pha loãng trong 100 µL dung dịch đệm cacodylat xitrat (natri cacodylat trihydrat 0,1 M; NaCl 0,45 M và natri xitrat 0,01 M) và ly tâm ở 700 g ở 4°C trong 20 phút. Sau đó, phần nổi phía trên được xả ra và viên nén được pha loãng lại với 100 µL dung dịch đệm cacodylat (natri cacodylat trihydrat 0,01 M; 0.45 M NaCl; 0.01 M CaCl2 0.2 H2O; 0.26 M MgCl 0.6 H2O). Phần nổi phía trên được chuyển vào một đĩa vi mô 96 giếng với việc bổ sung 100 µL Trypsin (Sigma Aldrich), tạo huyền phù lại và ủ ở nhiệt độ phòng trong 10 phút. Sau khi ủ, 50 µL L -DOPA được thêm vào giếng và độ hấp thụ được đo bằng thiết bị đọc vi bản (R-Biopharm Well Reader, Đức) ở bước sóng 490 nm.
2.5. Phân tích thống kê
Hiệu suất tăng trưởng, tổng số lượng tế bào máu, tỷ lệ sống của tôm sau khi cảm nhiễm và các thông số liên quan đến miễn dịch đã được phân tích bằng phân tích phương sai một chiều (ANOVA) để xác định sự khác biệt đáng kể giữa các nghiệm thức, sau đó là nhiều thử nghiệm so sánh của Tukey để xác định sự khác biệt giữa các nghiệm thức. Tất cả các phân tích thống kê được thực hiện bằng hệ thống SAS (V9.4. Viện SAS, Cary, NC, Hoa Kỳ). Sự khác biệt được ở giá trị P là 0,05 được coi là đáng kể hoặc không đáng kể đối với khoảng tin cậy là 95%. Tất cả các thanh Errors cho biết độ lệch chuẩn.
Theo Romi Novriadi, Indah Istiqomah, Alim Isnansetyo, Derek Balk, Melissa Jolly-Breithaupt, Simon Davies
Nguồn: https://www.sciencedirect.com/science/article/pii/S2352513423001102
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Mô Hình Nuôi Tôm Thẻ Chân Trắng Công Nghiệp Tại Trung Quốc
- Quan Tâm Đến Hệ Vi Sinh Vật: Giải Trình Tự Hệ Vi Sinh Vật Như Một Bước Chuẩn Bị Ban Đầu Của Việc Quản Lý Sản Xuất Thích Ứng
- Giun Nhiều Tơ Tươi SPF – Nhu Cầu Cấp Thiết Đối Với An Toàn Sinh Học Và Năng Suất Của Tôm Bố Mẹ

 English
English