Kỹ Thuật Nuôi, Tin tức
Nuôi Ghép Tôm Thẻ Chân Trắng, Cá Đù Đỏ Và Cá Rô Phi Trong Hệ Thống Biofloc: Sử Dụng Cá Rô Phi Làm Vật Tiêu Thụ Tổng Chất Rắn Lơ Lửng
Tóm tắt
Nghiên cứu này được thực hiện nhằm đánh giá vai trò của cá rô phi (Oreochromis niloticus) trong kiểm soát sinh học chất rắn lơ lửng trong hệ thống nuôi thủy sản đa dinh dưỡng tích hợp công nghệ biofloc (BFT), kết hợp nuôi cá đù đỏ (Sciaenops ocellatus) và tôm thẻ chân trắng (Litopenaeus vannamei). Bốn hệ thống BFT tích hợp được thiết lập theo mô hình tuần hoàn khép kín, với các bể nuôi riêng biệt cho từng loài. Thí nghiệm được thiết kế nhằm so sánh hiệu quả kiểm soát chất rắn lơ lửng của hệ thống có bổ sung cá rô phi (xử lý sinh học – BT) với hệ thống đối chứng không có cá rô phi. Trọng lượng trung bình ban đầu và mật độ thả giống lần lượt là: 2 g và 250 con/m³ đối với tôm; 71 g và 1,04 kg/m³ đối với cá đù đỏ; và 85 g và 5,12 kg/m³ đối với cá rô phi. Các chỉ tiêu môi trường nước được theo dõi xuyên suốt thí nghiệm bao gồm nhiệt độ, oxy hòa tan (DO), pH, độ kiềm, độ mặn, tổng chất rắn lơ lửng (TSS), tổng nitơ amoniac (TA-N) và nitrit, và đều được duy trì trong phạm vi khuyến cáo cho từng loài nuôi. Kết quả cho thấy không có sự khác biệt đáng kể về tăng trưởng của tôm, cá đù đỏ và cá rô phi giữa các nghiệm thức. Tuy nhiên, nghiệm thức có bổ sung cá rô phi (BT) thể hiện khả năng tiêu thụ chất rắn lơ lửng rõ rệt, góp phần làm giảm hàm lượng vật chất dạng hạt trong nước thải so với hệ thống đối chứng. Những kết quả này cho thấy cá rô phi có tiềm năng kiểm soát hiệu quả chất rắn lơ lửng khi được tích hợp vào hệ thống nuôi ghép đa dinh dưỡng áp dụng công nghệ BFT kết hợp nuôi tôm thẻ chân trắng và cá biển.
Giới thiệu
Nuôi trồng thủy sản theo hướng bền vững đặt ra yêu cầu cấp thiết về việc sử dụng nguồn nước một cách hiệu quả. Trong bối cảnh đó, hệ thống nuôi trồng ứng dụng công nghệ biofloc (BFT) đã nổi lên như một giải pháp đầy tiềm năng, mang lại nhiều lợi ích vượt trội trong tối ưu hóa việc sử dụng nước. Hệ thống BFT có khả năng vận hành với lượng nước rất thấp hoặc thậm chí không cần thay nước định kỳ (Otoshi và cộng sự, 2009), cho phép tái sử dụng nước qua nhiều chu kỳ sản xuất (Krummenauer và cộng sự, 2014), từ đó giảm đáng kể nhu cầu sử dụng nước và hạn chế tác động tiêu cực đến môi trường.
Nguyên lý cốt lõi của hệ thống BFT là tận dụng hoạt động của vi khuẩn để tái chế các chất dinh dưỡng phát sinh từ chất thải của vật nuôi, qua đó thúc đẩy sự phát triển của quần thể vi sinh vật khác và hình thành các hạt biofloc (Avnimelech, 2009). Cơ chế này không chỉ giúp giảm lượng chất thải hữu cơ trong hệ thống mà còn cải thiện chất lượng nước, đồng thời tạo ra nguồn thức ăn tự nhiên phong phú cho các đối tượng nuôi (Wasielesky và cộng sự, 2006). Để ngăn ngừa sự suy giảm chất lượng nước do tích tụ chất rắn ở đáy bể, các hạt biofloc được duy trì ở trạng thái lơ lửng thông qua hệ thống sục khí cơ học (Hargreaves, 2006), đặc biệt trong trường hợp nước được tái sử dụng từ các chu kỳ trước (Krummenauer và cộng sự, 2014). Tuy nhiên, khi nồng độ biofloc vượt quá 500 mg/L, hiệu suất tăng trưởng của cá và tôm có thể bị ảnh hưởng tiêu cực. Do đó, việc sử dụng bể lắng để kiểm soát hàm lượng chất rắn bằng cách loại bỏ một phần biofloc khỏi hệ thống được xem là giải pháp hiệu quả trong suốt chu kỳ sản xuất (Gaona và cộng sự, 2011; Ray và cộng sự, 2010).
Các hệ thống đa dinh dưỡng tạo ra các loài mục tiêu có giá trị thương mại và chất thải hữu cơ và vô cơ của chúng được sử dụng đồng thời để nuôi các sinh vật thủy sinh khác trong hệ thống (Barrington, Chopin, & Robinson, 2009). Sản xuất tổng hợp các loài được lựa chọn cẩn thận để tiêu thụ chất dạng hạt có thể làm giảm nồng độ chất rắn lơ lửng, chuyển chúng thành sản phẩm có thể bán được trên thị trường và giảm thiểu tác động đến môi trường (Abreu, Pereira, Yarish, Buschmann, & Sousa-Pinto, 2011; Lander, Robinson, MacDonald, & Martin, 2013; Legarda và cộng sự, 2019; Muangkeow, Ikejima, Powtongsook, & Yi, 2007; Fitzimmons, & Diana, 2010).
Nuôi tích hợp tôm và cá trong hệ thống BFT đa dinh dưỡng có thể tối ưu hóa sản xuất. Việc nuôi tôm bằng BFT đã đạt được kết quả tuyệt vời về chất lượng nước và năng suất của vật nuôi được cải thiện, dẫn đến năng suất cao hơn (Krummenauer, Cavalli, Poersch, & Wasielesky, 2011; Samocha và cộng sự, 2007; Wasielesky và cộng sự, 2006). Cá rô phi là loài cá ăn tạp, ăn vật liệu dạng hạt và được sản xuất hiệu quả trong hệ thống BFT (Azim & Little, 2008; Luo và cộng sự, 2014; Poli và cộng sự, 2019). Mặc dù cá đù đỏ thường được đánh bắt tự nhiên nhưng nó có thể được sản xuất để tiêu thụ trong các hệ thống nuôi thương phẩm (Sandifer, Hopkins, Stokes, & Smiley, 1993).
Hệ thống đa dưỡng tích hợp sản xuất các loài trong bể nước tuần hoàn chưa được nghiên cứu kỹ. Mục tiêu của nghiên cứu này là đánh giá việc sản xuất hai loài có giá trị thương mại cao là tôm thẻ chân trắng Litopenaeus vannamei và cá đù đỏ Sciaenops ocellatus và đánh giá cá rô phi Oreochromis niloticus là loài tiêu thụ tổng chất rắn lơ lửng (TSS) trong hệ thống biofloc tích hợp.
Chuẩn bị nghiên cứu
Thiết kế thí nghiệm
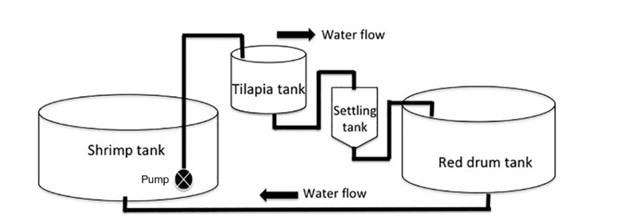
Một thí nghiệm kéo dài 8 tuần đã được thực hiện trong hai nhà kính tại Trung tâm Nuôi trồng thủy sản Waddell (WMC) ở Bluffton, SC. Nước sử dụng trong thí nghiệm được lấy từ sông Colleton, liền kề với WMC và được pha với nước ngọt để giảm độ mặn từ 32 xuống 13 ppt. Tôm thẻ chân trắng L. vannamei, cá đù đỏ S. ocellatus và cá rô phi O. niloticus được thích nghi với độ mặn giảm khi bắt đầu thí nghiệm trong thời gian 48 giờ. Thí nghiệm được tiến hành trên 4 hệ thống thí nghiệm, mỗi hệ thống gồm 4 bể, trong đó có bể lắng hoặc bể lọc. Hai trong số các hệ thống chứa cá rô phi để xử lý sinh học (BT) chất rắn lơ lửng trong khi hai hệ thống còn lại không chứa cá rô phi là nhóm đối chứng. Trong tất cả các lần lặp lại, các loài nuôi được nuôi trong các bể riêng biệt trong hệ thống khép kín tuần hoàn. Nước được bơm từ bể nuôi tôm vào bể có hoặc không có cá rô phi, tùy theo nghiệm thức, với tốc độ 1.500 L/giờ bằng máy bơm chìm 2.000 L/giờ. Sau đó, nước chảy theo trọng lực sang bể cá đù đỏ trước khi quay trở lại bể nuôi tôm (Hình 1). Nước được bơm vào bể lắng khi nồng độ biofloc vượt quá 300 mg/L. Dung tích mỗi bể nuôi tôm, cá rô phi, cá đù đỏ và bể lắng lần lượt là 22, 1,5, 6,7 và 1 m3.
Khi bắt đầu thí nghiệm, các bể chuẩn bị nuôi tôm được tiêm 4 m3 nước biofloc trưởng thành đã được nitrat hóa. Mỗi bể được bón phân ba lần với lượng ± 360 g dextrose với hàm lượng carbon 40% để điều chỉnh tỷ lệ C:N (15:1) dựa trên các phương pháp của Avnimelech (1999) và Ebeling, Timmons và Bisogni (2006). Một máy thổi 7 mã lực cung cấp khả năng sục khí thông qua đá khí ở đáy tất cả các bể (1 đá khí trên 1,5 m2 trong bể nuôi tôm, 6 đá khí trên mỗi bể cá rô phi và bể đối chứng; 2 đá khí trên mỗi bể cá đù đỏ).
Quản lý vật liệu sinh học và thức ăn
Tôm post L. vannamei (PL 10) được mua từ Hệ thống cải tiến tôm, Islamorada, FL và được nuôi trong bể ương cho đến khi đạt trọng lượng trung bình 2,00 ± 0,62 g. Khi bắt đầu thí nghiệm, tôm được chuyển sang bể nuôi thương phẩm với mật độ thả 250 con/m3. Tôm được cho ăn 3 lần/ ngày bằng thức ăn thương mại với 35% protein thô (Zeigler HI 35®, Zeigler Brothers, Inc., Gardners, PA). Thức ăn được cung cấp trong khay cho ăn với tỷ lệ ban đầu là 10% sinh khối tôm mỗi ngày và được điều chỉnh theo mức tiêu thụ được quan sát trong khoảng thời gian giữa mỗi lần cho ăn.
Cá rô phi O. niloticus với trọng lượng trung bình 85,39 ± 38,63 g, được thả ở mật độ 60 con/m3 (5,12 kg/m3) trong nghiệm thức BT. Chúng được cho ăn thức ăn thương mại với 40% protein thô (Zeigler Finfish Silver 40–10®, Zeigler Brothers, Inc.) được cung cấp 3 lần/ ngày, với tỷ lệ cho ăn trung bình là 1,25% sinh khối mỗi ngày trong toàn bộ thí nghiệm.
Cá đù đỏ S. ocellatus được nhân giống và nuôi trong phòng thí nghiệm được thả với mật độ 14,6 con/m3 (1,04 kg/m3), với trọng lượng trung bình là 70,94 ± 25,47 g và 71,39 ± 25,88 g lần lượt trong bể đối chứng và bể BT. Cá đù đỏ được cho ăn thức ăn thương mại chứa 40% protein thô (Zeigler Finfish Silver 40–10®, Zeigler Brothers, Inc.) 3 lần/ngày, với tỷ lệ cho ăn là 2% sinh khối mỗi ngày trong suốt thí nghiệm.
Các thông số vật lý và hóa học
Nhiệt độ, oxy hòa tan, độ pH và độ mặn được theo dõi hàng ngày bằng đồng hồ vạn năng YSI® Professional Plus (YSI Incorporated, Yellow Springs, OH). Các phân tích tổng amoniac (TA-N), nitrit (NO2 -N) và nitrat (NO3-N) được thực hiện hàng ngày trên ba mẫu trên mỗi bể, theo các phương pháp HACH 8155, 8507 và 8039 (HACH Company, 2003). Nồng độ photphat được đo mỗi tuần một lần theo phương pháp HACH 8048 (Công ty HACH, 2003). Độ kiềm được đo hàng tuần bằng phương pháp chuẩn độ như được mô tả trong APHA (Hiệp hội Y tế Công cộng Hoa Kỳ), Hiệp hội Công trình Nước Hoa Kỳ và Hiệp hội Kiểm soát Ô nhiễm Nước (1989). Hàng tuần, ba mẫu nước được thu thập từ mỗi bể để phân tích TSS và chất rắn lơ lửng dễ bay hơi (VSS). TSS và VSS được đo bằng cách pha loãng 90% với nước khử ion theo phương pháp ESS 340.2 (ESS (Bộ phận Khoa học Môi trường), Đơn vị Hóa vô cơ, Phòng thí nghiệm Vệ sinh Bang Wisconsin, 1993). Chất rắn lắng (SS) được đo trong bể nuôi cá rô phi (BT) và không nuôi cá rô phi (đối chứng) vào cuối thí nghiệm sử dụng nón Imhoff để đánh giá BT (Avnimelech, 2009). Nước trong tất cả các bể được đồng nhất bằng cách khuấy mạnh bằng lưới trước khi lấy mẫu.
Hiệu suất tăng trưởng
Tăng trưởng của tôm được đo hai tuần một lần và tăng trưởng của hai loài cá được đo hàng tháng bằng cân kỹ thuật số với độ chính xác 0,01 g. Việc điều chỉnh cho tôm ăn được thực hiện theo Jory và cộng sự (2001). Tăng trọng hàng tuần (WWG) được xác định bằng cách tính sau: WWG (g/tuần) = ([trọng lượng cuối cùng – trọng lượng ban đầu] / số tuần nuôi). Tỷ lệ chuyển đổi thức ăn (FCR) được tính như sau: FCR = trọng lượng thức ăn được cung cấp/tăng sinh sinh khối. Tỷ lệ sống của vật nuôi được tính như sau: S% = ([tổng sinh khối cuối cùng / trọng lượng trung bình của cá thể] / số cá thể thả giống) x 100. Năng suất được tính cho tôm và cá bằng: Năng suất (kg/ m3) = ([ tổng sinh khối cuối cùng – tổng sinh khối ban đầu]/thể tích bể).
Phân tích thống kê
Việc so sánh các thông số vật lý và hóa học giữa nghiệm thức đối chứng và nghiệm thức BT được tiến hành bằng cách sử dụng phân tích ANOVA (PROC MIXED) đo lặp lại. Dữ liệu về hiệu suất tăng trưởng của từng loài được so sánh giữa đối chứng và BT bằng t-test (p < 0,05). Dữ liệu tỷ lệ sống được chuyển đổi (arcsine x 0,5) trước khi phân tích (Zar, 1996). Mức ý nghĩa cho tất cả các phân tích được đặt ở p < 0,05.
Kết quả
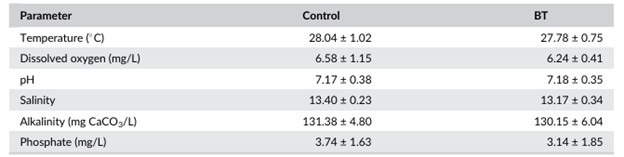
Các nghiệm thức đối chứng và BT cho thấy không có sự khác biệt đáng kể (p > 0,05) về nhiệt độ trung bình tổng thể, oxy hòa tan, pH, độ mặn, độ kiềm và phốt phát (Bảng 1).
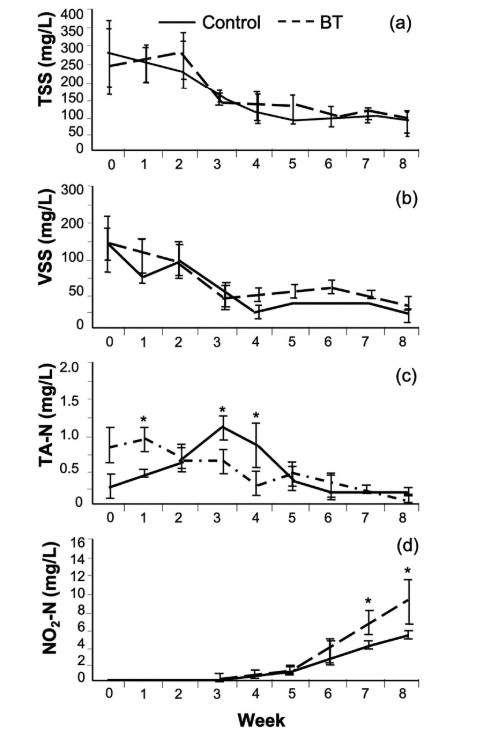
TSS nhìn chung dao động từ tuần đầu tiên cho đến tuần thứ 4 và thứ 5 trong tất cả các hệ thống và sau đó duy trì ổn định cho đến cuối thử nghiệm. Không tìm thấy sự khác biệt đáng kể về nồng độ TSS giữa BT và hệ thống đối chứng (Hình 2a). Các biến thể của VSS tương tự như của TSS; tuy nhiên, có sự khác biệt đáng kể giữa nghiệm thức BT và đối chứng (p < 0,05) trong Tuần 4, 5 và 6 (Hình 2b). SS cao hơn đáng kể (p < 0,05) ở bể đối chứng (940 ± 56 mL/L) so với các nghiệm thức BT (7 ± 4 mL/L) vào cuối thí nghiệm (Hình 3).
![HÌNH 3 Chất rắn lắng đọng tích lũy trong bể cá rô phi (xử lý sinh học [BT]) so với bể không có cá rô phi (đối chứng) được đo bằng nón Imhoff sau khi thu hoạch cá rô phi ở cuối thí nghiệm](https://binhminhcapital.com/wp-content/uploads/2026/01/Picture8.jpg)
Đỉnh amoniac trong đối chứng và BT xảy ra ở những thời điểm khác nhau. Nồng độ amoniac trong BT cao hơn đáng kể (p < 0,05) so với đối chứng trước tuần đầu tiên của thí nghiệm (Hình 2C). Ngược lại, nồng độ amoniac lớn hơn đáng kể (p < 0,05) trong hệ thống đối chứng vào tuần thứ ba và thứ tư của thí nghiệm. Nitrit tích lũy trong suốt thí nghiệm ở cả hai nghiệm thức và đạt mức cao hơn đáng kể (p < 0,05) trong BT so với hệ thống đối chứng trong 2 tuần qua (Hình 2d). Ở một trong các hệ thống BT, nồng độ nitrit đạt 11,7 ± 0,2 mg/L và quan sát thấy tôm chết. Không có sự khác biệt đáng kể nào được phát hiện (p > 0,05) về chỉ số hiệu suất tăng trưởng giữa các hệ thống đối chứng và xử lý đối với tôm và cá đù đỏ (Bảng 2).
Thảo luận
Nhiệt độ, oxy hòa tan, pH và độ mặn được duy trì theo các giá trị khuyến nghị cho sinh vật nuôi (Azim & Little, 2008; Van Wyk & Scarpa, 1999; Yuan và cộng sự, 2010). Các thông số này vẫn gần với các giá trị được theo dõi bởi Lunger, Rasmussen, Laursen và McLean (2006) đối với S. ocellatus.
Nồng độ TSS không vượt quá phạm vi từ 400 đến 600 mg/L với O. niloticus và L. vannamei được đề xuất bởi Azim và Little (2008) và Schveitzer và cộng sự (2013). Việc bón phân ban đầu bằng dextrose đã kích thích sự hình thành biofloc trước khi thả vật nuôi. Sau tuần thứ hai của thí nghiệm, nồng độ TSS giảm cho đến tuần thứ tư ở cả hai nghiệm thức. Sự giảm này có thể liên quan đến khả năng tiêu thụ biofloc của tôm và cá rô phi (Ekasari và cộng sự, 2014) và sự lắng đọng chất rắn trong bể lắng chuyên dụng (Gaona và cộng sự, 2011; Merino, Piedrahita, & Conklin, 2007; Ray và cộng sự, 2010).
Trong bể tròn nuôi cá đù đỏ, dòng chảy hướng tâm có thể khiến các hạt vật chất tích tụ ở đáy bể (Timmons & Ebeling, 2010). Nghiên cứu của Nguyen và cộng sự (2010) cho thấy nuôi kết hợp cá rô phi và tôm giúp giảm nồng độ TSS so với nuôi tôm đơn độc. Avnimelech (2007) cũng quan sát thấy cá rô phi có thể tiêu thụ biofloc làm thức ăn, góp phần giảm TSS trong giai đoạn không cho ăn. Trong thí nghiệm này, TSS ở mức thấp vào cuối giai đoạn thử nghiệm trên tất cả các hệ thống, có thể là do ba yếu tố: (a) bật bể lắng trong 2 giờ mỗi tuần trong 2 tuần đầu tiên; (b) cá rô phi trong nghiệm thức BT đã giảm TSS xuống mức thấp; và (c) bể không có cá rô phi trong quá trình xử lý đối chứng có chức năng như một buồng lắng. Các phép đo chất rắn lơ lửng ở cuối thí nghiệm (Hình 3) cung cấp bằng chứng cho thấy các bể không có cá rô phi hoạt động như buồng lắng. Ngay cả với tổng sinh khối cá cao hơn khi bổ sung cá rô phi trong nghiệm thức BT, nồng độ TSS vẫn giữ nguyên như trong nghiệm thức đối chứng trong suốt thí nghiệm. Điều này cho thấy rằng bản thân cá rô phi có thể đang tiêu thụ lượng chất rắn dư thừa được tạo ra do sự hiện diện của chúng trong một hệ thống đa loài tổng hợp.
Tốc độ tích lũy nitơ (N) và phốt pho (P) trong hệ thống nuôi trồng thủy sản biến đổi tùy thuộc vào khả năng bài tiết và đồng hóa của từng loài. Cá rô phi có xu hướng hấp thụ nhiều P hơn N, trong khi tôm lại ưu tiên N hơn P (Ferreira và cộng sự, 2014; Muangkeow và cộng sự, 2007). Thí nghiệm này ghi nhận hoạt động của các hợp chất nitơ tương đồng với hệ thống nuôi trồng thủy sản theo phương pháp Biofloc (BFT). Nồng độ amoniac đạt đỉnh trong hai tuần đầu nuôi, tiếp theo là nitrit vào tuần thứ 4-6 và nitrat tích tụ dần đến cuối chu kỳ (Avnimelech, 2009). Muangkeow và cộng sự (2007) cho thấy nồng độ amoniac và nitrit trong bể chỉ nuôi tôm cao hơn so với bể nuôi hỗn hợp tôm-cá rô phi. Tuy nhiên, kết quả thí nghiệm này lại trái ngược về nồng độ nitrit cuối cùng, khi hệ thống nuôi đơn thuần (BT) ghi nhận mức nitrit cao hơn hệ thống đối chứng.
Trong nghiệm thức BT, amoniac do cá rô phi tạo ra ngoài tôm và cá đù đỏ có thể làm tăng nồng độ amoniac trong tuần đầu tiên, sau đó là giảm quá trình nitrat hóa của hợp chất này (Avnimelech, 2009). Quá trình nitrat hóa có liên quan đến quần thể vi khuẩn trong biofloc. Cá rô phi ở mật độ cao có thể làm thay đổi cấu trúc biofloc và làm giảm sự hiện diện của vi khuẩn oxy hóa nitrit. Dilling và Alldredge (2000) và Souza, Cardozo, Wasielesky và Abreu (2019) đã quan sát thấy những thay đổi trong quần xã vi sinh vật và hậu quả là quá trình nitrat hóa sau khi thay đổi cấu trúc biofloc. Việc giảm vi khuẩn oxy hóa nitrit này có thể giải thích sự khác biệt về nồng độ nitrit giữa nghiệm thức BT và nghiệm thức đối chứng trong Tuần 6, 7 và 8 (Hình 2d).
Mặc dù nồng độ amoniac có sự khác biệt, nhưng nhìn chung đều nằm trong phạm vi khuyến nghị cho tôm thẻ chân trắng (L. vannamei) theo nghiên cứu của Lin & Chen (2001). Tuy nhiên, trong thí nghiệm BT, nồng độ nitrit đã vượt quá mức an toàn 6,1 mg/L đối với tôm thẻ chân trắng theo ước tính của Lin và Chen (2003), và đây có thể là nguyên nhân dẫn đến tỷ lệ sống thấp của tôm trong nghiên cứu này (Bảng 2). Đối với cá rô phi, nồng độ amoniac và nitrit được ghi nhận trong thí nghiệm đều thấp hơn mức được báo cáo là có ảnh hưởng tiêu cực đến sự tăng trưởng hoặc tỷ lệ sống (Luo và cộng sự, 2014).
Cá rô phi đã được báo cáo là có khả năng giữ lại phốt pho (Poli và cộng sự, 2019; Tian và cộng sự, 2001), nhưng không thấy sự khác biệt đáng kể về mức phốt pho giữa nghiệm thức đối chứng và nghiệm thức BT trong thí nghiệm này.
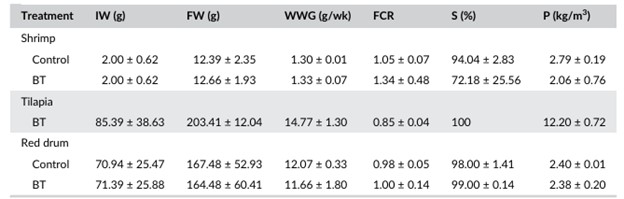
Cá rô phi BT không ảnh hưởng đến năng suất của tôm và cá đù đỏ trong hệ thống nuôi đa loài. Việc tích hợp cá rô phi BT vào hệ thống nuôi không cần điều chỉnh mật độ thả giống của các loài khác. Nuôi L. vannamei trong hệ thống BFT đã được báo cáo về mật độ thả tôm, thông số chất lượng nước và thời gian nuôi khác nhau, dẫn đến sự thay đổi về trọng lượng cuối cùng (8,4–15,6 g), WWG (0,5–0,9 g), FCR (1,3–4,8), tỷ lệ sống (66–92%) và năng suất (2,1–4,1 kg/m3) (Krummenauer và cộng sự, 2011; Ray và cộng sự, 2010; Schveitzer và cộng sự, 2013). Trong nghiên cứu này, kết quả về trọng lượng cuối cùng, WWG, FCR, tỷ lệ sống và năng suất lần lượt là 12,39–12,66 g, 1,33 g/tuần, 1,05–1,34, 72–94% và 2,06–2,79 kg/m3. Trong một nghiên cứu của Azim và Little (2008) về cá rô phi O. niloticus trong hệ thống BFT, đã ghi nhận trọng lượng cuối cùng, WWG, FCR, tỷ lệ sống và năng suất dao động từ 138,58–140,72 g, 3,34 g/tuần, 3,44–3,51, 100% và tương ứng là 4,80–4,90 kg/m3. Sử dụng hệ thống BFT, Luo và cộng sự (2014) trong một thí nghiệm với cá rô phi cho thấy trọng lượng cuối cùng là 168,58 g, FCR là 1,20, tỷ lệ sống 100% và năng suất 36,95 kg/m3. Kết quả tăng trưởng của cá rô phi trong nghiên cứu này tốt hơn so với các nghiên cứu trước đây về trọng lượng cuối cùng = 203,41, WWG = 14,77 g/tuần và tỷ lệ sống = 100%. Ngoài ra, FCR thấp (0,85) làm nổi bật khả năng tiêu thụ biofloc tăng lên do tỷ lệ cho ăn của cá rô phi không được điều chỉnh trong suốt thí nghiệm và có thể dẫn đến mức tiêu thụ biofloc cao hơn. Năng suất cá rô phi đạt giá trị trung bình 12,20 kg/m3 so với các nghiên cứu trước đây.
Trong một nghiên cứu nuôi thương phẩm kéo dài 18 tháng trong ao có diện tích 0,1 ha, Sandifer và cộng sự (1993) ghi nhận các chỉ tiêu sản xuất của cá đù đỏ với trọng lượng thu hoạch đạt 0,89–1,37 kg, hệ số chuyển đổi thức ăn (FCR) 2,15–2,60, tỷ lệ sống 55–95% và năng suất 7.251–24.083 kg. Gần đây hơn, Rossi, Tomasso và Gatlin III (2015) tiến hành nuôi cá đù đỏ trong lồng, với trọng lượng ban đầu 68 g trong 15 tuần, và báo cáo trọng lượng cuối cùng đạt 237,8–247,9 g, FCR 0,53–0,57, tỷ lệ sống 95–99%, cùng mức tăng trọng hằng tuần (WWG) khoảng 12 g/tuần. Trong nghiên cứu hiện tại, sau 8 tuần nuôi trong hệ thống biofloc tích hợp (BFT), cá đạt trọng lượng cuối cùng 164–167 g, FCR xấp xỉ 1,00, tỷ lệ sống 98–99%, và WWG khoảng 12 g/tuần, cho thấy hiệu quả tăng trưởng và tỷ lệ sống cao trong điều kiện nuôi này.
Các chỉ số hiệu suất tăng trưởng này chứng minh rằng nuôi tôm, cá đù đỏ và cá rô phi trong hệ thống đa loài tổng hợp của nghiên cứu này có thể so sánh với các kết quả được báo cáo trong các tài liệu khác từ các thí nghiệm độc canh và đa loài.
Kết luận
Tôm thẻ chân trắng, cá đù đỏ và cá rô phi có thể được nuôi hiệu quả trong hệ thống nuôi đa loài tích hợp áp dụng công nghệ biofloc (BFT). Hàm lượng chất rắn lơ lửng trong hệ thống được kiểm soát hiệu quả nhờ khả năng tiêu thụ của cá rô phi, với hiệu quả tương đương các biện pháp xử lý cơ học như bể lắng. Cách tiếp cận này không chỉ góp phần giảm lượng chất thải trong nuôi trồng thủy sản mà còn bổ sung thêm một đối tượng có giá trị thương mại vào hệ thống nuôi tích hợp. Các chỉ tiêu năng suất thu được, đặc biệt là tốc độ tăng trưởng và tỷ lệ chuyển đổi thức ăn (FCR), đã khẳng định vai trò của biofloc như một nguồn thức ăn bổ sung quan trọng cho tôm và cá rô phi, đồng thời cho thấy tiềm năng ứng dụng mô hình BFT trong nuôi cá đù đỏ. Những kết quả này chứng minh khả năng đa dạng hóa đối tượng nuôi thương phẩm trong các hệ thống nuôi trồng thủy sản tích hợp dựa trên công nghệ biofloc.
Theo Luis Poersch, Jeff Brunson, Carlos A. P. Gaona, Alvin Stokes, Jacob Richardson, Kevin Pitts, John Leffler
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Phân Tích Bệnh Phân Trắng (WFD) do Vibrio sp. Và Dinoflagellata Ở Tôm Thẻ Chân Trắng (Litopenaeus vannamei) Ở Ao Nuôi Nước Lợ
- Các Nghiên Cứu Mới Xác Nhận Tính Khả Thi Của Các Phương Pháp Cải Tiến Để Xử Lý Nước Thải Nuôi Trồng Thủy Sản
- Nhiệt Độ Tăng Do Biến Đổi Khí Hậu Tác Động Như Thế Nào Đến Nuôi Trồng Thủy Sản Giáp Xác

 English
English