Kỹ Thuật Nuôi, Tin tức
Acinetobacter venetianus, Một Tác Nhân Tiềm Ẩn Gây Bệnh Đỏ Chân Ở Tôm Thẻ Chân Trắng Penaeus vannamei Nuôi Trong Môi Trường Nước Ngọt
Tóm tắt
Chi Acinetobacter gần đây đã nổi lên như một mầm bệnh vi khuẩn liên quan đến hiện tượng chết hàng loạt trong nuôi trồng thủy sản. Tuy nhiên, hiện có rất ít thông tin cho rằng Acinetobacter venetianus là mầm bệnh tiềm ẩn của tôm thẻ chân trắng Penaeus vannamei. Trong nghiên cứu này, một mầm bệnh A. venetianus (SHF1) đã được xác định là tác nhân gây bệnh đỏ chân ở tôm thẻ chân trắng nuôi nước ngọt. Kết quả cho thấy giá trị liều gây chết trung bình (LD50) là 3,8 × 105 CFU/ mL và phát triển nhiều khả năng kháng phenicols, quinolone và thuốc tetracycline được sử dụng trong nuôi trồng thủy sản. Ngoài ra, A. venetianus gây bệnh có thể được kiểm soát hiệu quả bằng bột Bdellovibrio ở mức 0,8 mg/ L, thể hiện hoạt tính kháng khuẩn đáng kể và thể hiện sự bảo vệ tốt chống lại cảm nhiễm A. venetianus ở P. vannamei trong 6 ngày. Theo như chúng tôi biết, đây là nghiên cứu đầu tiên xác định A. venetianus là mầm bệnh vi khuẩn tiềm ẩn của bệnh đỏ chân ở tôm thẻ chân trắng nuôi nước ngọt.
1. Giới thiệu
Tôm thẻ chân trắng Penaeus vannamei là một trong những loài tôm thương phẩm quan trọng nhất và được nuôi trên toàn thế giới như ở Trung Quốc, Việt Nam và nhiều nước ở Đông và Đông Nam Á, Trung Á và Châu Phi (Benzie, 2009). Đặc biệt tại Trung Quốc, với sự phát triển nhanh chóng của kỹ thuật nuôi nước ngọt từ năm 2000 (Đặng và cộng sự, 2013), sản lượng tôm thẻ chân trắng hàng năm đã đạt trên 1,76 triệu tấn (Bộ Nông nghiệp và phát triển Nông thôn Trung Quốc, 2019). Tuy nhiên, bệnh đỏ chân, một bệnh truyền nhiễm có dấu hiệu nhận biết đặc trưng gồm chân bò (periopods) và chân bơi (pleopods) có màu đỏ (Velmurugan và cộng sự, 2015), đã đe dọa nghiêm trọng ngành công nghiệp này và dẫn đến thiệt hại kinh tế lớn (Aguirre-Guzman ‘ và cộng sự, 2004). Vì vậy, cần chú ý nhiều hơn cho căn bệnh này. Cho đến nay, bệnh đỏ chân đã được gây ra bởi một số mầm bệnh như Vibrio anguillarum, Vibrio parahaemolyticus và Providencia rettgeri (Lightner và Lewis, 1975; Sudheesh và Xu, 2001; Gai và cộng sự, 2017). Tuy nhiên, rất ít báo cáo về A. venetianus là mầm bệnh vi khuẩn gây bệnh đỏ chân ở tôm thẻ chân trắng.
Thông thường, bệnh đỏ chân được điều trị bằng cách sử dụng kháng sinh trong nuôi tôm (Balcazar’ và cộng sự, 2006). Tuy nhiên, việc sử dụng kháng sinh thường xuyên và rộng rãi đã gây ra các vấn đề nghiêm trọng về môi trường và kiểm soát dịch bệnh (Srinivasan và Ramasamy, 2009). Do đó, cần phải phát triển các phương pháp tiếp cận mới để chống lại bệnh đỏ chân. Hiện nay, việc sử dụng men vi sinh cũng được đề xuất như một giải pháp thay thế tiềm năng cho thuốc kháng sinh để điều trị các bệnh do vi khuẩn trong nuôi trồng thủy sản (Shakibzzadeh và cộng sự, 2011). Đặc biệt, khuẩn Bdellovibrio được coi là một trong những chế phẩm sinh học triển vọng nhất. Nó có thể làm giảm nhanh chóng quần thể mầm bệnh nuôi trồng thủy sản (Qi và cộng sự, 2009), có hiệu quả bảo vệ đáng kể chống lại nhiễm khuẩn Aeromonas hydrophila ở Carassius carassius, Vibrio alginolyticus và Vibrio parahaemolyticus nhiễm trùng ở P. vannamei (Chu và Zhu, 2010; Wen và cộng sự, 2014; Kongrueng và cộng sự, 2017), và đóng vai trò quan trọng trong quản lý sức khỏe trong nuôi trồng thủy sản (Karunasagar, 2012). Do đó, các công thức dạng lỏng và bột của Bdellovibrio đã được phát triển thương mại và được đề xuất tốt để điều trị nhiễm trùng do vi khuẩn trong nuôi trồng thủy sản (Lukwambe và cộng sự, 2015). Tuy nhiên, việc kiểm soát bệnh đỏ chân ở tôm thẻ chân trắng bằng công thức Bdellovibrio hiếm khi được ghi nhận.
Vào tháng 7/2017, bệnh đỏ chân bùng phát ở hầu hết vùng nuôi tôm ở Thanh Phố, Thượng Hải, Trung Quốc. Trong nghiên cứu hiện tại, một phân lập (SHF1) của A. venetianus đã được khẳng định là tác nhân gây bệnh đỏ chân ở tôm thẻ chân trắng nuôi nước ngọt, và vị trí phân loại, độc lực và độ nhạy cảm với kháng sinh của nó đã được nghiên cứu. Hơn nữa, việc kiểm soát A. venetianus gây bệnh bằng bột Bdellovibrio đã được đánh giá thêm. Theo hiểu biết của chúng tôi, đây là báo cáo đầu tiên về A. venetianus như một mầm bệnh vi khuẩn tiềm ẩn của tôm thẻ chân trắng nuôi nước ngọt, và kết quả của nghiên cứu này có thể được sử dụng làm tài liệu tham khảo để phòng ngừa và kiểm soát bệnh đỏ chân ở tôm thẻ chân trắng.
2. Vật liệu và phương pháp
2.1. Tôm và thuốc thử
Mười lăm con tôm thẻ chân trắng nuôi nước ngọt (trọng lượng 8,01 ± 1,45 g) bị bệnh đỏ chân đã được lấy mẫu từ ao nước ngọt bị nhiễm bệnh của một trang trại nuôi tôm không có tiền sử bệnh đỏ chân trước đó ở Thanh Phố, Thượng Hải Trung Quốc trong tháng 7 năm 2017. Bệnh gây ra tỷ lệ chết tích lũy là 60% và các thông số chất lượng nước trong đợt bùng phát là 28ºC, pH 8,50, 0,15 mg/ L tổng amoniac, 0,06 mg/ L nitrit và 6,51 mg/ L oxy hòa tan. Tôm được cho vào túi vô trùng và giữ trên đá trong suốt 1 giờ vận chuyển đến phòng thí nghiệm theo khuyến cáo của Jayasinghe và cộng sự (2010). Tôm khỏe mạnh (7,11 ± 1,05 g) được lấy từ các ao không bị ảnh hưởng của một trang trại nuôi tôm ở Công ty TNHH Nuôi trồng Thủy sản Liên Vân Cảng, Giang Tô, Trung Quốc và được thả ngẫu nhiên trong thủy tinh (76 cm × 50 cm × 48 cm) với 100 L nước lọc khí với độ pH ban đầu là 7,50, 6,3 mg/ L oxy hòa tan, 0,12 mg/ L tổng lượng amoniac, và 0,01 mg/ L nitrit ở 28ºC trong 14 ngày. Tình trạng sức khỏe được đánh giá thông qua việc kiểm tra cẩn thận hình thức bên ngoài, tình trạng đường ruột, tình hình tăng trưởng, hành vi thể chất và xu hướng cho ăn (Cơ quan Phát triển Xuất khẩu Thủy sản và Mạng lưới các Trung tâm Nuôi trồng Thủy sản ở Châu Á – Thái Bình Dương, 2003), cũng như bằng cách lấy mẫu một vài con tôm để kiểm tra trước phân tử để xác định không có bất kỳ mầm bệnh nào bao gồm Vibrio anguillarum, Vibrio parahaemolyticus và Providencia rettgeri (Rodkhum và cộng sự, 2006; Kumar và cộng sự, 2018; Devadas và cộng sự, 2019; Feng và cộng sự, 2019; Ye và cộng sự, 2020). Nước nuôi đã lọc đã được xử lý theo nghiên cứu trước đây của chúng tôi (Cao và cộng sự, 2019).
2.2. Xác nhận mầm bệnh
Mỗi mẫu tôm thẻ chân trắng bị bệnh được khử trùng bên ngoài bằng cồn 70%, được mổ trong phòng thí nghiệm (Soto-Rodriguez và cộng sự, 2015), và các mầm bệnh tiềm ẩn được xác định bằng các quy trình sau: (I). Một lát cắt của các cơ quan (mang, gan tụy, cơ, ruột) đã được lấy mẫu và kiểm tra cẩn thận để tìm ký sinh trùng dưới kính hiển vi theo khuyến cáo của Bayo và cộng sự (2014). (II). Theo Ghani và Bhassu (2019), xét nghiệm virus học được thực hiện bằng cách tiêm bắp dịch lọc của cơ quan không có vi khuẩn từ dịch cơ quan đồng nhất. (III). Các mẫu từ gan tụy của tôm bị bệnh đã được cắt và cấy lên các đĩa thạch dinh dưỡng (NA) (Sinopharm Chemical Reagent Co., Ltd.) để phân lập vi khuẩn theo Gai và cộng sự (2017). Sau khi ủ trong 18− 24 giờ ở 28ºC, các chủng đồng nhất chiếm ưu thế đã được tinh sạch bằng cách cấy sọc và cấy lại vạch lên các đĩa NA. Việc kiểm tra mầm bệnh vi khuẩn được tiến hành bằng thử thách ngâm với các phân lập tinh khiết ở 5,0 × 106 CFU/ mL theo khuyến cáo của Tran và cộng sự (2013). Bên cạnh đó, các phần lát cắt từ gan tụy của tôm bị nhiễm bệnh và tôm khỏe mạnh đã được chuẩn bị thêm để kiểm tra bằng kính hiển vi quang học để quan sát những thay đổi mô bệnh học theo Zhou và cộng sự (2019).
2.3. Xác định mầm bệnh
Các chủng gây bệnh được xác định bằng phương pháp phân tử và kiểu hình. Tóm lại, DNA bộ gen được chiết xuất từ phân lập gây bệnh bằng cách sử dụng Bộ DNA TIANamp (Tiangen Biotech. Co., Ltd., Bắc Kinh, Trung Quốc), sau đó gen 16S rRNA được khuếch đại bằng PCR theo Wilson và cộng sự (1990), và được giải trình tự bởi Bộ giải trình tự DNA ABI 3730 XL (Hệ thống sinh học ứng dụng, Waltham, MA, Hoa Kỳ). Một tìm kiếm tương đồng cho trình tự gen 16S rRNA đã được thực hiện bằng cách sử dụng Công cụ tìm kiếm căn chỉnh cục bộ cơ bản (BLAST) tại Trung tâm Thông tin Công nghệ Sinh học Quốc gia (NCBI), và cây phát sinh loài được xây dựng bằng phương pháp neighbor-joining. Ngoài ra, việc xác định kiểu hình của phân lập gây bệnh cũng được thực hiện bằng cách sử dụng dải API 32 GN theo hướng dẫn của nhà sản xuất (Biomerieux, Lyon, Pháp) theo khuyến nghị của Chiang và cộng sự (2011). Các đặc điểm kiểu hình của A. venetianus được báo cáo trước đây bởi Vaneechoutte và cộng sự (2009) và Malhotra và cộng sự (2012) dùng làm tài liệu tham khảo.
2.4. Độc lực của mầm bệnh
Xét nghiệm độc lực bao gồm một nhóm đối chứng và bốn nhóm điều trị. Trước khi thử nghiệm này, một huyền phù nuôi cấy tươi của phân lập gây bệnh đã được chuẩn bị theo mô tả của Wang và cộng sự (2019), và mật độ tế bào của nó được xác định là 1011 CFU/ mL bằng phương pháp trải tấm sau khi pha loãng nối tiếp 10 lần trong nước muối sinh lý vô trùng (Saraoui và cộng sự, 2018). Trong các nhóm xử lý, ba bể gồm 15 con tôm khỏe mạnh đã bị cảm nhiễm bằng cách ngâm trong 100 L nước nuôi đã lọc với phân lập gây bệnh ở mật độ tế bào cuối cùng là 5,0 × 104 đến 5,0 × 107 CFU/ mL. Ba bể khác gồm 15 con tôm khỏe mạnh, tiếp xúc với các điều kiện thí nghiệm tương tự, không bị cảm nhiễm và được dùng làm đối chứng. Tất cả tôm thử nghiệm được giữ ở mức 28ºC mà không cần thay nước. Tỷ lệ chết được ghi nhận mỗi ngày trong 6 ngày. Tôm chết ngay lập tức được vớt ra để tái phân lập và xác định mầm bệnh để xác nhận xem tôm chết có phải do cảm nhiễm với phân lập hay không. Giá trị liều gây chết trung bình (LD50) được tính bằng phương pháp Bliss (Finney, 1985).
2.5. Tính nhạy cảm với kháng sinh của mầm bệnh
Tính nhạy cảm của chủng gây bệnh đối với 24 loại kháng sinh thú y (Công ty TNHH Thuốc thử vi sinh vật Binhe Hàng Châu, Hàng Châu, Trung Quốc) đã được thử nghiệm trên các đĩa NA bằng phương pháp khuếch tán đĩa Kirby-Bauer (Joseph và cộng sự, 2011). Các vùng ức chế kháng sinh chống lại phân lập gây bệnh được đo sau khi ủ ở 28ºC trong 24 giờ và độ nhạy cảm với kháng sinh được xác định theo hướng dẫn của nhà sản xuất.
2.6. Tác dụng kháng khuẩn trong ống nghiệm của bột Bdellovibrio đối với mầm bệnh
Thử nghiệm hoạt tính kháng khuẩn trong ống nghiệm của bột Bdellovibrio được thực hiện 3 lần trong bình thủy tinh. Trước khi thử nghiệm này, bột Bdellovibrio với mật độ tế bào là 4,0 × 107 PFU/ g đã được điều chế bằng cách sấy phun theo nghiên cứu trước đây của chúng tôi (Cao và cộng sự, 2019). Trong các bình nghiệm thức, huyền phù mới nuôi cấy của phân lập gây bệnh đã được đổ vào 200 mL nước nuôi đã lọc được hấp khử trùng đến mật độ tế bào cuối cùng là 5,0 × 106 CFU/ mL . Ngay sau đó, bột Bdellovibrio được thêm riêng và hòa tan trong nước đến liều cuối cùng là 0,4 mg/ L và 0,8 mg/ L. Trong các bình đối chứng, chỉ có chủng gây bệnh được cấy vào 200 mL nước nuôi đã lọc được hấp khử trùng đến mật độ tế bào cuối cùng là 5,0 × 106 CFU/ mL. Tất cả các bình được ủ ở 28ºC với tốc độ lắc 180 vòng/ phút trong 120 giờ. Mật độ tế bào của chủng gây bệnh trong bình đối chứng và nghiệm thức được đo trong khoảng thời gian 24 giờ bằng cách sử dụng các đĩa thạch eosin- methylen blue (EMB) phết khuẩn (Hou và cộng sự, 2013).
2.7. Tác dụng bảo vệ của bột Bdellovibrio đối với tôm thẻ chân trắng nhiễm bệnh
Thử nghiệm tác dụng bảo vệ bao gồm một đối chứng âm tính, một đối chứng dương tính và một nhóm xử lý. Trong nhóm xử lý, 3 bể gồm 10 con tôm khỏe mạnh đã bị cảm nhiễm bằng cách ngâm trong 100 L nước nuôi đã lọc có sục khí có chứa chủng gây bệnh ở mật độ tế bào cuối cùng là 5,0 × 106 CFU/ mL theo khuyến nghị của Tran và cộng sự (2013), sau đó bột Bdellovibrio với mật độ tế bào 4,0 × 107 PFU/ g ngay lập tức được thêm vào 100 L nước nuôi đã qua lọc có sục khí đến liều cuối cùng là 0,8 mg/ L như đã xác định ở trên. Trong nhóm đối chứng âm tính, ba bể gồm 10 con tôm khỏe mạnh chỉ bị cảm nhiễm bằng cách ngâm thông qua việc tiếp xúc liên tục với chủng gây bệnh ở mật độ tế bào cuối cùng là 5,0 × 106 CFU/ mL trong 100 L nước nuôi đã qua lọc và có sục khí. Trong nhóm đối chứng dương tính, ba bể gồm 10 con tôm khỏe mạnh đã tiếp xúc với 100 L nước nuôi đã lọc có sục khí với 0,8 mg/ L bột Bdellovibrio. Tất cả tôm thử nghiệm được giữ ở mức 28ºC mà không cần thay nước. Tỷ lệ chết được ghi nhận mỗi ngày trong 6 ngày ở tôm thử nghiệm mà không cần cho ăn và thay nước. Tất cả các con tôm chết được vớt ra ngay lập tức để cách ly và xác định mầm bệnh nhằm kiểm tra xem tỷ lệ chết có phải do cảm nhiễm gây ra hay không. Tỷ lệ sống sót tương đối được tính theo Baulny và cộng sự (1996).
2.8. Phân tích thống kê
Phân tích thống kê được thực hiện bằng phần mềm thống kê SPSS 15.0 (SPSS, Inc.) để quan sát sự khác biệt giữa mỗi thử nghiệm. Tất cả dữ liệu được trình bày dưới dạng giá trị trung bình ± độ lệch chuẩn (SD) cho số lượng được chỉ định của mỗi xét nghiệm. Sự khác biệt được coi là có ý nghĩa thống kê tại P < 0,05 bằng cách sử dụng phân tích phương sai theo thử nghiệm của Duncan.
3. Kết quả
3.1. Xác nhận mầm bệnh
Tổng cộng có 4 chủng phân lập trội khác nhau, tạm thời được đánh số từ SHF1 đến SHF4, đã được phục hồi từ gan tụy của tôm bị bệnh và chỉ có SHF1 phân lập chiếm ưu thế nhất được xác nhận là mầm bệnh của bệnh này theo định đề của Koch: (i) Phân lập SHF1 có thể được phân lập từ tôm thẻ chân trắng bị bệnh. (ii) Tỷ lệ chết của tôm thử nghiệm được tăng dần theo thời gian sau cảm nhiễm với phân lập SHF1. Tổng cộng có 13,3% –100% tôm bị cảm nhiễm đã chết với giá trị LD50 là 3,8 × 105 CFU/ mL (Bảng 1) và có dấu hiệu của chân bò và chân bơi đỏ tương tự như ở tôm bị bệnh ban đầu (Hình 1), phù hợp với các triệu chứng lâm sàng được báo cáo trước đó của bệnh đỏ chân (Zhou, 2017). Không ghi nhận các dấu hiệu lâm sàng hoặc tỷ lệ chết ở tôm thẻ chân trắng đối chứng. (iii) Phân lập SHF1 có thể được phân lập lại từ tôm chết thử nghiệm, và đã được xác nhận lại thông qua xác định kiểu hình và phân tử. Hơn nữa, những thay đổi mô bệnh học ở gan tụy của tôm bị nhiễm bệnh bằng thực nghiệm và tự nhiên (Hình 2) đều cho thấy sự sắp xếp rối loạn của ống gan tụy và thâm nhiễm tế bào viêm, tương tự như trong gan tụy bị nhiễm vi khuẩn (Zhou và cộng sự, 2019). Bên cạnh đó, không tìm thấy ký sinh trùng nào ở tôm bị bệnh và tất cả tôm thử nghiệm đều bị cảm nhiễm với dịch lọc cơ quan không có vi khuẩn đều sống sót mà không có thay đổi rõ ràng (dữ liệu không được hiển thị), càng chỉ ra rằng căn bệnh này không phải do ký sinh trùng hoặc vi rút gây ra. Những phát hiện này đã chứng minh rằng phân lập SHF1 là mầm bệnh gây bệnh của bệnh này.
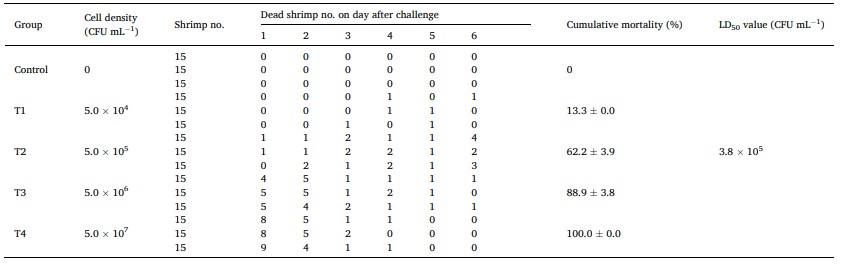
Bảng 1 Tỷ lệ chết tích lũy của tôm thẻ chân trắng thực nghiệm bị nhiễm bệnh bằng cách phân lập SHF1


Hình 1. Dấu hiệu gộp của tôm bị ảnh hưởng mắc bệnh đỏ chân: A. Tôm bị ảnh hưởng tự nhiên trong vùng bùng phát dịch bệnh; B. Tôm thử nghiệm gặp khó khăn với SHF1 cô lập. Mũi tên cho thấy periepads và pleopods đỏ; C. Tôm khỏe mạnh. Mũi tên cho thấy periepads và pleopods bình thường.
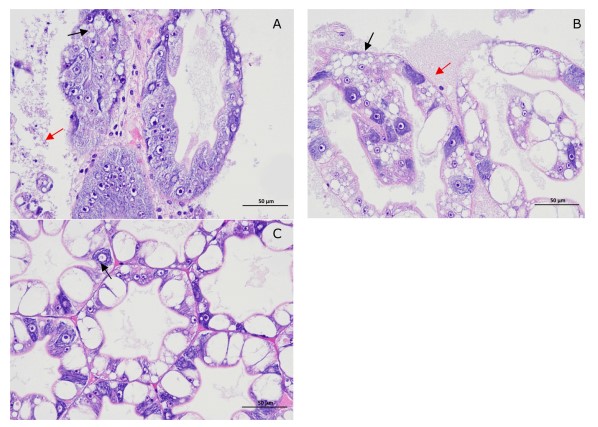
Hình 2. Thay đổi mô bệnh học ở gan tụy của tôm bị ảnh hưởng: A. Sắp xếp rối loạn các ống gan tụy (mũi tên đen) và thâm nhiễm tế bào viêm (mũi tên đỏ) trong gan tụy bị nhiễm bệnh tự nhiên; B. Sắp xếp rối loạn các ống gan tụy (mũi tên đen) và thâm nhiễm tế bào viêm (mũi tên đỏ) trong gan tụy bị nhiễm trùng nhân tạo; C. Sự sắp xếp bình thường của ống gan tụy (mũi tên đen) trong gan tụy khỏe mạnh.
3.2. Xác định mầm bệnh
Trình tự gen 16S rRNA của SHF1 phân lập đã được gửi vào GenBank với số gia nhập No. MH374282, và cho thấy sự tương đồng 99% với các chủng A. venetianus đã biết trong cơ sở dữ liệu GenBank. Cây phát sinh loài (Hình 3) tiếp tục chứng minh phân lập SHF1 là một chủng A. venetians. Hơn nữa, phân lập SHF1 thể hiện các đặc điểm kiểu hình tương tự với các chủng tham chiếu của A. venetianus (Vaneechoutte và cộng sự, 2009; Malhotra và cộng sự, 2012). Đó là dương tính cho việc sử dụng 4-aminobutyrate, L-arginine, benzoate, citrate, ethanol, L-histidine, malonate, D-malate, và âm tính cho sự tăng trưởng trên β-alanine, L-arabinose, L-aspartate, 2,3-autanediol, citraconate, D-glucose, 4-hydroxybenzoate, DL-lactate, L-ornithine, phenylacetate và putrescine (Bảng 2). Do đó, các dữ liệu này xác định phân lập SHF1 là A. venetianus.

Hình 3. Cây phát sinh loài 16S rRNA gồm 14 vi khuẩn đã biết và phân lập SHF1 được xây dựng bằng phương pháp neighbor-joining. Các giá trị bootstrap (%) được hiển thị bên cạnh các nhánh, số gia nhập được chỉ định bên cạnh tên của các chủng và thanh tỷ lệ đại diện cho các giá trị khoảng cách
Bảng 2. Đặc tính kiểu hình của phân lập SHF1
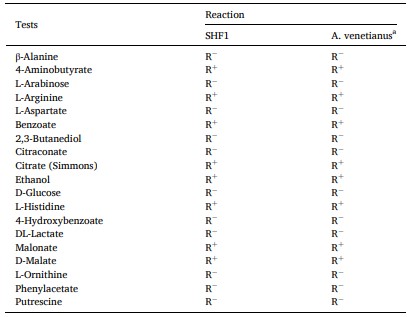
aDữ liệu cho A. venetianus trước đây được báo cáo bởi Vaneechoutte và cộng sự (2009) và Malhotra và cộng sự (2012); R+: phản ứng tích cực; R– : phản ứng tiêu cực.
3.3. Tính nhạy cảm với kháng sinh của mầm bệnh
Dữ liệu (Bảng 3) chỉ ra rằng phân lập SHF1 nhạy cảm vừa phải với erythromycin, polymyxin, tobramycin và kháng amoxicillin, aztreonam, chloramphenicol, cefazolin, cefotaxime, ceftazidime, cefuroxime, clindamycin, cotrimoxazole, doxycycline, enrofloxacin, florfenicol, furadantin, furazolidone, lincomycin, norfloxacin, ofloxacin, oxacillin, rifampin, tetracycline, trimethoprim. Điều này cho thấy rằng phân lập SHF1 đã phát triển nhiều loại kháng sinh đối với kháng sinh chloramphenicols, quinolone và tetracycline được sử dụng trong nuôi trồng thủy sản.
Bảng 3. Độ nhạy kháng sinh của SHF1 phân lập
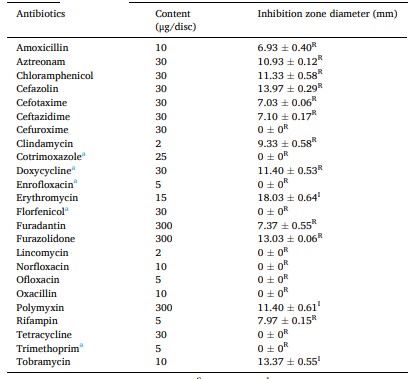
a loại kháng sinh dùng trong nuôi trồng thủy sản; S nhạy cảm; I nhạy cảm trung gian; RResistant.
3.4. Tác dụng kháng khuẩn của bột Bdellovibrio khi thử nghiệm in vitro
Hoạt tính kháng khuẩn trong ống nghiệm của bột Bdellovibrio chống lại phân lập SHF1 được thể hiện trong Hình 4. Kết quả đã chứng minh rằng bột Bdellovibrio với liều 0,8 mg/ L đã ức chế đáng kể sự phát triển của phân lập SHF1 và giảm 99,96% (P < 0,05) mật độ tế bào sau khi điều trị trong 120 giờ so với đối chứng. Đặc biệt, việc giảm 97,48% (P < 0,05) mật độ tế bào đã được quan sát thấy sau khi điều trị trong 120 giờ so với ban đầu. Ngược lại, so với đối chứng, chỉ có một sự ức chế nhẹ được quan sát thấy trong sự tăng trưởng của phân lập SHF1 được điều trị bằng bột Bdellovibrio ở 0,4 mg/ L sau khi điều trị trong 120 giờ. Do đó, 0,8 mg/ L bột Bdellovibrio đã được chọn để kiểm soát A. venetianus gây bệnh.
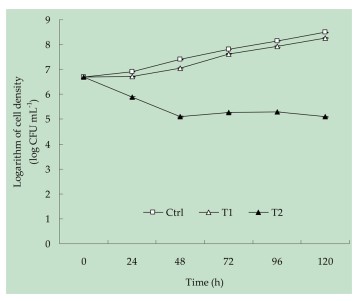
Hình 4. Tác dụng kháng khuẩn của bột Bdellovibrio chống lại phân lập SHF1; Ctrl: 0 mg/ L bột Bdellovibrio; T1: 0,4 mg/ L bột Bdellovibrio; T2: 0.8 mg/ L bột Bdellovibrio. Dữ liệu được trình bày dưới dạng giá trị trung bình ± SD. Bất kỳ sự khác biệt nào quan sát được đều được coi là có ý nghĩa thống kê ở mức P < 0,05 theo thử nghiệm của Duncan.
3.5. Tác dụng bảo vệ của bột Bdellovibrio đối với tôm thẻ chân trắng bị cảm nhiễm với mầm bệnh
Tác dụng bảo vệ của bột Bdellovibrio đối với tôm thẻ chân trắng nhiễm A. venetianus được thể hiện trong Hình 5. Tỷ lệ chết tích lũy của tôm được xử lý bằng 0,8 mg/ L của bột Bdellovibrio thấp hơn 60,0% (P < 0,05) sau cảm nhiễm với phân lập SHF1 so với tỷ lệ đối chứng âm tính, cho thấy tỷ lệ sống tương đối là 72,0% thu được ở tôm đã qua xử lý bột Bdellovibrio sau 6 ngày cảm nhiễm với phân lập SHF1. Tỷ lệ chết của tất cả tôm thử nghiệm là do chủng cảm nghiệm gây ra, được xác định bằng cách phân lập và xác định vi khuẩn (dữ liệu không được hiển thị). Hơn nữa, không quan sát thấy tôm chết ở nhóm tôm đối chứng dương tính được xử lý bằng bột Bdellovibrio (dữ liệu không được hiển thị), cho thấy thêm rằng cái chết của tôm thẻ chân trắng là do A. venetianus gây ra. Dữ liệu chứng minh rằng bột Bdellovibrio với liều 0,8 mg/ L thể hiện sự bảo vệ đáng kể chống lại A. venetianus đáng kể ở P. vannamei.

Hình 5. Tác dụng bảo vệ của bột Bdellovibrio đối với tôm thẻ chân trắng được cảm nhiễm với phân lập SHF1: Ctrl-N. Tôm cảm nhiễm với A. venetianus; T1. Tôm được xử lý bằng bột A. venetianus và Bdellovibrio. Dữ liệu được trình bày dưới dạng giá trị trung bình ± SD. Bất kỳ sự khác biệt nào quan sát được đều được coi là có ý nghĩa thống kê ở mức P < 0,05 theo thử nghiệm của Duncan.
4. Thảo luận
Chi Acinetobacter đã được ghi nhận là mầm bệnh vi khuẩn mới nổi trong nuôi trồng thủy sản, và đã gây ra tỷ lệ chết hàng loạt ở cá chép Cyprinus carpio, cá da trơn Ictalurus punctatus, cá chép lớn Labeo rohita của Ấn Độ, cá tráp mõm cùn Megalobrama amblycephala và cá chép bạc Hypophthalmichthys molitrix (Kozinska ‘ và cộng sự, 2014; Cao và cộng sự, 2016; Behera và cộng sự, 2017; Cao và cộng sự, 2017; Malick và cộng sự, 2020). Tuy nhiên, có rất ít thông tin về nhiễm Acinetobacter venetianus trong nuôi trồng thủy sản. Trong nghiên cứu này, chúng tôi đã xác định A. venetianus đa đề kháng là tác nhân gây ra bệnh đỏ chân ở tôm thẻ chân trắng nuôi nước ngọt và đánh giá tiềm năng của bột Bdellovibrio chống lại A. venetianus gây bệnh. Theo như chúng tôi biết, đây là báo cáo đầu tiên về việc sử dụng bột Bdellovibrio để kiểm soát nhiễm A. venetianus ở tôm thẻ chân trắng nuôi nước ngọt.
Nhìn chung, các chủng phân lập có hoạt tính hemolymh thường có thể gây bệnh do vi khuẩn ở tôm thẻ chân trắng (Flores-Miranda và cộng sự, 2012). Ví dụ, Bacillus cereus với haemolymh đã được xác nhận là mầm bệnh gây bệnh của bệnh đốm trắng ở P. vannamei (Velmurugan và cộng sự, 2015). Hiện nay, biểu hiện của β-haemolysis ở A. venetianus đã thu hút sự chú ý nghiêm trọng (Tayabali và cộng sự, 2012). Trong nghiên cứu này, A. venetianus phân lập SHF1 cho thấy khả năng gây bệnh đỏ chân ở tôm thẻ chân trắng với giá trị LD50 là 3,8 × 105 CFU/ mL, cho thấy A. venetianus cũng có thể là mối đe dọa đối với nuôi tôm He. Điều này có lẽ là do sản xuất các yếu tố độc hại như hemolymh, protein màng ngoài và protein bài tiết (Tayabali và cộng sự, 2012). Ngoài độc lực của A. venetianus, có thể có các yếu tố phụ khác gây ra bệnh này như amoniac, có thể làm tăng tính nhạy cảm của tôm đối với nhiễm khuẩn do suy giảm khả năng miễn dịch (Liu và cộng sự, 2020; Zhang và cộng sự, 2011).
Các loài Acinetobacter đã được chứng minh là có nhiều khả năng kháng nhiều loại thuốc kháng khuẩn, bao gồm penicillin, cephalosporin và tetracycline (Li và cộng sự, 2017; Malick và cộng sự, 2020). Điều này cũng được quan sát thấy ở A. venetianus phân lập SHF1, hơn nữa chỉ ra rằng không nên đánh giá thấp việc kiểm soát mầm bệnh này. Do tác dụng phụ của kháng sinh trong việc kiểm soát mầm bệnh vi khuẩn, bột Bdellovibrio, một chế phẩm sinh học an toàn cho tôm thẻ chân trắng có giá trị LD50 trên 1200 mg/ L (Cao và cộng sự, 2019), được sử dụng để điều trị A. venetianus gây bệnh. Dữ liệu này cho thấy bột Bdellovibrio với liều 0,8 mg/ L cho thấy tác dụng bảo vệ đáng kể chống lại A. venetianus gây bệnh và cho thấy tỷ lệ sống tương đối là 72,0% sau 6 ngày cảm nhiễm với A. venetianus. Điều này có lẽ là do Bdellovibrio và các chất sinh miễn dịch khác từ bột Bdellovibrio có thể tạo ra phản ứng miễn dịch nguyên thủy ở tôm và khiến tôm dễ dàng chống lại nhiễm trùng do vi khuẩn (Cao và cộng sự, 2019).
5. Kết luận
Tóm lại, đây là nghiên cứu đầu tiên xác định A. venetianus là tác nhân tiềm ẩn gây bệnh đỏ chân ở tôm thẻ chân trắng và chứng minh việc sử dụng bột Bdellovibrio như một giải pháp hiệu quả để ngăn ngừa nhiễm trùng A. venetianus. Dữ liệu này có thể cung cấp những hiểu biết mới và hướng quản lý mầm bệnh A. venetianus ở tôm thẻ chân trắng.
Theo Xiaodong Huang, Yin Gu, Huihua Zhou, La Xu, Haipeng Cao, Chunlei Gai
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Nguồn: https://sci-hub.hkvisa.net/10.1016/j.aqrep.2020.100543
Xem thêm:
- Phần 1: Giun Nhiều Tơ (Perinereis helleri) Nuôi Trong Hệ Thống Lọc Cát Giúp Tận Dụng Chất Dinh Dưỡng Từ Nước Thải Ao Nuôi Tôm Sú (Penaeus monodon), Nhưng Mang Rủi Ro Về Mầm Bệnh IHHNV
- Phần 2: Giun Nhiều Tơ (Perinereis helleri) Nuôi Trong Hệ Thống Lọc Cát Giúp Tận Dụng Chất Dinh Dưỡng Từ Nước Thải Ao Nuôi Tôm Sú (Penaeus monodon), Nhưng Mang Rủi Ro Về Mầm Bệnh IHHNV
- Aeromonas schubertii, Một Loại Vi Khuẩn Mới Được Phát Hiện Từ Các Trang Trại Bị Ảnh Hưởng Bởi AHPND, Có Khả Năng Gây Chết Tôm Thẻ Chân Trắng (Penaeus vannamei)

 English
English