Kỹ Thuật Nuôi, Tin tức
Phần 2: Bổ Sung Một Phần Nước Biển Để Cải Thiện Hiệu Suất Tôm Thẻ Chân Trắng Litopenaeus vannamei Trong Các Hệ Thống Biofloc Có Độ Mặn Thấp
Kết quả
Chất lượng nước
Bảng 3 tóm tắt các thông số chất lượng nước được lựa chọn. Ngoại trừ độ dẫn điện, độ mặn và độ cứng tổng, không có sự khác biệt đáng kể nào về các thông số chất lượng nước giữa các nhóm bổ sung nước biển. Đối với ba trường hợp ngoại lệ nêu trên, tất cả các nhóm đều khác nhau về mặt thống kê, cho thấy sự gia tăng các giá trị trung bình theo sự gia tăng tỷ lệ tiêm chủng vào nước biển. Liên quan đến các hợp chất nitơ độc hại, mức TAN tối đa được ghi nhận là 0,28 mg/ L, trong khi NO2 −-N tối đa là 0,89 mg/ L. Đối với NO3–-N, nồng độ tối đa trung bình sau đây (mg/ L) được ghi nhận khi kết thúc thí nghiệm: 0%, 45,25 ± 5,12; 3%, 35,25 ± 13,50; 6%, 36,50 ± 11,39; 10%, 43,00 ± 6,16; và 13%, 40,00 ± 14,88.
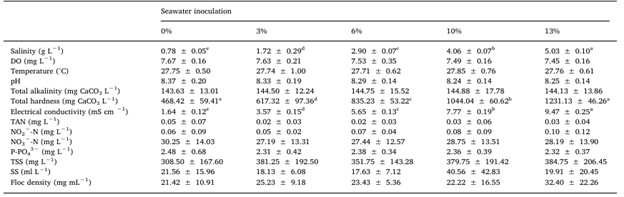
Các chữ cái chỉ số trên khác nhau trong mỗi hàng biểu thị sự khác biệt có ý nghĩa thống kê (p < 0,05).
DO: oxy hòa tan; TAN: tổng nitơ amoniac; NO2−-N: nitrit-nitơ; NO3−-N: nitrat-nitơ; P-PO43−: photphat; TSS: tổng chất rắn lơ lửng; SS: chất rắn lắng được.
Có sự khác biệt thống kê về nồng độ Cl−, Na+, Mg2+ và K+ cũng như tổng nồng độ của các ion chính giữa mỗi nhóm, cho thấy sự gia tăng đáng kể về giá trị trung bình theo sự gia tăng lượng vi khuẩn tiêm vào nước biển. Nồng độ SO4 2− và Ca2+ cho thấy xu hướng tương tự, nhưng không tìm thấy sự khác biệt giữa 13% và 10%, 6% và 10%, và 0% và 3%. Không có sự khác biệt đáng kể về HCO3 − giữa các nhóm tiêm vào nước biển (Bảng 4).
Tỷ lệ Na+:K+ khác nhau về mặt thống kê giữa mỗi nhóm, cho thấy sự gia tăng các giá trị trung bình khi tỷ lệ tiêm chủng vào nước biển tăng lên. Mô hình tương tự cũng được quan sát thấy đối với tỷ lệ Mg2+:Ca2+ và K+:Ca2+. Tuy nhiên, không có sự khác biệt nào được ghi nhận giữa 10% và 13% ở nhóm trước, trong khi 10% và 13%, 6% và 10%, và 3% và 6% không cho thấy sự khác biệt ở nhóm sau (Bảng 4).
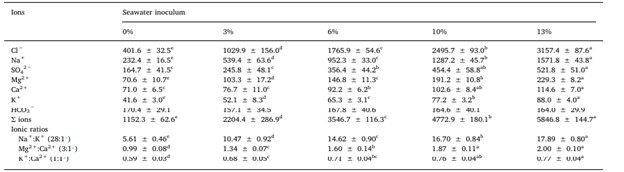
Các chữ cái chỉ số trên khác nhau trong mỗi hàng biểu thị sự khác biệt có ý nghĩa thống kê (p < 0,05).
⁎ Tỷ lệ dự kiến đối với nước biển tự nhiên (Boyd, 2018).
Hiệu suất tăng trưởng
Trọng lượng cuối cùng, tỷ lệ sống, SGR, WGR và năng suất thấp hơn đáng kể ở nhóm Đối chứng, tức là không bổ sung nước biển (0%). Không tìm thấy sự khác biệt thống kê về các thông số này giữa các nghiệm thức (từ 3% đến 13% lượng nước biển bổ sung). Nhóm không bổ sung nước biển cũng cho FCR cao nhất (Bảng 5).
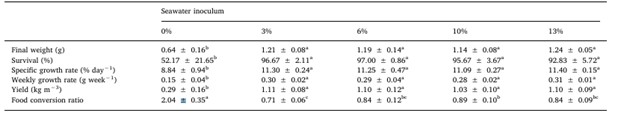
Các chữ cái chỉ số trên khác nhau trong mỗi hàng biểu thị sự khác biệt có ý nghĩa thống kê (p < 0,05).
Thảo luận
Một số tác giả đã báo cáo các trại ương tôm thành công trong hệ thống BFT ở mức 4–5 g/ L (Moreno-Arias và cộng sự, 2016; Zacarias và cộng sự, 2018). Tuy nhiên, khả năng sống sót có thể giảm đáng kể do khả năng diệt khuẩn của NO2− cao hơn ở nồng độ Cl− thấp, ví dụ: nước có độ mặn thấp (Maicá và Borba, 2011; Esparza-Leal và Xavier, 2016). Trong điều kiện này, tôm có xu hướng mất Cl− vào môi trường và do cân bằng nội môi, tôm hấp thụ tích cực NO2− vì cả hai anion đều có cùng thụ thể ở mang. Kết quả là tôm bị thiếu máu chức năng, đặc trưng bởi sự biến đổi cấu trúc của hemocyanin và cuối cùng chết (Cheng và Chen, 2002; Gross và cộng sự, 2004; Romano và Zeng, 2013). Do đó, tỷ lệ chết liên quan đến NO2−-N là một trong những yếu tố hạn chế chính đối với việc thâm canh nuôi L. vannamei ở độ mặn thấp (Furtado và cộng sự, 2016).
Nghiên cứu này sử dụng NH4Cl làm nguồn nitơ vô cơ để phát triển và ổn định quần thể vi khuẩn nitrat hóa trước khi thả tôm giống trong môi trường nước lợ. Chiến lược này đã được báo cáo trong các hệ thống BFT ở độ mặn cao (Ferreira và cộng sự, 2020; Morais và cộng sự, 2020) và ở đây cũng cho thấy hiệu quả trong điều kiện nước lợ. Trên thực tế, TAN và NO2−-N vẫn ở mức an toàn trong tất cả các nhóm thử nghiệm trong suốt thử nghiệm (Gross và cộng sự, 2004; Li và cộng sự, 2007; Ramirez-Rochin và cộng sự, 2016). Tương tự như TAN và NO2−-N, độc tính NO3−-N tăng ở độ mặn thấp hơn và có thể là một trong những yếu tố ảnh hưởng tiêu cực đến tỷ lệ sống ở nhóm đối chứng. Vào cuối thí nghiệm, nồng độ trung bình được ghi nhận là khoảng 45 mg/ L ở mức 0,78 g/ L. Mặc dù mức an toàn NO3 −-N chưa được xác định đối với độ mặn thấp, nhưng nồng độ được ghi nhận gần với mức an toàn được khuyến nghị cho tôm thẻ L. vannamei ở mức 3 và 5 g/ L (tương ứng là 45 và 60 mg/ L).
Đúng như dự đoán, độ mặn và độ dẫn điện khác nhau đáng kể giữa các nhóm tùy theo mức độ bổ sung nước biển tự nhiên tăng lên. Tuy nhiên, sự khác biệt (xem Bảng 3) nằm trong phạm vi của hệ thống phân loại nước có độ mặn thấp (Hệ thống Venice, 1958). Mặt khác, các thông số chất lượng nước được lựa chọn khác không cho thấy sự khác biệt về mặt thống kê (ngoại trừ độ cứng) và cũng nằm trong phạm vi được khuyến nghị cho nuôi tôm (Wyban và cộng sự, 1995; Van Wyk và cộng sự, 1999; Gaona và cộng sự, 2011; Furtado và cộng sự, 2015).
Do nồng độ trung bình của các ion chính trong nước có độ mặn thấp tự nhiên được tìm thấy ở Đông Bắc Brazil được sử dụng làm mô hình để điều chế nước có độ mặn thấp thử nghiệm trong nghiên cứu này, nó cho thấy mức độ pH, độ kiềm và độ cứng cao là đặc điểm tự nhiên của nước và các yếu tố chính cho sự thành công của nghề nuôi tôm ở vùng bán khô hạn đó (Barbosa và cộng sự, 2012; Pessôa và cộng sự, 2016). Độ cứng và độ kiềm liên quan trực tiếp đến nồng độ Ca2+, Mg2+ và HCO3− (Davis và cộng sự, 2004; Boyd và cộng sự, 2016). Ở những vùng bán khô hạn, độ kiềm cao thường liên quan đến trữ lượng CaCO3 tự nhiên, điều này cũng ảnh hưởng đến độ cứng chủ yếu do nồng độ Ca2+ (Pessôa và cộng sự, 2016). Trong nghiên cứu này, sự khác biệt về độ cứng được tìm thấy giữa các nhóm thử nghiệm rất có thể liên quan đến Ca2+ và Mg2+, có nồng độ tăng theo sự gia tăng lượng nước biển tiêm vào. Tuy nhiên, không tìm thấy sự khác biệt về độ kiềm do bổ sung Ca(OH)2 để đạt mục tiêu 150 mg CaCO3 /L, phản ánh cả nồng độ HCO3 −, điều này không cho thấy sự khác biệt thống kê giữa các nhóm nước có độ mặn thấp.
Tương tự như HCO3–, nồng độ Ca2+ có sự thay đổi giả tạo khi bổ sung Ca(OH)2. Điều này được chứng minh qua việc nồng độ Ca2+ tăng ở tất cả các nhóm thí nghiệm so với nồng độ trong nước ban đầu (bảng 1 và 4). Kết quả này cho thấy việc điều chỉnh độ kiềm trong hệ thống nước lợ bằng biofloc nên sử dụng Ca(OH)2 làm nguồn cung cấp ion Ca2+. Canxi đóng vai trò quan trọng trong sự phát triển vỏ ngoài và ảnh hưởng trực tiếp đến tăng trưởng của tôm (Li và Cheng, 2012). Ngoài ra, Ca(OH)2 còn có ưu điểm là rẻ hơn so với các tác nhân kiềm hóa khác như natri cacbonat và natri bicarbonate (Furtado và cộng sự, 2011). Mendes và cộng sự (2006) cũng báo cáo rằng nồng độ Ca2+ cao nhất trong hệ thống nước ngọt giúp tôm thẻ chân trắng L. vannamei có tỷ lệ sống và tăng trưởng cao hơn. Tuy nhiên, nghiên cứu này không ghi nhận sự khác biệt về các chỉ tiêu nuôi trồng thủy sản giữa các nghiệm thức mặc dù nồng độ Ca2+ thấp nhất ở nghiệm thức 3% so với 6%, 10% và 13%. Mặt khác, nồng độ Ca2+ tương tự cũng được quan sát thấy trong khoảng từ 0% đến 3%; nhưng hiệu suất tăng trưởng cao hơn đã được ghi nhận trong nghiệm thức với tỷ lệ bổ sung nước biển tối thiểu so với nhóm đối chứng. Điều này cho thấy rằng nồng độ Ca2+ trong môi trường thí nghiệm có thể không bị ảnh hưởng bởi việc bổ sung Ca(OH)2 trong suốt thời gian nghiên cứu.
Tương tự như Ca2+, nồng độ SO4 2- cũng có xu hướng tăng khi lượng vi khuẩn trong nước biển tăng lên. Lý do là vì SO42- là ion phổ biến thứ ba trong nước biển, nhưng lại khan hiếm trong nước ngầm (Goldberg, 1963; Boyd và cộng sự, 2007). Khác với Ca2+ có nồng độ bị ảnh hưởng bởi việc điều chỉnh độ kiềm, sự khác biệt nồng độ SO42- giữa các nhóm thí nghiệm (ví dụ: 0 và 3%, 6 và 10% và 10 và 13%) có thể do các nguyên nhân sinh học và/hoặc hóa học tự nhiên. SO4 2- là sản phẩm của quá trình phân hủy protein ở các loài giáp xác biển và được bài tiết qua tuyến râu (Bradley, 2009; He và cộng sự, 2013). Lưu huỳnh (S) từ chất hữu cơ được khoáng hóa thành sunfua (S2-) và sau đó bị oxy hóa thành SO42- trong điều kiện hiếu khí (Boyd, 2015). Do hệ thống nuôi trồng biofloc giàu chất hữu cơ và oxy, SO42- có xu hướng tích lũy và thường được tìm thấy ở dạng oxy hóa mạnh nhất, axit sulfuric (H2SO4) (Sarti và cộng sự, 2008; Timmons và Ebeling, 2010; Boyd, 2015).
Nồng độ Cl–, Na+, Mg2+ và K+ trong hệ thống nuôi trồng thủy sản biofloc phản ánh tỷ lệ ion có sẵn trong nước biển tự nhiên. Sự khác biệt về thành phần ion giữa các nhóm thí nghiệm có thể được giải thích bởi hai lý do chính: (1) Cl− và Na+ là những ion có nhiều nhất trong nước biển (Goldberg, 1963); và (2) Mg2+ và K+ thường khan hiếm ở vùng nước nội địa (Roy và cộng sự, 2007, 2010; Wudtisin và Boyd, 2011; Valenzuela-Madrigal và cộng sự, 2017), điều này cũng được quan sát thấy ở vùng nước có độ mặn thấp tự nhiên phục vụ làm mẫu cho nước thí nghiệm được sử dụng trong nghiên cứu này. Những khác biệt này rõ ràng đã ảnh hưởng đến tỷ lệ Na+:K+. Điều quan trọng cần lưu ý là giá trị trung bình của tỷ lệ này được ghi ở 0 và 3% thấp hơn giá trị được tìm thấy trong nước thử nghiệm, tức là 14:1 (xem Bảng 1 và 4). Mức giảm này rất có thể liên quan đến việc sử dụng mật mía trong quá trình điều chế nước có độ mặn thấp có ưu thế biofloc (xem phần 2.3). Mật đường rất giàu K+ và chứa nồng độ Na+ thấp (Nogueira và cộng sự, 2009). Một giả thuyết khác cần được xem xét là tỷ lệ trong nước cũng bị ảnh hưởng bởi tỷ lệ Na+:K+ trong thức ăn thấp (khoảng 0,2:1), như mô tả của nhà sản xuất. Do đó, các nghiệm thức khác (6, 10 và 13%) không cho thấy mức giảm này do lượng Na+ đầu vào từ nước biển tự nhiên cao nhất.
Hiệu suất tăng trưởng của tôm L. vannamei được nuôi ở nhiều tỷ lệ Na+:K+ đã được báo cáo trước đây trong tài liệu. Ví dụ, Zhu và cộng sự (2004) phát hiện ra rằng cá con được nuôi ở mức 30 g/ L và tỷ lệ 20:1 (giá trị được chuyển đổi từ tỷ lệ mol Na+:K+) tiêu tốn phần trăm năng lượng cao nhất cho tăng trưởng và ít hơn cho hô hấp và bài tiết. Tuy nhiên, các tác giả đã báo cáo trọng lượng cuối cùng tương tự so với tỷ lệ thấp hơn, chẳng hạn như 15:1. Đối với nuôi L. vannamei ở độ mặn dưới 5 g/ L, kết quả tốt hơn đã được báo cáo khi tỷ lệ gần hoặc cao hơn tỷ lệ tìm thấy trong môi trường tự nhiên (tức là 28:1), ví dụ: 23:1 (Liu và cộng sự, 2016), 29:1 (Roy và cộng sự, 2007) và 40:1 (Perez-Velazquez và cộng sự, 2012). Mặc dù tỷ lệ dưới 20:1 là phổ biến ở vùng nước có độ mặn thấp nội địa (Jaime-Ceballos và cộng sự, 2012; Pessôa và cộng sự, 2016; ValenzuelaMadrigal và cộng sự, 2017), nhưng rất ít báo cáo về ảnh hưởng của nó đến hiệu suất tăng trưởng của tôm. Trong nghiên cứu hiện tại, tất cả các tỷ lệ đều dưới 20:1, nhưng việc bổ sung nước biển tối thiểu (tỷ lệ khoảng 10:1) mang lại hiệu suất tăng trưởng cao hơn so với đối chứng (tỷ lệ khoảng 5:1).
Tỷ lệ Mg 2+:Ca 2+ và K+:Ca2+ ở tất cả các nhóm thí nghiệm đều thấp hơn so với tỷ lệ trong nước biển (lần lượt là 3:1 và 1:1). Nồng độ thấp nhất được ghi nhận ở nhóm đối chứng, cũng là nhóm có hiệu suất tăng trưởng và tỷ lệ sống thấp nhất. Tuy nhiên, tỷ lệ Mg 2+:Ca2+ và K+:Ca 2+ trong tất cả các nhóm thí nghiệm (bao gồm cả nhóm 0%) đều cao hơn mức tối thiểu được khuyến nghị bởi Roy và cộng sự (2007) để duy trì tỷ lệ sống của tôm thẻ chân trắng (L. vannamei) ở độ mặn 4 g/L. Các nhóm thí nghiệm (3, 6, 10 và 13%) mặc dù có tỷ lệ ion và độ mặn thấp hơn nước biển tự nhiên nhưng lại cho kết quả nuôi tương tự như một số nghiên cứu khác sử dụng hệ thống BFT với nước biển tự nhiên không pha loãng (Esparza-Leal và Cardozo, 2015; Esparza-Leal và Xavier, 2016; Serra và cộng sự, 2015; Wasielesky Jr. và cộng sự, 2013). Kết quả nghiên cứu chứng minh khả năng ương nuôi tôm thẻ chân trắng (L. vannamei) trong hệ thống BFT ở độ mặn thấp hơn 2 g/L..
Ngoài tỷ lệ các ion chính, hiệu suất tăng trưởng cao hơn ở nhóm sử dụng ít nước biển nhất (3%) có thể được giải thích bởi sự hiện diện của các nguyên tố vi lượng trong nước biển tự nhiên, vốn không có trong công thức nước thí nghiệm. Một số nguyên tố vi lượng là ion thiết yếu cho sự phát triển và sinh tồn của tôm thẻ chân trắng (L. vannamei) trong các hệ thống nuôi trồng muối nhân tạo và nuôi trồng khép kín (Kuhn và cộng sự, 2007; Prangnell và cộng sự, 2016). Các nguyên tố này bao gồm kẽm, đồng, sắt và mangan. Chúng thường liên kết với các ion có điện tích trái dấu, có nồng độ cao hơn hoặc không hòa tan trong nước, và hiện diện trong tất cả các sinh vật sống (Boyd, 2015). Nguyên tố vi lượng có thể thu được từ các nguồn thực phẩm tự nhiên, ví dụ như vi sinh vật trong hệ thống biofloc. Điều này cho thấy tiềm năng của hệ thống biofloc trong nuôi tôm nội địa.
Liên quan đến việc sử dụng phương pháp bổ sung nước biển thương mại, việc vận chuyển nó có thể là một giải pháp thay thế, tính khả thi của nó dựa trên mối quan hệ đặc tính biofloc giữa lượng nước thấp cần thiết để đạt năng suất cao và phụ thuộc vào khoảng cách từ trang trại đến biển. Nước biển có thể được cô đặc đến độ mặn tối đa 250 g/L mà không cần kết tủa muối (Roy và cộng sự, 2010). Điều này cho phép sử dụng ít nước hơn để đạt được độ mặn mong muốn cho hệ thống nuôi trồng thủy sản biofloc. Việc sử dụng nước muối có thể làm giảm lượng nước bổ sung cần thiết từ 3% (30 L/m3) xuống còn khoảng 0,42% (4,2 L/m3). Tuy nhiên, các hạn chế về môi trường và pháp lý của mỗi quốc gia cũng như các khía cạnh về an toàn sinh học phải được xem xét.
Kết luận
Trong nghiên cứu này, việc bổ sung nước biển ở mức 3% là một chiến lược hiệu quả để giảm thiểu tác động tiêu cực của sự mất cân bằng ion đến hiệu suất tăng trưởng của tôm thẻ L. vannamei được nuôi trong hệ thống nước lợ chủ yếu là biofloc.
Theo Plácido Soares de Mouraa, Wilson Wasielesky Jra, Fabiane da Paz Serraa, André Braga, Luís Poersch
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Các Nghiên Cứu Mới Xác Nhận Tính Khả Thi Của Các Phương Pháp Cải Tiến Để Xử Lý Nước Thải Nuôi Trồng Thủy Sản
- Protein Loại Metallothionein Và Mức Dự Trữ Năng Lượng Sau Khi Tiếp Xúc Với Ni Và Pb Ở Tôm Thẻ Chân Trắng Penaeus vannamei
- Thông Số Chất Lượng Nước Thường Bị Bỏ Qua: pH

 English
English