Kỹ Thuật Nuôi, Tin tức
Phần 1: Ảnh Hưởng Của Khẩu Phần Thủy Phân Đầu Cá Ngừ Đến Tỷ Lệ Sống Và Tăng Trưởng Của Tôm Thẻ Chân Trắng Penaeus Vannamei
Tóm tắt
Nghiên cứu này nhằm đánh giá tác động của việc bổ sung chất thủy phân từ đầu cá ngừ đến tỷ lệ sống và tăng trưởng của tôm thẻ chân trắng (Penaeus vannamei). Thí nghiệm được thực hiện trên 11 nhóm tôm, mỗi nhóm gồm 30 con với trọng lượng trung bình 4,34g. Mỗi nhóm được nuôi trong ba bể thể tích 150 lít và được cho ăn theo một trong 11 khẩu phần khác nhau: Một khẩu phần đối chứng chứa bột đầu cá ngừ với 40% protein thô; chín khẩu phần thay thế 50% bột đầu cá ngừ bằng protein cá thủy phân (FPH), thu được sau 2, 3 hoặc 6 giờ thủy phân, một khẩu phần thương mại được sử dụng để so sánh. FPH được phân thành protein hòa tan (DS) và protein không hòa tan (DI). 3 khẩu phần ăn chứa DS thu được sau 2, 3, 6 giờ thủy phân (DS2, DS3, DS6). 3 khẩu phần ăn chứa DI thu được sau 2, 3, 6 giờ thủy phân (DI2, DI3, DI6). 3 khẩu phần ăn chứa hỗn hợp DS và DI thu được sau 2, 3, 6 giờ thủy phân (DM2, DM3, DM6). Sau 6 tuần nuôi, các chỉ tiêu kỹ thuật như tỷ lệ sống, tăng trưởng, hệ số chuyển hóa thức ăn (FCR) và hiệu quả sử dụng protein (PER) được ghi nhận và so sánh. Kết quả cho thấy các khẩu phần chứa DS (DS2, DS3, DS6) và DI2 giúp cải thiện rõ rệt tỷ lệ sống, tăng trọng, FCR và PER so với khẩu phần đối chứng. Trong khi đó, các khẩu phần chứa hỗn hợp DS và DI (DM2, DM3, DM6) không mang lại hiệu quả cao hơn, thậm chí có kết quả thấp hơn so với đối chứng và khẩu phần thương mại. Kết luận, việc tách riêng protein hòa tan và không hòa tan từ đầu cá ngừ sau quá trình thủy phân có ảnh hưởng tích cực đến hiệu quả nuôi tôm thẻ chân trắng.
Giới thiệu
Nguồn protein có nguồn gốc từ biển đóng vai trò thiết yếu trong công thức thức ăn thương mại dành cho tôm. Trong đó, bột cá và bột mực là hai thành phần chính, được ưa chuộng nhờ chứa hàm lượng cao các axit amin thiết yếu, axit béo, vitamin và khoáng chất. Hiện nay, ngành nuôi tôm vẫn phụ thuộc nhiều vào việc bổ sung bột cá để đáp ứng nhu cầu protein cho tôm. Một khảo sát toàn cầu thực hiện vào năm 2006 tại 50 quốc gia cho thấy, ngành nuôi trồng thủy sản đã tiêu thụ khoảng 3.724 nghìn tấn bột cá, trong đó phần lớn được sử dụng cho thức ăn tôm biển và cá hồi (Tacon & Metian, 2008). Tuy nhiên, nghiên cứu này cũng dự báo rằng việc sử dụng bột cá trong tương lai sẽ dần giảm do nguồn cung từ khai thác biển ngày càng hạn chế. Đồng thời, sự phổ biến của các nguồn protein thay thế từ thực vật và động vật với chi phí thấp hơn cũng đang gia tăng. Do đó, ngành nuôi trồng thủy sản cần từng bước giảm sự phụ thuộc vào bột cá và hướng đến các giải pháp thay thế bền vững hơn, chẳng hạn như tận dụng phụ phẩm cá làm nguồn cung protein hoặc lipid trong thức ăn thủy sản.
Chất thủy phân protein cá được xem là một giải pháp tiềm năng để thay thế hoặc bổ sung cho bột cá trong khẩu phần thức ăn thủy sản. Với giá trị dinh dưỡng cao và đặc tính chức năng ưu việt, loại nguyên liệu này đã được ứng dụng rộng rãi như một nguồn bổ sung protein, chất dẫn dụ hoặc tăng cường khẩu vị trong thức ăn nuôi trồng thủy sản (Aguila và cộng sự, 2007; Hardy, 1991). Quá trình thủy phân protein cá bằng enzyme diễn ra trong điều kiện ôn hòa, giúp tạo ra sản phẩm giàu chức năng, có đặc tính cảm quan tốt và giá trị dinh dưỡng vượt trội, đồng thời không hình thành các hợp chất gây hại (Kristinsson và Rasco, 2000).
Ngoài các đặc tính chức năng, nhiều nghiên cứu đã chỉ ra rằng thủy phân protein cá còn có các hoạt động sinh học như chống oxy hóa, hạ huyết áp và kháng khuẩn (Klompong và cộng sự, 2007; Thiansilakul và cộng sự, 2007). Bổ sung thủy phân protein cá vào khẩu phần ăn đã được chứng minh là giúp cải thiện hiệu quả tăng trưởng và sử dụng thức ăn (về hiệu quả protein và khả năng lưu giữ chất dinh dưỡng) ở cá hồi (Berge và Storebakken, 1996; Refstie và cộng sự, 2004) và ấu trùng cá chép (Carvalho và cộng sự, 1997). Nhiều nghiên cứu về sự phát triển của ấu trùng cá cho thấy việc bổ sung thủy phân protein cá giúp cải thiện cả sự tăng trưởng và phát triển hệ tiêu hóa (Cahu và cộng sự, 1999; Day và cộng sự, 1997; Zambonino-Infante và cộng sự, 1997). Trong lĩnh vực nuôi giáp xác, Anggawati và cộng sự (1990) đã thử nghiệm bổ sung thủy phân cá vào thức ăn cho tôm sú (Penaeus monodon) và nhận thấy rằng thay thế 3% bột cá bằng thủy phân cá đã thúc đẩy sự phát triển của tôm.
Nghiên cứu này nhằm mục đích đánh giá khả năng sử dụng thủy phân protein từ đầu cá ngừ vây vàng trong thức ăn cho tôm thẻ chân trắng (Penaeus vannamei) và so sánh hiệu quả chăn nuôi, bao gồm tỷ lệ sống, tăng trọng, tỷ lệ chuyển hóa thức ăn và tỷ lệ hiệu quả protein, giữa các nhóm tôm được cho ăn thức ăn có chứa hàm lượng thủy phân protein khác nhau.
Chuẩn bị nghiên cứu
Thành phần protein khẩu phần ăn
Cá ngừ vây vàng (Thunnus albacares) được đánh bắt ở Thái Bình Dương vào tháng 4 năm 2008 và được phi lê tại Công ty chế biến hải sản Hải Vương ở Nha Trang, Việt Nam. Đầu cá ngừ được thu thập, đông lạnh và vận chuyển đến Đại học Nha Trang để sử dụng làm nguyên liệu sản xuất bột cá và dịch thủy phân cá.
Đầu cá ngừ được băm nhỏ và trộn đều với nước cất theo tỷ lệ 1:1. Sau đó, hỗn hợp được thủy phân bằng enzyme Protamex do Novozymes AS (Đan Mạch) cung cấp với tỷ lệ enzyme 0,5% so với khối lượng đầu cá. Quá trình thủy phân được thực hiện ở 45°C và pH tự nhiên của nguyên liệu (pH ban đầu = 6,5) trong 2, 3 và 6 giờ. Để dừng phản ứng phân giải protein, hỗn hợp được duy trì ở 95°C trong 15 phút để vô hiệu hóa enzyme. Sau đó, hỗn hợp được lọc để tách xương. Dịch lọc thu được được ly tâm ở 10.000×g và 4°C trong 30 phút.
Do đó, 2 loại sản phẩm protein được sản xuất từ đầu cá ngừ vây vàng. Bột protein hòa tan: S2, S3 và S6 được sản xuất bằng cách đông khô pha hòa tan sau 2, 3 và 6 giờ thủy phân. Bột protein không hòa tan: I2, I3 và I6 được sản xuất bằng cách sấy khô bùn rắn ở 40°C sau 2, 3 và 6 giờ thủy phân. Ngoài ra, một loại bột protein khác (M2, M3 và M6) được sản xuất bằng cách đông khô dịch lọc sau khi vô hoạt enzyme bằng nhiệt mà không ly tâm.
Cả chín loại bột protein này được sử dụng để thay thế một phần bột cá từ đầu cá ngừ vây vàng trong khẩu phần ăn của tôm. Bột cá là thành phần chính trong khẩu phần ăn, cùng với bột đậu nành, cám gạo và lúa mì. Bột cá được lấy trực tiếp từ đầu cá ngừ vây vàng, và ba thành phần thực vật được cung cấp bởi công ty Long Hiệp, một công ty sản xuất thức ăn cho nuôi tôm tại Nha Trang, Việt Nam. Thành phần dinh dưỡng của các thành phần protein trong khẩu phần được đưa vào mỗi khẩu phần được nêu trong Bảng 1.
Bảng 1 Thành phần dinh dưỡng của các thành phần protein trong khẩu phần (% chất khô).
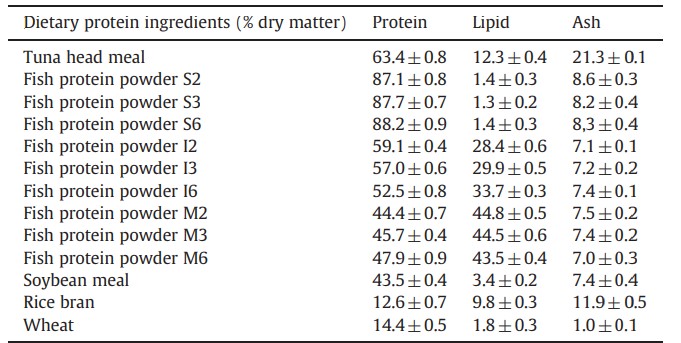
Các giá trị được báo cáo có ý nghĩa của ba lần lặp lại.
Khẩu phần ăn thử nghiệm
Mười khẩu phần ăn chứa 40% protein thô (khối lượng khô) được thiết kế để đánh giá hiệu quả của các loại bột protein từ đầu cá ngừ vây vàng. Khẩu phần đối chứng (CD) sử dụng bột đầu cá ngừ làm nguồn protein chính. 9 khẩu phần còn lại thay thế 50% bột đầu cá ngừ bằng các loại bột protein khác nhau, như được trình bày trong Bảng 2. Bột protein hòa tan: DS2 (S2), DS3 (S3), DS6 (S6). Bột protein không hòa tan: DI2 (I2), DI3 (I3), DI6 (I6). Hỗn hợp bột protein: DM2 (M2), DM3 (M3), DM6 (M6). Tất cả các khẩu phần đều chứa 15% bột đậu nành, 10% cám gạo và 3% hỗn hợp khoáng chất và vitamin. Thành phần chi tiết của mười khẩu phần ăn được trình bày trong Bảng 2. Kích thước viên thức ăn là 2 mm và được bảo quản ở 4°C cho đến khi sử dụng. Thành phần dinh dưỡng và thành phần axit amin của mỗi khẩu phần được trình bày tương ứng trong Bảng 3 và 4.
Bảng 2 Thành phần của các khẩu phần thí nghiệm (% chất khô)
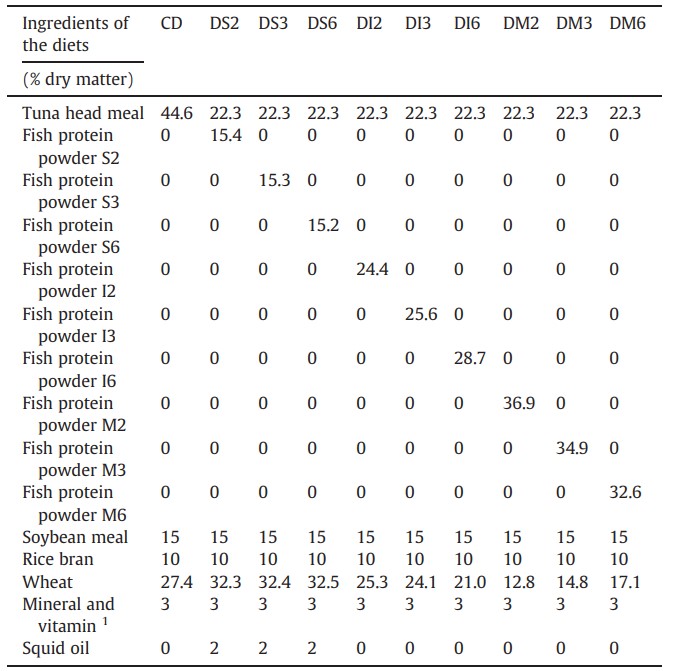
1 Mỗi kg hỗn hợp khoáng chất và vitamin: Vitamin A: 1000000 UI, Vitamin D3: 300000 UI, Vitamin E: 2000 mg, Vitamin K3: 500 mg, Vitamin B1: 500 mg, Vitamin B2: 320 mg, Niacine: 2000 mg, Vitamin B6: 500 mg, Inositol: 10000 mg, Biotine: 20 mg, Axit folic: 200 mg, D-Calpan: 2500 mg, Vitamin B3: 5 mg, Vitamin B12: 5 mg, Vitamin C: 10000 mg, Phốt pho: 10000 mg, Canxi: 8000 mg, Kẽm: 5000 mg, Mangan: 2000 mg, Magiê: 750 mg, Choline clorua: 5000 mg, Coban: 50 mg, Selen: 50 mg, Iốt: 20 mg.
Thử nghiệm cho ăn
Tôm được chọn cho ăn thử nghiệm thuộc loài Penaeus vannamei, được sử dụng trong thí nghiệm có trọng lượng trung bình 4,34± 0,08 g và được cung cấp bởi Trung tâm Nghiên cứu Nuôi trồng Thủy sản của Đại học Nha Trang (Việt Nam).
Thử nghiệm cho ăn được thực hiện tại Đại học Nha Trang trong 6 tuần để xác định ảnh hưởng của các khẩu phần ăn thử nghiệm đó đến tỷ lệ sống và tăng trưởng của tôm và so sánh với khẩu phần ăn thương mại (RD) do công ty Uni-President (Việt Nam) cung cấp được sử dụng làm khẩu phần ăn tham khảo.
Thử nghiệm cho ăn này được thực hiện bằng 33 bể có dung tích 150 L (50×60×50 cm). Những bể này được lắp đặt trong hệ thống tuần hoàn nước bao gồm bể lắng, bộ lọc sinh học và máy bơm. Khi bắt đầu thí nghiệm, 11 nhóm tôm (30 con/bể) được phân ngẫu nhiên vào các bể. Mỗi khẩu phần thức ăn được thử nghiệm trên 3 bể và được cho ăn 2 lần/ngày vào lúc 8h và 17h với lượng thức ăn cố định 5% trọng lượng tôm ban đầu. Tôm được cho ăn bằng tay 2 lần/ngày vào lúc 8h và 17h. Ở mỗi lần cho ăn, khẩu phần tương ứng với từng bể được chia trên một khay cho ăn có đường kính 30 cm. Các khay cho ăn được lấy ra 3 giờ sau mỗi lần cho ăn và thức ăn thừa được thu gom riêng biệt khỏi mỗi bể và đông lạnh ở -20°C. Khi kết thúc thí nghiệm, thức ăn thừa của mỗi bể được sấy khô ở 105°C cho đến khi đạt khối lượng không đổi và sau đó cân.
Trọng lượng tôm được đo 3 tuần một lần. Dựa trên kết quả đo, khẩu phần thức ăn hàng ngày cho mỗi bể được điều chỉnh lại để đảm bảo lượng thức ăn cung cấp cho tôm luôn là 5% tổng trọng lượng tôm trong bể.
Tất cả các bể chứa được làm sạch hàng ngày bằng cách hút các chất thải tích lũy. Trong thời gian thí nghiệm, nhiệt độ nước dao động từ 27 đến 29°C, oxy hòa tan dao động từ 5 đến 6,5 mg/L, độ mặn dao động từ 23 đến 26‰, pH dao động từ 7 đến 8.
Tỷ lệ sống và các thông số tăng trưởng
Tỷ lệ sống được tính bằng tỷ lệ giữa số lượng tôm sống sót sau thí nghiệm và số lượng tôm ban đầu. Mức tăng trọng tuyệt đối (AWG) được tính bằng cách lấy trọng lượng trung bình của tôm sau thí nghiệm trừ đi trọng lượng trung bình ban đầu. Mức tăng trọng tương đối (RWG) được tính bằng cách chia AWG cho trọng lượng trung bình ban đầu.
Bên cạnh việc tăng trọng, các thông số liên quan đến tăng trưởng khác đã được xác định để đánh giá cả việc sử dụng thức ăn của tôm (lượng thức ăn FI) và ảnh hưởng của lượng thức ăn ăn vào đến tăng trọng (tỷ lệ chuyển đổi thức ăn FCR và tỷ lệ hiệu quả protein PER). Vì khẩu phần được ngâm trong nước trong quá trình thử nghiệm nên các thử nghiệm độ ổn định của nước đã được thực hiện để tính đến sự mất đi chất khô (LDM) và mất protein thô (LCP) trong quá trình thử nghiệm. thí nghiệm được thực hiện như sau: 5 g thức ăn viên cho mỗi khẩu phần được cho vào bình 200 mL chứa nước muối (độ mặn 25‰), bình được lắc nhẹ (30 vòng/phút) ở 28°C để mô phỏng các điều kiện động lực học ở đáy bể nuôi. Sau 3 giờ, chất lơ lửng còn lại được thu hồi bằng cách lọc dung dịch muối qua vải lưới 1 mm. Chất giữ lại sau đó được sấy khô ở 105°C cho đến khi thu được khối lượng không đổi.
Mức độ hao hụt chất khô (LDM) và mức độ hao hụt protein thô (LCP) trong quá trình ngâm thức ăn được tính toán dựa trên các phương trình sau (Cruz-Suárez và cộng sự, 2001):
%LDM = [( DWi – DWf) / Dwi] x 100
trong đó DWi và DWf lần lượt là trọng lượng khô của thức ăn trước và sau khi ngâm Mức độ hao hụt chất khô thu được từ phần trăm protein thô của thức ăn khô khi bắt đầu thí nghiệm (được ký hiệu là % Pi) và của phần thức ăn còn lại sau khi ngâm (cũng ở dạng khô), được ghi chú là %Pf.
%LCP = [%Pi x 100−% Pf x (100 − %LDM)]/%Pi
Lượng thức ăn ăn vào của tôm trong các thử nghiệm được ước tính bằng chênh lệch giữa trọng lượng khô của thức ăn được cung cấp ban đầu và trọng lượng khô của thức ăn thừa còn lại trong khay cho ăn sau 3 giờ thử nghiệm. Sự khác biệt này được chia cho số lượng tôm trong mỗi bể, do đó thu được hệ số lượng thức ăn FI (Refstie và cộng sự, 2004). Thông số này được hiệu chỉnh để trừ đi sự hao hụt chất khô trong quá trình ngâm, theo phương trình:
FIadj = FI x (1 – LDM/100)
Lượng thức ăn ăn vào của tôm có liên quan đến mức tăng trọng tuyệt đối (AWG) của chúng thông qua Tỷ lệ chuyển đổi thức ăn (Hernández và cộng sự, 2008).
FCR = FIadj/(AWG)
Cuối cùng, Tỷ lệ Hiệu quả Protein (PER) được tính bằng khối lượng tăng trọng tuyệt đối trên khối lượng protein tiêu thụ.
PER = AWG/[( lượng chất đạm x (1 −LCP/100 )]= AWG/[(Fi x Pi x (1- LCP/100)]
Phân tích hóa học
Thành phần dinh dưỡng của nguyên liệu thô và khẩu phần thử nghiệm được xác định theo các phương pháp chính thức được Hiệp hội các nhà hóa học phân tích chính thức (AOAC) công nhận.
Độ ẩm và hàm lượng khoáng chất được xác định bằng trọng lượng bằng cách nung mẫu ở nhiệt độ tương ứng là 105°C và 600°C (AOAC, 1990). Hàm lượng protein thô được tính bằng phương pháp Kjeldahl, sử dụng hệ số chuyển đổi là 6,25. Lipid được chiết xuất và định lượng theo phương pháp được mô tả bởi Folch và cộng sự (1957). Hàm lượng chất xơ thô được xác định là cặn hữu cơ còn lại sau khi xử lý tuần tự các mẫu bằng axit và kiềm (AOAC, 1990).
Chiết xuất không chứa nitơ (NFE) được tính bằng chênh lệch so với thành phần dinh dưỡng của nó, theo phương trình (Sudaryono và cộng sự, 1996):
%NFE = 100− (% protein + % lipid + % tro + % chất xơ thô)
Thành phần axit amin được xác định theo một nghiên cứu trước đó (Kechaou và cộng sự, 2009). Các mẫu được thủy phân với 200 μL HCl 6 N trong môi trường nitơ ở 118°C trong 18 giờ. Sau đó, các mẫu được làm khô hoàn toàn trong môi trường khí nitơ và sau đó được pha loãng bằng cách thêm 2,5 mL nước. Phân tích axit amin được thực hiện bằng quy trình EZ:faast™ (Phenomenex, Hoa Kỳ) bao gồm bước chiết pha rắn, sau đó là tạo dẫn xuất và chiết lỏng/lỏng. Một phần dịch từ pha hữu cơ được phân tích trên hệ thống GC-FID (Perkin Elmer Autosystem XL).
Sự phân bố trọng lượng phân tử của peptide trong dịch thủy phân được phân tích bằng sắc ký lọc gel (Nguyen và cộng sự, 2011). Các phần trọng lượng phân tử được phân tách bằng hệ thống sắc ký lỏng hiệu năng cao (HPLC) được trang bị cột loại trừ kích thước (Superdex Peptide 10/300 GL, GE Healthcare UK Ltd, Chalfont, UK). Pha động gồm nước với axit trifluoroacetic 0,1% và acetonitril 0,5% (70:30), tốc độ dòng là 0,5 mL/phút. Sắc ký được theo dõi bằng cách đo độ hấp thụ ở bước sóng 214 nm. Cột được hiệu chuẩn với các chất chuẩn: ribonuclease A (13 700 Da), aprotinin (6500 Da), renin (1760 Da), vasopressine (1084 Da) và leucine (294 Da). Phạm vi trọng lượng phân tử của các phần khác nhau được dựa trên thời gian lưu của các phần được thu thập và được xác định từ đường cong chuẩn.
Phân tích thống kê
Một chương trình thống kê (SPSS, SPSS Inc., Chicago, IL, USA) đã được sử dụng để xử lý dữ liệu và phân tích thống kê. Dữ liệu được phân tích phương sai (ANOVA). Thử nghiệm đa phạm vi của Duncan là một quy trình so sánh nhiều lần được sử dụng để xác định sự khác biệt đáng kể giữa các nghiệm thức (Tang và cộng sự, 2008). Sự khác biệt được coi là có ý nghĩa ở mức P<0,05.
…Còn tiếp…
Theo Huong Thi My Nguyen, Raúl Pérez-Gálvez, Jean Pascal Bergé
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital

 English
English