Kỹ Thuật Nuôi, Tin tức
Ảnh Hưởng Của Tăng Thân Nhiệt Đến Phản Ứng Miễn Dịch Của Tôm Thẻ Chân Trắng Bị Nhiễm IMNV
Tóm tắt
Mục đích của nghiên cứu này là xác định ảnh hưởng của tăng thân nhiệt đến phản ứng miễn dịch của tôm bị nhiễm IMNV. Tôm thẻ chân trắng đã được cảm nhiễm với IMNV và được nuôi ở nhiệt độ lần lượt là 30°C (Sk30), 31°C (S31), 32°C (S32) và 33°C (S33). Nhóm tôm đối chứng không nhiễm IMNV được nuôi ở nhiệt độ 30℃. Trong quá trình nghiên cứu, các phép đo phản ứng miễn dịch của tôm là tổng số lượng tế bào máu (THC), tỷ lệ bạch cầu (DHC), hoạt động bùng nổ hô hấp (RB) và hoạt động Phenoloksidase (PO). Nhìn chung, kết quả cho thấy phản ứng của tôm giảm cùng với tình trạng tăng thân nhiệt. Tôm bị nhiễm IMNV có đáp ứng miễn dịch giảm mạnh, đặc biệt ở nhiệt độ 32°C và 33°C.
Giới thiệu
Tôm là mặt hàng chủ lực của ngành nuôi trồng thủy sản Indonesia, đóng góp 34,83% giá trị xuất khẩu thủy sản năm 2020 (KKP, 2020). Tổng sản lượng thủy sản năm 2020 đạt 851,6 nghìn tấn, ngành này đặt mục tiêu đạt sản lượng 2 triệu tấn vào năm 2024 (KKP, 2022). Tuy nhiên, ngành nuôi tôm Indonesia đang phải đối mặt với 2 thách thức lớn là điều kiện môi trường và tỷ lệ mắc bệnh. Những thay đổi về môi trường có thể làm tăng nguy cơ xuất hiện bệnh tật (Kurniawati & Pursetyo, 2021), ví dụ như trong đợt bùng phát Virus hoại tử cơ (IMNV) do sự thay đổi mạnh mẽ về nhiệt độ (Sunarto và cộng sự, 2016).
Virus hoại tử cơ truyền nhiễm (IMNV) là một loại bệnh gây hại nghiêm trọng đến sản xuất nuôi tôm thẻ chân trắng (Hidayat và cộng sự, 2019). Bệnh này được báo cáo lần đầu tiên ở Brazil vào năm 2002 và sau đó lan rộng sang Indonesia vào năm 2007. Thiệt hại kinh tế do IMNV gây ra là do tỷ lệ chết cao và tỷ lệ chuyển hóa thức ăn tăng lên (Flegel và cộng sự, 2008). Tỷ lệ chết do IMNV có thể lên tới 80% và bị ảnh hưởng mạnh mẽ bởi điều kiện môi trường. IMNV có thể được tìm thấy ở tất cả các giai đoạn của tôm, cả ấu trùng và trưởng thành, nhưng tỷ lệ chết cao hơn ở tôm cỡ lớn. IMNV có thể lây truyền theo chiều ngang hoặc chiều dọc. Con đường lây truyền ngang chính là ăn thịt đồng loại, trong khi con đường lây truyền dọc có thể xảy ra qua trứng hoặc phôi.
Hệ thống miễn dịch của tôm bao gồm hệ thống phòng thủ thể dịch và hệ thống phòng thủ tế bào. Các phản ứng bảo vệ dịch thể quan trọng đối với tôm bao gồm tổng hợp melanin, hệ thống đông máu và tăng peptide kháng khuẩn (AMP) như penaedin, anti-lipopolysaccharide (ALFs) và custin (Supungul và cộng sự, 2004). Phản ứng miễn dịch tế bào của tôm bao gồm hoạt động thực bào, quá trình chết theo chương trình và bao bọc các mầm bệnh hoặc vật thể lạ (Flegel và cộng sự, 2011). Phản ứng miễn dịch của tôm đối với nhiễm IMNV cho thấy số lượng tế bào máu giảm tới 30%. Nguyên nhân gây giảm bạch cầu vẫn chưa được làm rõ. IMNV chưa được chứng minh là lây nhiễm vào các cơ quan tạo máu. Việc tăng cường phản ứng của cơ thể tôm với IMNV đã được thử nghiệm bằng cách sử dụng probiotic và synbiotic (Widanarni và cộng sự, 2020).
Phản ứng miễn dịch của tôm bị ảnh hưởng bởi nhiệt độ. Tôm thẻ chân trắng có thể phát triển ở nhiệt độ từ 7,5 – 42,0℃. Nhiệt độ tối ưu hỗ trợ tăng trưởng phụ thuộc vào kích thước của tôm thẻ chân trắng. Tình trạng tăng thân nhiệt ảnh hưởng đến tỷ lệ nhiễm virus ở tôm. Tôm có khả năng kháng virus Hội chứng Taura (TSV) chủng HI94 nếu được giữ ở nhiệt độ 32°C. Tuy nhiên, tỷ lệ chết cao ở tôm bị nhiễm chủng TSV BZ02 và được nuôi ở cùng nhiệt độ (Cote, 2008). Nghiên cứu này được thực hiện để xác định ảnh hưởng của tăng thân nhiệt đối với tôm thẻ chân trắng bị nhiễm IMNV. Nghiên cứu cho thấy rằng tăng thân nhiệt có thể làm giảm khả năng miễn dịch của tôm thẻ chân trắng đối với IMNV. Tôm thẻ chân trắng bị nhiễm IMNV và được nuôi ở nhiệt độ cao có tỷ lệ tử vong cao hơn và số lượng tế bào bị nhiễm bệnh cao hơn so với tôm được nuôi ở nhiệt độ tối ưu.
Nhiệt độ duy trì ở mức 32 – 33°C có thể giúp tôm chống lại WSSV, IHHNV. Nhiệt độ này kích hoạt quá trình apoptosis và tăng cường hoạt động của hệ miễn dịch, giúp tôm tiêu diệt virus. Dựa trên những thực tế này, nghiên cứu này được thực hiện để xác định ảnh hưởng của tăng thân nhiệt đối với tôm thẻ chân trắng bị nhiễm IMNV.
Thiết kế thử nghiệm
Nghiên cứu sử dụng thiết kế hoàn toàn ngẫu nhiên (CRD) để so sánh tác động của nhiệt độ nuôi đối với tôm thẻ chân trắng bị nhiễm IMNV. Nghiên cứu sử dụng 5 nghiệm thức, mỗi nghiệm thức được lặp lại 3 lần, đó là tôm nhiễm IMNV và nuôi ở nhiệt độ 30°C (S30), tôm nhiễm IMNV và nuôi ở 31°C (S31), tôm nhiễm IMNV và được nuôi ở 32℃ (S32), tôm bị nhiễm IMNV và được nuôi ở 33°C (S33), và tôm không bị nhiễm IMNV và được nuôi ở 30°C (Sk30) để làm đối chứng. Để tăng nhiệt độ nuôi, lò sưởi được trang bị bộ điều chỉnh nhiệt. Một thùng chứa dạng 15 hộp nhựa chứa 15 con tôm thẻ chân trắng mỗi hộp và được sục khí. Các thông số được quan sát là tổng số lượng tế bào máu (THC), tỷ lệ bạch cầu (DHC), hoạt động phenoloxidase và hoạt động bùng nổ hô hấp.
Quy trình nghiên cứu
Chuẩn bị thùng chứa
- Sử dụng 15 thùng nhựa có thể tích 100 lít.
- Khử trùng bằng dung dịch hypochlorite 50 ppm.
- Rửa sạch bằng nước sạch và sấy khô.
- Đầy nước biển có độ mặn 30 ppt.
- Sục khí.
- Thay nước 10% mỗi ngày.
Sinh vật thử nghiệm
- Tôm thẻ chân trắng L. vannamei.
- Trọng lượng 9,19±0,58 g.
- Thích nghi trong thùng nuôi trong 1 tuần.
- Xử lý theo thiết kế thí nghiệm và nuôi trong 10 ngày.
- Cho ăn 30% thức ăn protein mỗi ngày.
- Cho ăn 5% sinh khối trong quá trình thích nghi và điều trị.
- Cho ăn 3 lần/ngày vào lúc 09:00, 15:30 và 21:00.
Tái nhiễm IMNV
Quá trình này đã tăng khả năng gây bệnh và số lượng vi rút IMNV bằng cách tiêm 0,1 ml virus dự trữ vào tôm thẻ chân trắng. Mô bụng tôm được làm sạch và loại bỏ phần vỏ. Mô này đã được kiểm tra bằng qRT-PCR để xác định số lượng bản sao vi rút (Silva và cộng sự, 2015).
Chuẩn bị cấy
Tổng cộng 100 gam mô cơ bụng tôm bị nhiễm IMNV (không có vỏ) được nghiền bằng 300 ml dung dịch đệm TN (20 mM Tris–HCl và 0,4 M NaCl, pH 7,4). Mô trong dung dịch đệm TN được pha loãng 10 lần bằng dung dịch muối NaCl 2%. Chế phẩm cấy được ly tâm 2 lần, lần đầu tiên ở tốc độ 3000 vòng/phút trong 25-6 phút ở 40°C, lần thứ hai ly tâm lại trong 20 phút với tốc độ 14.000 g ở 40°C. Phần nổi phía trên được lấy và lọc bằng bộ lọc ống tiêm 0,22 m. Sau đó, vật liệu cấy được bảo quản trong tủ đông sâu ở -80°C (Silva và cộng sự, 2015).
Nhiễm IMNV
Tôm thẻ chân trắng được tiêm bắp 0,1 ml dung dịch tiêm IMNV. Việc tiêm được thực hiện ở đoạn thứ ba của bụng lưng bằng ống tiêm vô trùng 1 ml có cỡ kim 25 G. Sau khi tiêm, tôm được nuôi bằng thức ăn có hàm lượng sinh khối 5% và nước bảo trì được thay 10% mỗi ngày.
Thủ tục quan sát
Tôm sau nhiễm bệnh được quan sát mỗi giờ trong 10 ngày. Tỷ lệ chết và các triệu chứng lâm sàng là đối tượng được quan sát hàng ngày. Ngoài ra, trong quá trình nghiên cứu, các xét nghiệm chất lượng nước và mẫu máu huyết đã được lấy để xét nghiệm miễn dịch.
Các mẫu hemolymp
Để thu thập mẫu hemolymp, lấy 50 µL hemolymp từ ba con tôm cho mỗi nghiệm thức. Sử dụng ống tiêm vô trùng 0,1 ml chứa chất chống đông máu (30 mM trisodium citrate, 100 mM glucose, 26 mM axit citric, 10 mM EDTANa2 và 510 mM NaCl; thêm NaOH đến pH 6,6). Tỷ lệ hemolymp-chống đông máu là 1:1. Sau đó, chúng tôi chia hỗn hợp thành ba ống nhỏ để xét nghiệm tổng số lượng tế bào máu (THC) và tỷ lệ bạch cầu (DHC), xét nghiệm phenoloxidase (PO) và thử nghiệm bùng nổ hô hấp (RB). Để bảo quản xét nghiệm THC, mẫu được thêm 4% muối formalin (NaCl 0,45 M). Đối với phép thử PO và RB, mẫu được cho vào hộp mát chứa đầy đá.
Thông số nghiên cứu
Tổng số lượng tế bào máu (THC) và Tỷ lệ bạch cầu (DHC)
Thử nghiệm THC được tiến hành bằng cách đưa 10 µL hỗn hợp hemolymp và chống đông máu vào máy đo huyết cầu. Tế bào máu được quan sát bằng kính hiển vi có độ phóng đại 100 lần.
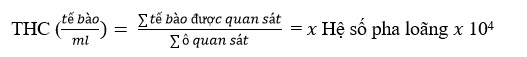
Một xét nghiệm biệt hóa tế bào máu đã được tiến hành để xác định sự so sánh của các loại tế bào máu (trong suốt, bán hạt, dạng hạt). Thử nghiệm được thực hiện bằng cách nhuộm 50 L hỗn hợp chất chống đông máu với 50 µL trypan blue (0,4% trong PBS) và 5 L rose Bengal (1,2% trong 50% ethanol) (Mangkalanan và cộng sự, 2014). Sau khi ủ, dung dịch nhuộm được tạo ra để chuẩn bị đốm. Tỷ lệ phần trăm DHC ước tính được xác định bằng cách đếm 100 tế bào máu sử dụng kính hiển vi ở độ phóng đại 400 lần (Tampangallo và cộng sự, 2012).
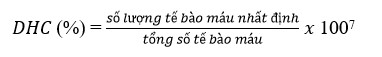
Bùng nổ hô hấp (RB)
Hoạt động bùng nổ hô hấp là phép đo nội bào của anion superoxide (O2-). Thử nghiệm này dựa trên sự hình thành formazan từ quá trình khử nitroblue tetrazolium (NBT). Các phép đo sử dụng máy đo quang phổ ở bước sóng 630 nm (Song và cộng sự, 2003).
Phenoloxidase (PO)
Tổng cộng 50 µl hemolymp được ủ với 50 µl (1 mg/mL) trypsin trong 5 phút. Sau đó thêm 50 µl LDOPA (3 mg/mL) vào và ủ trong 10 phút. Hoạt tính PO được đo dựa trên sự hình thành dopachrome từ L-Dihydroxyphenylalanine (L-DOPA) bằng máy quang phổ có bước sóng 490 nm (Cheng và cộng sự, 2005).
Kết quả và thảo luận
Tổng số lượng tế bào máu (THC)
Sau cảm nhiễm IMNV, các triệu chứng lâm sàng ban đầu của nhiễm IMNV bắt đầu xuất hiện từ ngày thứ 2 đến ngày thứ 5. Các triệu chứng bao gồm giảm thèm ăn và mất đi độ trong suốt của cơ bụng. Để xác nhận chẩn đoán IMNV, sử dụng xét nghiệm phản ứng chuỗi polymerase phiên mã ngược (RT-PCR). Kết quả RT-PCR cho thấy các dải ở mức 139 và 328 bp trong các mẫu tôm nhiễm IMNV (Hình 1).
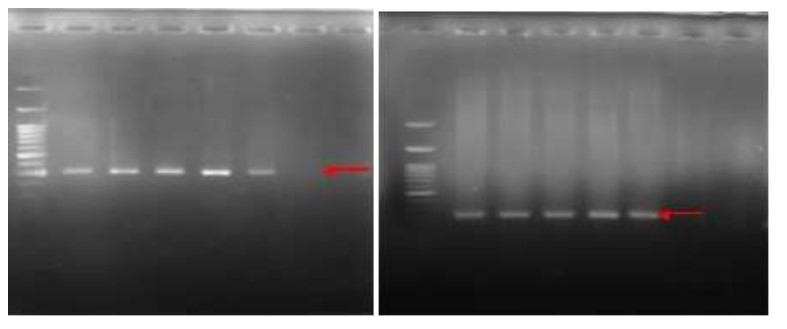
Hình 1. Kết quả của bước đầu tiên (trái) và xét nghiệm RT-PCR lồng tôm thẻ chân trắng (phải), sau thử nghiệm cảm nhiễm IMNV. M; điểm đánh dấu (100bp), S30; Nhiệt độ bảo trì 30C, S31; nhiệt độ bảo trì 31°C, S32; nhiệt độ duy trì 320C, S33; nhiệt độ duy trì 33°C, K (+); đối chứng dương tính, K (-); đối chứng âm tính, SK30; nhóm điều trị đối chứng âm tính.
Tăng thân nhiệt ảnh hưởng đến việc giảm giá trị THC sau xét nghiệm IMNV. Giá trị THC ở nghiệm thức S33 có giá trị thấp nhất so với các nghiệm thức khác. Vào ngày thứ năm, giá trị THC của nhómS33 (nhiệt độ 33°C) khác biệt đáng kể (P<0,05) với S30, S31, S32 và SK30. Việc xử lý S32 khác biệt đáng kể (P<0,05) với S30 và SK30, nhưng không khác biệt đáng kể (P<0,05) so với SK30. Mức giảm giá trị THC của S30, S31, S32 và S33 khi so sánh với Sk30 là 52,11%, 53,10%, 58,28% và 64,61% (Hình 2).
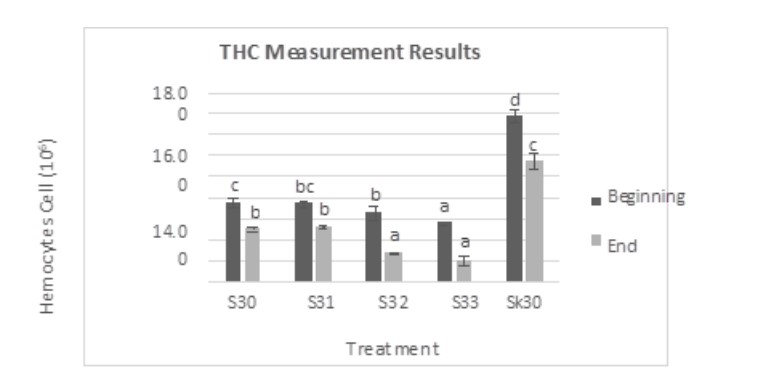
Hình 2. Kết quả đo THC của tôm chân trắng sau thử nghiệm cảm nhiễm IMNV. Kết quả sai khác có ý nghĩa (P<0,05) được biểu thị bằng các chữ cái khác nhau trong cùng một màu.
Vào ngày thứ 10, giá trị THC của S33 khác biệt đáng kể (P<0,05) với S30, S31 và SK30 nhưng khác biệt không đáng kể (P<0,05) với S32. Trong khi giá trị THC của nghiệm thức S31 (nhiệt độ 31℃) khác biệt đáng kể (P<0,05) với SK30, nhưng khác biệt không đáng kể (P<0,05) với S30. Mức giảm giá trị THC của S30, S31, S32 và S33 khi so sánh với SK30 là 68,08%, 67,12%, 82,58% và 86,84%.
Tỷ lệ bạch cầu (DHC)
Giá trị của các tế bào máu hyaline (tế bào hạt) sau khi xét nghiệm IMNV giảm đáng kể. Số lượng tế bào hyaline S33 có giá trị thấp nhất so với các nghiệm thức khác. Vào ngày thứ 5, giá trị tế bào hyaline của S33 khác biệt đáng kể (P<0,05) với S30, S31 và SK30, nhưng không khác biệt đáng kể so với S32. Mức giảm giá trị của các tế bào hyaline S30, S31, S32 và S33 khi so sánh với SK30 là 20,81%, 21,48%, 34,90% và 38,25% (Hình 3 A).
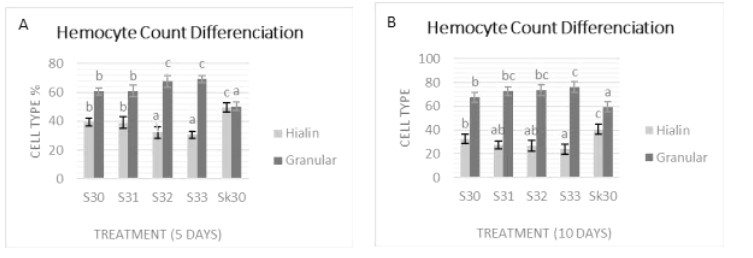
Hình 3. Kết quả đo DHC của tôm chân trắng vào ngày thứ 5 (A) và thứ 10 (B) sau thử nghiệm cảm nhiễm IMNV. Kết quả sai khác có ý nghĩa (P<0,05) được biểu thị bằng các chữ cái khác nhau trong cùng một màu.
Vào ngày thứ 10, số lượng tế bào hyaline S33 khác biệt đáng kể (P<0,05) với S30 và SK30 nhưng khác biệt không đáng kể (P<0,05) với S31 và S32. Vào ngày thứ 10, giá trị của các tế bào hyaline S33 khác biệt đáng kể (P<0,05) với S30 và SK30, nhưng không khác biệt đáng kể so với S31 và S32 (Hình 3B). Giá trị của các tế bào hyaline giảm trong S30, S31, S32 và S33 khi so sánh với Sk30 lần lượt là 34,23%, 44,97%, 46,31% và 51,68%.
Hoạt tính phenoloxidase
Theo kết quả nghiên cứu, hoạt tính PO của nghiệm thức và đối chứng đều giảm vào ngày thứ mười so với ngày thứ năm. Cụ thể, vào ngày thứ năm, hoạt tính PO của nghiệm thức S33 thấp nhất. Mức độ giảm hoạt tính PO của S30, S31, S32 và S33 khi so sánh với đối chứng lần lượt là 30,88%, 40,63%, 47,69% và 49,71%.
Kết quả nghiên cứu cho thấy, vào ngày thứ mười, hoạt tính PO của nghiệm thức S33 thấp hơn đáng kể so với các nghiệm thức S30, S31 và SK30, nhưng không khác biệt so với nghiệm thức S32. Hoạt tính PO của nghiệm thức S30 cũng thấp hơn đáng kể so với nghiệm thức SK30, nhưng không khác biệt so với nghiệm thức S31. Kết quả này được thể hiện rõ trong Hình 4. Mức độ giảm hoạt tính PO của S30, S31, S32 và S33 khi so sánh với SK30 lần lượt là 53,30%, 66,37%, 65,96% và 73,85%.
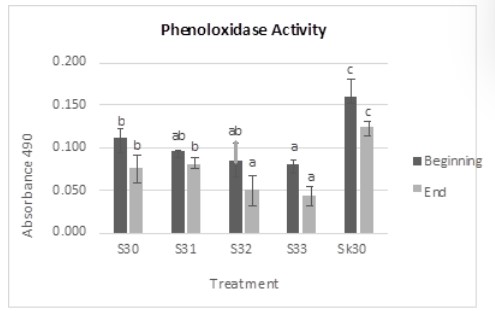
Hình 4: Đo hoạt tính PO của tôm chân trắng sau thử nghiệm cảm nhiễm IMNV. Kết quả sai khác có ý nghĩa (P<0,05) được biểu thị bằng các chữ cái khác nhau trong cùng một màu.
Hoạt động bùng nổ hô hấp (RB)
Nhiễm IMNV và tăng thân nhiệt đều dẫn đến giảm hoạt động RB. Giá trị hoạt động RB vào ngày thứ 10 thấp hơn vào ngày thứ 5 cả ở nghiệm thức và đối chứng. Nghiệm thức S33 có hoạt tính RB thấp nhất so với các nghiệm thức khác. Vào ngày thứ năm, giá trị RB của nghiệm thức S33 khác biệt đáng kể (P<0,05) với S30 và SK30, nhưng không khác biệt đáng kể so với S31 và S32. Giá trị hoạt động của RB S30 khác biệt đáng kể (P<0,05) với SK30, nhưng khác biệt không đáng kể (P<0,05) với S31. Giá trị hoạt độ RB giảm S30, S31, S32 và S33 khi so sánh với SK30 lần lượt là 23,75%, 37,09%, 49,26% và 52,73% (Hình 5).
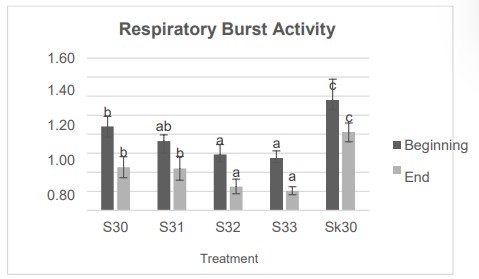
Hình 5. Kết quả đo hoạt động RB của tôm chân trắng sau thử nghiệm cảm nhiễm IMNV.
Kết quả nghiên cứu cho thấy, vào ngày thứ 10, giá trị hoạt động RB của nghiệm thức S33 khác biệt đáng kể (P<0,05) với nghiệm thức S30 và SK30, nhưng không khác biệt đáng kể (P<0,05) với nghiệm thức S32. Giá trị hoạt động RB của nghiệm thức S30 khác biệt đáng kể (P<0,05) với SK30 nhưng khác biệt không đáng kể (P<0,05) với S31. Kết quả cho thấy tăng thân nhiệt làm giảm hoạt động RB của tôm thẻ chân trắng, dẫn đến phản ứng miễn dịch của cơ thể đối với nhiễm trùng IMNV giảm đáng kể. Mức giảm giá trị THC trong nghiên cứu này dao động từ 52,11% – 86,84%. Giá trị THC giảm đáng kể nhất trong nhóm S33. Giá trị THC của tôm có thể khác nhau hoặc phụ thuộc vào điều kiện sinh lý và thay đổi môi trường (Le Moullac và cộng sự, 2000; Mahasri & Sari., 2018). Sự phong phú của tế bào máu cũng bị ảnh hưởng bởi hệ thống tuần hoàn (mở/đóng), giới tính, lột xác, tăng trưởng, tình trạng sinh sản và dinh dưỡng (Owens & O’Neill). Sự giảm giá trị THC có thể đạt tới 30% sau khi nhiễm IMNV tự nhiên (Costa và cộng sự, 2009). Giá trị THC được báo cáo giảm tới 40% ở tôm trải qua những thay đổi nhiệt độ mạnh mẽ (Le Moullac và cộng sự, 2000). Trong các bệnh truyền nhiễm, THC giảm đi do bị ảnh hưởng bởi sự xâm nhập của tế bào máu vào mô, giảm sản xuất tế bào máu bởi các cơ quan tạo máu hoặc quá trình apoptotic. Sự thâm nhiễm tế bào máu trong mô là một phản ứng đối với phản ứng viêm. Trong trường hợp IMNV, nhiều tế bào máu thâm nhiễm đã được tìm thấy trong mô cơ bụng bị hoại tử (Andrade và cộng sự, 2008). Sự di chuyển của tế bào máu từ hệ tuần hoàn đến các mô cho thấy hệ thống phòng thủ của cơ thể đang hoạt động (Smith và cộng sự, 2003; Mahasri và cộng sự, 2018).
Tuần hoàn máu đóng vai trò quan trọng trong việc bảo vệ tôm khỏi bị nhiễm trùng. Tế bào máu đóng tham gia vào phản ứng miễn dịch của tôm thông qua các cơ chế nhận biết mầm bệnh, thực bào, tạo hắc tố và gây độc tế bào (Nkuba và cộng sự, 2023). Tế bào máu của tôm được phân loại thành 3 loại chính: tế bào hyaline (agranulocytes), bạch cầu bán hạt (SGC) và bạch cầu hạt (GC). Một số chuyên gia phân loại tế bào máu thành bạch cầu hạt và bạch cầu hạt. Trong nghiên cứu này, cả hai loại tế bào đều giảm đáng kể sau khi nhiễm IMNV. Mức giảm đáng kể nhất xảy ra ở nghiệm thức S32 và S33. Các loại tế bào máu rất quan trọng trong quá trình cố định và tiêu diệt mầm bệnh. Trong quá trình lây nhiễm, tế bào hyaline biến thành tế bào máu dạng hạt để đáp ứng với mầm bệnh xâm nhập vào cơ thể tôm. Tế bào máu hyaline đóng vai trò trong việc hấp thụ mầm bệnh và các hạt lạ. Ngoài ra, các tế bào này còn tham gia vào quá trình đông máu. SGC đóng vai trò trong việc phát hiện sớm mầm bệnh. GC chứa proPO, peroxinectin và crusin (kháng khuẩn) (Soderhall & Cerenius, 1992). Số lượng tế bào hạt trong hệ tuần hoàn cũng có thể giảm do quá trình thoái hóa của các tế bào máu dạng hạt trong các cơ quan bạch huyết. Trong trường hợp nhiễm virus, đã có báo cáo về sự tích tụ của Cơ quan bạch huyết hình cầu (LOS). Sự tích lũy LOS có liên quan đến sự thoái hóa của các tế bào máu dạng hạt có chứa virus. Ở LOS, thể vùi được tìm thấy ở tôm bị nhiễm IMNV (Tang và cộng sự, 2005).
Hoạt động PO là một chỉ số quan trọng dùng để đánh giá tình trạng sức khỏe của tôm (Maggioni và cộng sự, 2004). Hoạt động PO giảm có thể là do đấu hiệu của nhiễm trùng hoặc suy giảm miễn dịch. Trong nghiên cứu này, hoạt động PO cảu tôm giảm đáng kể sau thử nghiệm cảm nhiễm IMNV. Nhóm S33 có hoạt tính PO giảm đáng kể nhất so với các nhóm khác. Tôm bị nhiễm bệnh có thể bị giảm khả năng miễn dịch do hoạt động PO giảm rõ rệt (Cerenius và cộng sự, 2010). Hoạt động PO giảm đã được báo cáo xảy ra 24 giờ sau khi bị nhiễm bệnh (Mathew và cộng sự, 2007). Giá trị của hoạt động PO hầu như luôn tỷ lệ thuận với giá trị của THC. Tế bào máu giải phóng PO vào bạch huyết dưới dạng proPO (proenzym không hoạt động). Trong điều kiện bình thường, sự gia tăng lượng proPO đi kèm với sự gia tăng số lượng tế bào máu (Smith và cộng sự, 2003). Kích hoạt proPO bắt đầu bằng việc đưa các phân tử đặc hiệu vi sinh vật được gọi là mẫu phân tử liên quan đến mầm bệnh (PAMP) bởi các thụ thể nhận biết mầm bệnh (PRP). Quá trình này kích hoạt hoạt động serine proteinase (PRP) có thể kích hoạt zymogen proPO để trở thành enzyme PO. Enzyme PO có thể bắt đầu hình thành melanin từ quinone có khả năng tiêu diệt mầm bệnh. Hoạt động của PO có liên quan đến quá trình thực bào, bao bọc và tạo hắc tố của các vật thể lạ (Amparyup và cộng sự, 2013; Wiradana và cộng sự, 2019). Các mầm bệnh xâm nhập vào cơ thể tôm sẽ bị tiêu diệt thông qua hoạt động PO. Ngoài ra, điều này sẽ kích hoạt hoạt động kháng khuẩn bằng các peptide kháng khuẩn (AMP) như pentamidine, crusin và yếu tố chống lipopolysaccharides (ALF) (Tassanakajon, 2013).
Kết quả nghiên cứu cho thấy, hoạt động RB giảm đáng kể sau thử nghiệm cảm nhiễm IMNV. Hoạt động RB là quá trình tiêu diệt mầm bệnh hoặc các hạt lạ thông qua quá trình thực bào (Yeh và cộng sự, 2009). Các enzyme thoái hóa được giải phóng vào các phagosome dẫn đến sự tiêu diệt mầm bệnh do tạo ra chất trung gian oxy phản ứng (ROI) hoặc phản ứng hô hấp (RB). Hoạt động của RB giảm tỷ lệ thuận với việc giảm số lượng tế bào máu do di chuyển đến các mô bị nhiễm mầm bệnh. Giá trị hoạt động RB được xác định bằng cách đo lượng anion superoxide (O2-) được hình thành bởi các tế bào máu. Ngoài anion superoxide, hoạt tính RB còn tạo ra hydrogen peroxide (H2O2). Hydrogen peroxide sẽ biến thành axit hypochlorous (HClO) Sản phẩm của hoạt động RB gây độc cho mầm bệnh (Rodriguez & Le Moullac, 2000).
Kết luận
Tăng thân nhiệt ảnh hưởng đến phản ứng miễn dịch của tôm thẻ chân trắng bằng thử nghiệm cảm nhiễm IMNV. Giá trị của THC, tế bào hyaline, hoạt tính PO và hoạt động RB giảm ở tôm nuôi ở nhiệt độ 30°C, 31°C, 32°C và 33°C. Tôm nhiễm IMNV có đáp ứng miễn dịch giảm đáng kể, đặc biệt ở nhiệt độ 32°C và 33°C.
Theo Irvan Firman Syah Za, Azam Bachur Zaidy, Ketut Sugama, Angela Mariana Lusiastuti, Ren Fitriadi
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Tại Sao Phải Thuần Tôm Giống Trước Khi Thả?
- Sản Xuất Tôm Thẻ Chân Trắng Ở Trung Quốc
- Quản Lý Bệnh Trên Tôm: Châu Á Và Châu Mỹ

 English
English