Kỹ Thuật Nuôi, Tin tức
Phần 2: Hệ vi sinh vật trong nước ương ấu trùng tôm thẻ chân trắng (Litopenaeus vannamei) hình thành một cách ngẫu nhiên và chịu ảnh hưởng của hệ vi sinh vật trong sản phẩm thức ăn sống
4. Thảo luận
4.1. Việc tập hợp cộng đồng trong nước nuôi bị chi phối bởi tính ngẫu nhiên
Hiểu rõ quy trình tập hợp cộng đồng là điều cần thiết để phát triển các chiến lược quản lý hệ vi sinh vật hiệu quả. Nó có thể hỗ trợ xác định chế độ giám sát tối ưu và có thể nâng cao hiểu biết về thời gian hình thành và hiện diện của các chủng vi khuẩn có lợi được thêm vào nước (Dini-andreote và Raaijmakers, 2018; Pearson và cộng sự, 2018).
Phân tích đa dạng beta cho thấy các cộng đồng nước nuôi dần dần thay đổi trong quá trình nuôi (Hình 3A; Thông tin hỗ trợ Hình S3) và thông qua những thay đổi này, hệ vi sinh vật của các bể lặp lại ngày càng khác biệt với nhau (Hình 3B). Mặc dù các đơn vị phân loại hiện diện trong các bể tái tạo là tương tự nhau, nhưng mức độ phong phú tương đối mà chúng hiện diện rất khác nhau (Hình 3). Đánh giá của tập hợp cộng đồng cho thấy rằng động lực tạm thời trong các cộng đồng trong nước nuôi chủ yếu bị chi phối bởi các quá trình ngẫu nhiên (Hình 6A), điều này có thể giải thích sự không đồng nhất quan sát được này. Sự khác biệt giữa các lần lặp lại là hiện tượng thường xuyên được quan sát thấy trong quá trình nuôi các loài khác nhau, trong cả hệ thống theo đợt và hệ thống tuần hoàn (Chun và cộng sự, 2018; Almeida và cộng sự, 2019; Li và cộng sự, 2019; Dahle và cộng sự, 2020), cho thấy rằng sự tập hợp ngẫu nhiên có thể là một đặc điểm phổ biến của các hệ thống nuôi trồng thủy sản. Nguyên nhân có thể dẫn đến tính ngẫu nhiên này có thể là do cơ chế xáo trộn thông qua thay nước, bổ sung thức ăn, v.v. (Santillan và cộng sự, 2018) hoặc hiện tượng phú dưỡng của nước (Yang và cộng sự, 2018). Trong cả hai trường hợp, việc tập hợp sẽ phụ thuộc vào loại hệ thống nuôi được sử dụng, vì điều này quyết định các đặc tính vận hành như thay/tuần hoàn nước, tần suất cho ăn, v.v. Cần nghiên cứu sâu hơn để kiểm tra tính khái quát của quan sát của chúng tôi.
Mức độ ngẫu nhiên cao cho thấy động lực của cộng đồng và do đó sự hiện diện của các loài tăng cường sức khỏe và mầm bệnh cơ hội, phần lớn là không thể đoán trước được (Zhou và Ning, 2017). Do đó, các cộng đồng cần phải theo dõi liên tục. Một ý nghĩa khác của sự khó lường này là thời gian cư trú của các chủng probiotic sau khi hình thành sẽ không chắc chắn. Vì vậy, có thể cần phải bổ sung (tái) thường xuyên men vi sinh.
Không chỉ thành phần cộng đồng mà mật độ vi khuẩn cũng khác nhau giữa các bể lặp lại, dẫn đến ấu trùng trong các bể lặp lại tiếp xúc với các nhóm vi khuẩn khác nhau ở các tải lượng vi khuẩn khác nhau. Với mối liên hệ được ghi chép rõ ràng giữa vật chủ và hệ vi sinh vật trong nước nuôi (Zheng và cộng sự, 2017; Sun và cộng sự, 2019; Angthong và cộng sự, 2020), tính không đồng nhất này có thể có tác động đến khả năng tái sản xuất của hiệu suất canh tác. Trên thực tế, tỷ lệ chết cao và khả năng tái sản xuất thấp giữa các lần nuôi lặp lại thường được quan sát thấy ở các trại giống (Vestrum và cộng sự, 2018). Vì các sinh vật nuôi có thể chọn lọc các loài cụ thể từ môi trường của chúng (Yan và cộng sự, 2016; Li và cộng sự, 2017; Dai và cộng sự, 2020), nên tình trạng chính xác của việc nuôi dưỡng tính không đồng nhất trong nước đối với khả năng tái sản xuất hiệu suất canh tác vẫn cần làm sáng tỏ.
Sự không đồng nhất giữa các bể có hiệu suất tốt và kém cũng lớn như giữa các bể có hiệu suất kém. Với tính không đồng nhất cao như vậy, việc xác định các dấu ấn sinh học có thể phân biệt các bể có hiệu suất tốt và kém với nhau và do đó có thể được sử dụng làm ‘tín hiệu cảnh báo’ cho các vấn đề trong quá trình nuôi tôm, sẽ đòi hỏi số lượng canh tác lặp lại nhiều hoặc một kết hợp với thông tin chức năng (ví dụ: metagenomics, Transcriptomics, v.v.).
4.2. Quần thể tảo trong nước nuôi điều khiển động lực của vi khuẩn phù du
Để đạt được sự kiểm soát vi sinh vật trong các hệ thống nuôi trồng thủy sản, điều tối quan trọng là phải hiểu được các yếu tố thúc đẩy thành phần và động lực của cộng đồng (Bentzon-tilia và cộng sự, 2016). Dữ liệu của chúng tôi chỉ ra rằng các cộng đồng nước nuôi liên tục thay đổi và có hai sự thay đổi lớn xảy ra (tức là vào ngày 2 và ngày 10-11), có liên quan đến động thái của mật độ tế bào tảo trong nước nuôi. Sự thay đổi đầu tiên được gây ra bởi sự phát triển nhanh chóng của các loài vi khuẩn cụ thể. Có hai cách giải thích cho điều này: sự phong phú của vi khuẩn phát triển nhanh trên thức ăn và phân tích tụ trong bể (De Schryver và Vadstein, 2014; Chen và cộng sự, 2017) hoặc vi khuẩn có thể phát triển hiệu quả trên dịch tiết của tảo do mật độ tảo tăng mạnh (Natrah và cộng sự, 2014; Mühlenbruch và Grossart, 2018). Sau sự thay đổi này, các cộng đồng bị chiếm ưu thế bởi các đơn vị phân loại trong đó mức độ phong phú tuyệt đối có mối tương quan đáng kể với mật độ tảo (Bảng thông tin hỗ trợ S1). Chúng bao gồm các đơn vị phân loại được đưa vào thông qua việc bổ sung tảo và các đơn vị phân loại không được đưa vào thông qua tảo. Quan sát này hỗ trợ cho giả thuyết về sự phát triển vượt bậc của các loài vi khuẩn mà sự tăng trưởng được tảo thúc đẩy. Sự thay đổi này đã gây ra sự phong phú của cùng một đơn vị phân loại trong tất cả các bể lặp lại, giúp đồng bộ hóa thành phần cộng đồng trên các bể (Hình 3B). Điều này có thể được giải thích là do tập hợp cộng đồng bị chi phối bởi sự lựa chọn đồng nhất và hạn chế phân tán (tức là một hội đồng ngẫu nhiên có doanh thu thành phần cao) vào ngày đó (Thông tin hỗ trợ Hình S9). Việc cho tảo ngừng ăn sau 10 ngày làm giảm số lượng tảo, sau đó là giảm số lượng các loài vi khuẩn liên quan đến tảo. Điều này đã khởi đầu cho sự thay đổi cộng đồng thứ hai, làm tăng thêm sự khác biệt về thành phần cộng đồng giữa các bể lặp lại.
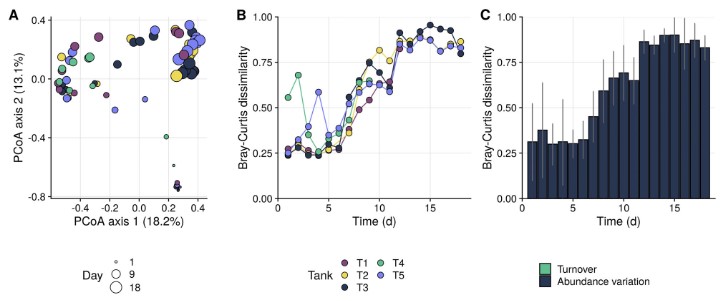
Hình 3. A. Sự phân bố PCoA của sự khác biệt Bray-Curtis của tất cả các hệ vi sinh vật nước nuôi trong quá trình nuôi. Các chấm được tô màu theo các bể khác nhau và kích thước tương ứng với số ngày sau khi bắt đầu canh tác.
- Động lực học Bray-Curtis của từng bể khác biệt so với các bể khác mỗi ngày (ví dụ: dòng T1 cho biết mức độ khác biệt trung bình của Bray-Curtis của T1 so với bốn xe tăng khác mỗi ngày).
- Sự khác biệt trung bình của Bray-Curtis giữa 5 bể mỗi ngày và phân chia theo doanh thu (tức là sự khác biệt về sự vắng mặt/hiện diện của các đơn vị phân loại) và sự thay đổi về độ phong phú (tức là sự khác biệt về độ phong phú tương đối giữa các bể). Doanh thu trung bình chịu trách nhiệm cho 0,26% sự khác biệt và do đó không thể hiện rõ trên biểu đồ. [Hình màu có thể được xem tại wileyonlinelibrary.com]
Thực vật phù du được biết là có vai trò điều khiển các cộng đồng vi khuẩn (Pinhassi và cộng sự, 2004; Teeling và cộng sự, 2016; Park và cộng sự, 2020). Park và cộng sự (2020) đã so sánh việc nuôi trồng với tảo sống và tảo dạng bột và chỉ ra rằng tảo điều chỉnh tích cực các cộng đồng nước nuôi và tăng hiệu suất canh tác. Nguyên tắc này được áp dụng rộng rãi với tên gọi ‘công nghệ nước xanh’, trong đó sự hiện diện của tảo trong nước nuôi được thúc đẩy để cải thiện hiệu suất canh tác (Corre và cộng sự, 2005; Neori, 2011; Charoonnart và Purton, 2018). Nghiên cứu này chỉ ra rằng ngay cả khi tảo được thêm vào với số lượng thấp để sử dụng làm nguồn thức ăn cho các sinh vật nuôi, cộng đồng thực vật phù du vẫn ảnh hưởng đến thành phần cộng đồng vi khuẩn. Vi khuẩn phù du có thể bị thực vật phù du điều khiển thông qua các cơ chế khác nhau. Một mặt, thực vật phù du có thể cạnh tranh với vi khuẩn về không gian và chất dinh dưỡng (Mills và cộng sự, 2008; Fourquez và cộng sự, 2015). Mặt khác, thực vật phù du có thể tương tác và thúc đẩy các phân loại cụ thể, như đã được quan sát trong nghiên cứu này. Sự tương tác này có thể xảy ra thông qua việc sản xuất các chất tiết ra từ tảo có thể đóng vai trò là nguồn lực cho sự tăng trưởng (Smriga và cộng sự, 2016) hoặc có đặc tính ức chế (Molina-cárdenas và Sánchez-saavedra, 2017) đối với các loài cụ thể.
Trong quá trình nuôi, nước nuôi trở nên phú dưỡng, có thể làm tăng tính ngẫu nhiên trong việc tập hợp cộng đồng và làm xáo trộn sự ổn định của cộng đồng (Yang và cộng sự 2018). Kết quả chỉ ra rằng sự hiện diện của thực vật phù du cộng đồng gắn liền với sự hiện diện của phân loại vi khuẩn cụ thể và do đó đã đồng bộ hóa cộng đồng thành phần trên các lần lặp lại. Tác dụng ổn định này theo nghiên cứu của Yang và cộng sự (2020) cho thấy thực vật phù du ảnh hưởng đến tốc độ cộng đồng thay đổi theo thời gian và điều này phụ thuộc vào về loại tảo được sử dụng. Mặc dù thực vật phù du làm giảm sự khác biệt giữa các bể lặp lại, điều này không ngăn cản các cộng đồng nhân rộng phân ra do sự tập hợp ngẫu nhiên hoặc ngăn chặn khối lượng tỷ lệ chết xảy ra ở một trong các bể trong khi tảo bị dồi dào trong nước nuôi (tức là bể 4).
Những phát hiện này tiếp tục chứng minh vai trò quan trọng của thực vật phù du như một yếu tố định hướng của hệ vi sinh vật nuôi trồng thủy sản và chỉ ra rằng việc quản lý quần thể thực vật phù du và các cộng sự vi khuẩn của nó trong nước nuôi là mối quan tâm lớn trong quá trình nuôi. Cần nghiên cứu sâu hơn về sự tương tác giữa tảo và vi khuẩn trong các hệ thống khỏe mạnh và bị bệnh để xác định cách sử dụng thực vật phù du một cách hiệu quả để kiểm soát các hệ vi sinh vật nước nuôi hướng tới trạng thái tăng cường sức khỏe.
4.3. Hệ vi sinh vật ngoại vi được đặc trưng bởi sự khác biệt theo lô
Trại giống bao gồm một số nơi chứa vi sinh vật, bao gồm cột nước, ấu trùng, thức ăn của ấu trùng, v.v. (Goulden và cộng sự, 2013). Hầu hết các nghiên cứu đều tập trung vào nước nuôi và các hệ vi sinh vật liên quan đến vật chủ nhưng không nghiên cứu đồng thời thành phần cộng đồng của các hệ vi sinh vật ngoại vi này. Mặc dù chúng được công nhận là một yếu tố quan trọng đối với an toàn sinh học (Høj và cộng sự, 2009), hiện có rất ít thông tin về sự thay đổi theo lô, động lực học của vi khuẩn trong điều kiện bảo quản, v.v., trong các trại sản xuất giống thương mại.
Đối với mỗi hệ vi sinh vật ngoại vi, mức độ biến thiên cao theo từng đợt được quan sát thấy. Những khác biệt theo lô này chủ yếu được cho là do sự khác biệt lớn về số lượng thành viên tương đối phong phú trong cùng một nhóm phân loại ‘cốt lõi’ (Bảng thông tin hỗ trợ S2-S5 và Hình S6). Ngoài ra, xét về mật độ vi khuẩn, người ta cũng quan sát thấy sự biến đổi cao giữa và trong các lô (Hình 4).
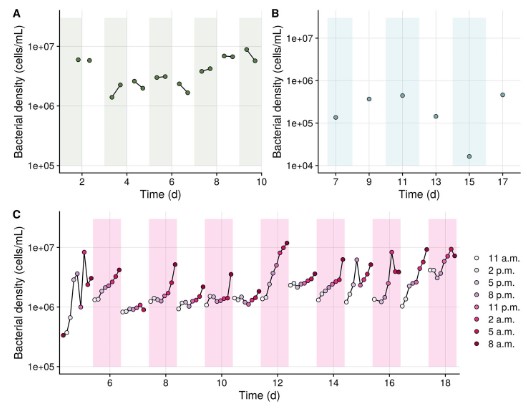
Hình 4. Động lực học theo thời gian của sự phong phú vi khuẩn trong môi trường nuôi cấy tảo (A), thay nước (B), bể nuôi Artemia (C). Sự khác biệt màu nền tương ứng với các lô khác nhau và các dòng kết nối các mẫu có nguồn gốc từ cùng một lô. Lưu ý rằng thang đo từ bảng B khác với bảng của bảng A và C. [Hình màu có thể đã xem tại wileyonlinelibrary.com]
Sự hiện diện của một nhóm vi khuẩn cốt lõi trong môi trường nuôi cấy tảo phù hợp với đặc tính đã được báo cáo trước đây của các hệ vi sinh vật liên quan đến tảo (Goecke và cộng sự, 2013; Behringer và cộng sự, 2018; Fulbright và cộng sự, 2018; Mönnich và cộng sự, 2020) (Bảng thông tin hỗ trợ S3). Nhiều đơn vị phân loại được xác định là thành viên cốt lõi của nuôi cấy tảo đã được báo cáo là có liên quan đến Chaetoceros sp., bao gồm Phaeodactylibacter, Neptuniibacter, Arthrobacter, Marinobacter, Alteromonas, Rhodobacteriaceae, Aestuariibacter, Marinobacter (Baker và cộng sự, 2016; Crenn và cộng sự, 2018; Angthong và cộng sự, 2020).
Tương tự với Artemia, một số đơn vị phân loại được xác định là thành viên cốt lõi đã được quan sát trước đây trong các phương pháp nuôi này, bao gồm Alteromonas, Vibrio, Nautella, Dong-hicola, Halomonas và Rhodobacteriaceae (Mcintosh và cộng sự, 2008; Tkavc và cộng sự, 2011; Walburn và cộng sự, 2019; Angthong và cộng sự, 2020) (Bảng thông tin hỗ trợ S4). Hệ vi sinh vật cốt lõi của nước nuôi Artemia chứa một số loài được phân loại là Vibrio sp.. Điều này phù hợp với các nghiên cứu trước đây cho biết các thành viên của chi Vibrio xuất hiện tự nhiên trong các hệ vi sinh vật liên quan đến Artemia (Lopez-Torres và Lizarraga- Partida, 2001; Thompson và cộng sự, 2004; Høj và cộng sự, 2009; Tkavc và cộng sự, 2011; Interaminense và cộng sự, 2014). Tuy nhiên, do trình tự 16S rRNA không cung cấp thông tin chức năng nên không thể xác định liệu những vi khuẩn này có gây nguy cơ an toàn sinh học hay không. Trong suốt 24 giờ, sự phát triển của vi khuẩn được quan sát thấy, gây ra sự khác biệt lên tới 1 log10 đơn vị về mật độ vi khuẩn. Do đó, điều kiện bảo quản không ngăn cản được sự phát triển của vi khuẩn. Thời điểm cuối cùng của mỗi lô được lấy mẫu để giải trình tự Illumina, do đó không thể đưa ra tuyên bố về việc phân loại vi khuẩn nào đang phát triển trong quá trình bảo quản lạnh.
Hệ vi sinh vật của thức ăn khô công thức được nghiên cứu ít hơn so với hệ vi sinh vật của thức ăn sống. Hệ vi sinh vật của 5 sản phẩm thức ăn khô chủ yếu là vi khuẩn gram dương, điều này phù hợp với báo cáo trước đó. Một số họ và chi được phát hiện trong thức ăn trước đây đã được tìm thấy trong hệ vi sinh vật trong thức ăn khô, chẳng hạn như Bacillaceae và Lactobacilli (Lunestad và cộng sự, 2007; Walburn và cộng sự, 2019). Các thành phần thức ăn chẳng hạn như các nguyên liệu có nguồn gốc từ tế bào đã qua chế biến, ngày càng được sử dụng làm nguồn protein thay thế để sản xuất thức ăn chăn nuôi (Cottrell và cộng sự, 2020), có thể chứa các vi sinh vật còn sót lại và/hoặc hệ vi sinh vật nền. Do đó, điều quan trọng cần lưu ý là lượng vi khuẩn đo được trong nghiên cứu này có thể bao gồm các tế bào sống sót và/hoặc không thể sống sót và cần phải phân tích sinh lý bổ sung để xác minh điều này. Các nghiên cứu trước đây đã chỉ ra rằng những khía cạnh này bị ảnh hưởng bởi các thông số môi trường cũng như việc xử lý và sử dụng tại chỗ (Lunestad và cộng sự, 2007; O’Keefe và Campabadal, 2015; Walbum và cộng sự, 2019). Do nỗ lực nghiên cứu về hệ vi sinh vật trong thức ăn khô còn hạn chế nên nghiên cứu sâu hơn sẽ làm sáng tỏ chức năng và hoạt động vi khuẩn tại chỗ.
Dữ liệu chỉ ra rằng hệ vi sinh vật của thức ăn khô và thức ăn sống cũng như nước thay thế được đặc trưng bởi sự biến đổi lớn, cả trong và giữa các lô, và do đó việc tăng cường kiểm soát hệ vi sinh vật có thể góp phần vào việc sản xuất ấu trùng dễ dự đoán hơn.
4.4. Các nguồn bên ngoài đóng góp khác nhau cho hệ vi sinh vật nước nuôi
Nước nuôi thường xuyên nhận được vi khuẩn đầu vào thông qua việc bổ sung thức ăn sống, thức ăn khô và nước thay thế, mỗi loại đều có thể đóng góp vào hệ vi sinh vật trong nước nuôi. Một số tác giả đã đưa ra giả thuyết rằng sự hiện diện của các đơn vị cụ thể trong nước nuôi là do việc bổ sung yếu tố đầu vào này (Zheng và cộng sự, 2017; Walburn và cộng sự, 2019; Angthong và cộng sự, 2020). Tuy nhiên, tầm quan trọng tương đối của từng yếu tố đầu vào này đối với cộng đồng nuôi trồng thủy sản vẫn chưa được định lượng (Vadstein và cộng sự, 2018).
Phân tích theo dõi nguồn cho thấy rằng hệ vi sinh vật của tất cả các nguồn bên ngoài (tảo, Artemia, thức ăn khô và nước trao đổi) đã góp phần vào hệ vi sinh vật nước nuôi và rằng ± 10% OTUS nước nuôi (tức là 42 trên 498) đã được đưa vào thông qua các nguồn này (Hình 5A). Khi tính đến sự tăng trưởng của các đơn vị phân loại được đưa vào trong nước nuôi, chúng chiếm 37% quần thể nước nuôi trong toàn bộ quá trình canh tác. Điều này minh họa rằng một số đơn vị phân loại được giới thiệu đã có thể phát triển để trở thành thành viên cộng đồng dồi dào. Nói chung, khi so sánh lượng vi khuẩn mà các nguồn gây ra đối với nước nuôi và lượng vi khuẩn sản xuất trong bể nuôi, thì lượng vi khuẩn sản sinh ra là nguồn vi khuẩn chính (tức là mật độ vi khuẩn tăng từ 4,21 ± 1,44 x 105 tế bào/ mL lúc ban đầu lên tới 9,16 x 107 tế bào/ mL khi kết thúc quá trình nuôi cấy trong khi lượng vi khuẩn thông qua việc bổ sung các hệ vi sinh vật ngoại vi là 1,45 x 102 -1,22 x 104 tế bào/ mL/ ngày). Sự đóng góp của các nguồn khác nhau rất khác nhau về số lượng OTUS được đưa vào, thời gian cư trú và độ phong phú tương đối trong nước nuôi. Đóng góp lớn nhất của tảo, tiếp theo là Artemia, nước thay thế và thức ăn khô (Hình 5).
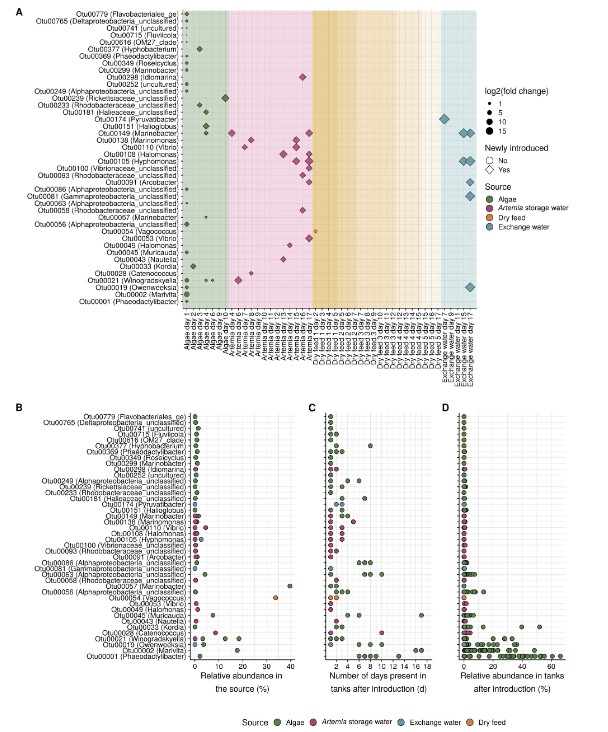
Việc bổ sung Artemia và tảo dẫn đến lượng vi khuẩn tương tự trong nước nuôi (Hỗ trợ Thông tin Hình S8). Tuy nhiên, số lượng OTUS được du nhập qua tảo cao hơn so với Artemia (tức là 26 so với 15) và thời gian hiện diện cũng như mật độ tương đối thu được từ OTUS liên quan đến tảo cao hơn (Hình 5). Điều này một phần có thể được giải thích bởi thực tế là điều kiện nước nuôi thường tạo điều kiện thuận lợi cho việc lựa chọn vi khuẩn từ môi trường nuôi cấy tảo so với điều kiện của Artemia (Hình 6B). Một cách giải thích khác cho sự đóng góp nhiều hơn của tảo có thể là tảo được bổ sung ngay từ đầu quá trình canh tác, trong khi việc bổ sung Artemia bắt đầu muộn hơn (Hình 1). Khi bắt đầu, nước nuôi đã được khử trùng một phần và lượng vi khuẩn dồi dào được cho là sẽ ở dưới mức chịu đựng (De Schryver và Vadstein, 2014). Trong những ngày tiếp theo, thức ăn và phân tích tụ trong nước nuôi, gây ra hiện tượng phú dưỡng dần dần và do đó thúc đẩy sự phát triển của vi khuẩn (Payne và cộng sự, 2006); do đó, lượng chất dinh dưỡng sẵn có trên mỗi tế bào có thể cao hơn trong quá trình đưa vi khuẩn liên quan đến tảo vào nuôi so với Artemia. Nghiên cứu về sự xâm lấn đã chỉ ra rằng sự sẵn có của các chất dinh dưỡng là một trong những yếu tố chính ảnh hưởng đến tính nhạy cảm của các cộng đồng trước sự xâm lấn (Eisenhauer và cộng sự, 2013; Mallon và cộng sự, 2015).
Bất chấp sự đóng góp thể tích lớn của nước thay thế (tức là 30% -50% thể tích bể), chỉ có sáu OTUS được đưa vào. Điều này có thể được giải thích bởi mật độ vi khuẩn thấp trong các vùng nước thay thế này (tức là thấp hơn 2 log10 đơn vị so với thức ăn sống). Theo nghiên cứu của Giatsis và cộng sự (2015), thức ăn khô đóng góp ít vào nước nuôi. Điều này có thể được giải thích bằng sự kết hợp giữa chọn lọc đối với các thành viên trong cộng đồng thức ăn (Hình 6B) và lượng vi khuẩn trong nước nuôi thấp hơn so với thức ăn sống. Ngoài ra, như đã đề cập ở trên, hệ vi sinh vật trong thức ăn khô có thể chứa một phần lớn các tế bào không thể sống được.
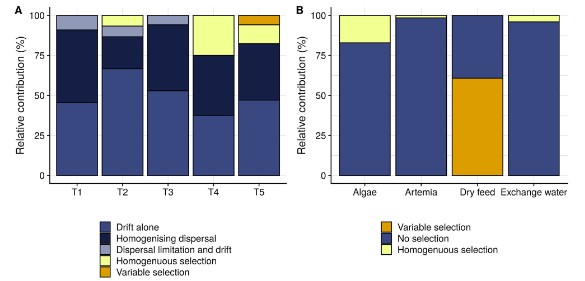
Hình 6. Quy trình tập hợp cộng đồng chiếm ưu thế cho các bể riêng lẻ (A) và từ nguồn đến nước nuôi (B), như được dự đoán bằng cách sử dụng khuôn khổ của Stegen và cộng sự (2013). Các thanh biểu thị sự phân bổ các dự đoán kết hợp trên mỗi bể (A) hoặc trên mỗi nguồn (B). Các quy trình màu xanh tượng trưng cho các cơ chế tập hợpngẫu nhiên, các quy trình màu vàng tượng trưng cho các cơ chế chọn lọc. Lưu ý rằng cả hai hình đều có thang màu riêng biệt. [Hình màu có thể được xem tại wileyonlinelibrary.com]
Điều thú vị là tảo chịu trách nhiệm đưa vào một số taxon có tương quan với lượng tảo dồi dào trong nước nuôi trong nửa đầu của quá trình nuôi trồng (ví dụ Phaeodactylibacter sp., Marvita sp. và Owenweeksia sp.), và theo cách đó đã góp phần vào tác dụng ổn định quan sát được của cộng đồng vi khuẩn liên quan đến tảo. Mặt khác, các OTU được giới thiệu cũng bao gồm các nhóm phân loại được xác định là dấu hiệu sinh học cho năng suất tôm kém (ví dụ Vibrionaceae sp., có nguồn gốc từ Artemia).
Nhìn chung, những kết quả này minh họa rằng hệ vi sinh vật ngoại vi có đóng góp quan trọng đối với hệ vi sinh vật nước nuôi. Với sự đóng góp này, việc chuẩn bị và lưu trữ cẩn thận những đầu vào này sẽ là điều tối quan trọng để duy trì hệ thống ổn định, lành mạnh. Dựa trên nghiên cứu này, việc vệ sinh hệ vi sinh vật trong thức ăn sống cần được ưu tiên so với vệ sinh thức ăn khô và nước trao đổi. Tuy nhiên, dòng vi khuẩn từ các đầu vào này có thể khác nhau tùy thuộc vào cách thiết lập (tức là phương pháp nuôi cấy, quy trình khử trùng, v.v.; Vadstein và cộng sự, 2018). Cần lưu ý rằng có những nguồn có thể được mong đợi sẽ đóng góp cho cộng đồng nuôi trồng thủy sản, nhưng những đóng góp đó chưa được định lượng trong nghiên cứu hiện tại (ví dụ: không khí, vi khuẩn còn sót lại trong bể sau khi làm sạch và trước khi đổ đầy nước vào bể, phân của tôm, v.v.).
5. Kết luận
Nghiên cứu này đã định lượng tầm quan trọng của thức ăn sống/ khô và nước thay thế với thành phần quần xã trong nước nuôi ấu trùng L. vannamei. Cùng với những yếu tố đầu vào này chiếm 37% tổng số vi khuẩn mà ấu trùng đã tiếp xúc trong quá trình nuôi. Sự đóng góp của mỗi nguồn phụ thuộc vào thành phần phân loại, tải lượng vi khuẩn gây ra bởi bổ sung nguồn này và thời điểm du nhập. Tập hợp cộng đồng tạm thời ở nước nuôi chủ yếu bị chi phối bởi tính ngẫu nhiên, chứng thực sự thay đổi của thành phần và hiệu suất canh tác giữa các lần nuôi lặp lại được ghi lại trước đó. Ngoài ra, tác động của quần thể tảo trong nước nuôi gây ra sự thay đổi trong thành phần cộng đồng vi khuẩn. Những phát hiện cung cấp kiến thức cơ bản về các nguồn và quy trình tổng hợp của hệ vi sinh vật nuôi trồng thủy sản, có thể hỗ trợ phát triển cách quản lý hệ vi sinh vật hiệu quả nhằm giảm thiểu các bệnh do vi khuẩn và duy trì môi trường nước nuôi tăng cường sức khỏe.
Theo Jasmine Heyse, Ruben Props, Pantipa Kongnuan, Peter De Schryver, Geert Rombaut, Tom Defoirdt, Nico Boon
Nguồn: https://ami-journals.onlinelibrary.wiley.com/doi/epdf/10.1111/1462-2920.15310
Biên dịch: Nguyễn Thị Quyên – Bình Minh Capital
Xem thêm:
- Thiết Kế Kế Hoạch An Toàn Sinh Học Trong Nuôi Tôm (Phần 1)
- Các Chủng Bacillus Khác Nhau Được Phân Lập Từ Tôm Sống Sót Sau Bệnh Hoại Tử Gan Tuỵ Cấp (AHPND) Có Thể Làm Giảm Tỷ Lệ Chết Ở Tôm Như Thế Nào?
- Shrimp III: Dịch bệnh và lợi nhuận

 English
English