Kỹ Thuật Nuôi, Tin tức
Ảnh Hưởng Của Việc Sử Dụng Chế Phẩm Sinh Học (Sanolife PRO-W) Đến Hiệu Suất Tăng Trưởng Của Hệ Động Vật Meiofauna Và Cá Rô Phi Trong Ao Đất
Tóm tắt
Sự tương tác giữa cá và chế phẩm sinh học đã được nghiên cứu rộng rãi, nhưng sự tương tác giữa meiofauna, chế phẩm sinh học và cá vẫn chưa được khám phá. Một nghiên cứu được thực hiện từ tháng 9/2019 – tháng 7/2020 đã đánh giá tác động của men vi sinh (Sanolife PRO-W) đối với sự phong phú, sinh khối và tính đa dạng của meiofauna cũng như tác động của những tác động này đối với cá rô phi sông Nile. Hai nghiệm thức được áp dụng trong ao đất: đối chứng (C) và xử lý bằng men vi sinh (T). Vào vụ xuân hè, mỗi ao được chia thành hai khu vực có cá (O) và không có cá (I). Mẫu được thu ngẫu nhiên 2 tháng 1 lần và hàng tháng từ các ao nuôi vào mùa thu đông và xuân hè. Kết quả cho thấy, loài Cladocera, Rotifera, Nematoda và Oligochaeta chiếm ưu thế trong ao được xử lý bằng chế phẩm sinh học. Độ phong phú, sinh khối và đa dạng của hệ động vật meiofauna không có sự khác biệt giữa các ao vào vụ thu đông. Tuy nhiên, vào mùa xuân hè, sự phong phú của hệ động vật meiofauna khác nhau ở các cặp xử lý sau: CO so với TO, CI so với TI, CI so với CO và TI so với TO. Hơn nữa, sinh khối khác nhau về CO so với TO và CI so với TI, trong khi tính đa dạng khác nhau về CI so với TI và TI so với TO. Những kết quả này cung cấp thêm thông tin về sự tương tác tích cực giữa cá và probiotic; tuy nhiên, cần có nghiên cứu bổ sung để khám phá các mối quan hệ được xác định trong những kết quả sơ bộ này.
1. Giới thiệu
Dân số toàn cầu đang tăng nhanh, tạo ra nhu cầu lương thực ngày càng tăng. Nghề nuôi trồng thủy sản là một cách để đáp ứng nhu cầu này, nhưng nó cũng gây ra những vấn đề môi trường, chẳng hạn như sự xuất hiện của các sinh vật gây bệnh kháng thuốc và sự suy giảm các sinh vật tái chế chất dinh dưỡng. Vi sinh vật đóng vai trò quan trọng trong hệ thống nuôi trồng thủy sản. Chúng giúp phân hủy chất hữu cơ, giảm bùn, tăng sinh động vật phù du, và giải phóng glucose và axit amin tự do cho các vi khuẩn có lợi. Ngoài ra, vi sinh vật còn có thể giúp cải thiện sức khỏe và năng suất của sinh vật nuôi. Trên thực tế, phương pháp này được xem là mang lại lợi ích cao hơn tất cả các phương pháp khác được sử dụng (Lara-Flores, 2011); (Elsabagh và cộng sự, 2018). Hầu hết tất cả các nghiên cứu liên quan đến sinh vật nuôi cấy được xử lý bằng men vi sinh đều bỏ qua mối quan hệ sinh thái của sinh vật mục tiêu, ví dụ như meiofauna (El- Saadony và cộng sự, 2021; Irianto & Austin, 2002; Pandiyan và cộng sự, 2013). Meiofauna rất phổ biến và đa dạng, do đó được coi là rất quan trọng đối với hoạt động bình thường của tất cả các môi trường dưới nước (Boulton và cộng sự, 2002; Schratzberger & Ingels, 2018). Kích thước nhỏ, độ phong phú cao và đặc điểm năng suất khiến hệ động vật meiofauna trở thành mối liên kết quan trọng giữa bậc dinh dưỡng thấp hơn và cao hơn của các hệ sinh thái thủy sinh (Ptatscheck và cộng sự, 2020; Schmid-Araya và cộng sự, 2002; Weber & Traunspurger, 2015). Ngoài việc tái chế chất hữu cơ, meiofauna còn là nguồn thức ăn thiết yếu cho cá (Weber & Traunspurger, 2015).
Nghiên cứu này nhằm mục đích thu thập thông tin về mối quan hệ giữa probiotic – meiofauna – cá bằng cách đánh giá các phản ứng của meiofauna theo thời gian (về độ phong phú, sinh khối và tính đa dạng) đối với việc sử dụng probiotic khi nuôi cá trong ao đất, cũng như những tác động tiếp theo của những phản ứng này trên cá rô phi sông Nile nuôi (Oreochromis niloticus). Nghiên cứu của chúng tôi nhằm mục đích cung cấp cái nhìn sâu sắc về vai trò tiềm năng của meiofauna trong việc cải thiện khả năng tăng trọng và năng suất cá nuôi thông qua probiotic. Vai trò này trước đây chưa từng được xem xét; do đó, nghiên cứu của chúng tôi sẽ cung cấp thêm thông tin cho sự hiểu biết hiện tại về mối quan hệ tích cực giữa chế phẩm vi sinh và cá.
2. Vật liệu và phương pháp
2.1. Tuyên bố đạo đức
Các tác giả xác nhận rằng các nguyên tắc đạo đức của tạp chí đã được tuân thủ, như đã nêu trên trang hướng dẫn tác giả của tạp chí, đồng thời quy trình và cách tiến hành nghiên cứu đã được xem xét và phê duyệt bởi Ủy ban Chăm sóc và Sử dụng Động vật Thủy sản trong Nghiên cứu, Khoa Khoa học Thủy sản và Thủy sản, Đại học Kafrelsheikh, Ai Cập (số phê duyệt: IAACUC- KSU- 30- 2019).
2.2. Khu vực nghiên cứu
Nghiên cứu được thực hiện ở phía tây bắc đồng bằng sông Nile ở tỉnh Kafr Elsheikh, Ai Cập. Một số ao đất được sử dụng để nuôi cá rô phi sông Nile. Hai ao có tọa độ như sau được chọn làm ao đối chứng (C) (31° 21’16,33”N, 30° 39’10,61”E) và ao bổ sung Probiotic (Sanolife PRO-W) (T) (31°21’15,26”B, 30°39’10,47”Đ). Mỗi ao có chiều dài 60 m, chiều rộng 50 m và sâu khoảng 1,5 m.
2.3. Thiết kế nghiên cứu
Nghiên cứu bao gồm hai bản thiết kế được tính thời gian để xảy ra đồng thời (Hình 1). Đầu tiên là nghiên cứu theo mùa về tác dụng của chế phẩm sinh học Sanolife PRO-W trong nước (hỗn hợp của Bacillus subtilis và Bacillus licheniformis ở 5 × 105 cfu/g; INVE Aquaculture, Bỉ) đối với sự phong phú, sinh khối và đa dạng của meiofauna (C so với T), diễn ra từ tháng 9/2019 đến tháng 7/2020 (tức là trong tất cả các mùa), khi có cá nuôi. Vào vụ xuân hè (từ 4/2020 đến 7/2020), mỗi ao dùng lưới cỡ mắt lưới 0,25 cm để ngăn cách một khu vực (1 m2) làm khu thả cá, dùng để xác định tác dụng trực tiếp của probiotic lên meiofauna. Để ngăn cản cá xâm nhập vào khu vực này, phải đảm bảo không có khe hở giữa mép dưới của lưới và đáy ao, mép trên của lưới đặt cao hơn mặt nước 30 cm. Việc giăng lưới này nhằm tạo ra hai khu vực dành cho cá: bên ngoài lưới (O) và bên trong lưới (I) ở mỗi ao. Do đó, chúng tôi đã phân loại các khu vực ao nuôi theo CO và TO trong suốt nghiên cứu (thiết kế đầu tiên), cũng như CI và TI chỉ trong mùa xuân hè (thiết kế thứ hai). Trong thiết kế thứ hai, diện tích 1 m2 được chỉ định là khu vực không có cá để giảm thiểu tác đông kinh tế không mong muốn cho chủ ao khi giảm diện tích nuôi cá trong mỗi ao. Khu vực không có cá được sử dụng vào mùa xuân hè vì meiofauna có xu hướng phong phú hơn vào những mùa này (Abada, 2000). Vì lý do tương tự, khoảng thời gian lấy mẫu xen kẽ trong thiết kế đầu tiên dài hơn thời gian lấy mẫu trong thiết kế thứ hai.
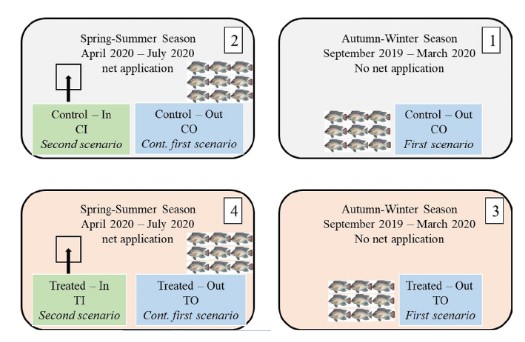
Hình 1 Sơ đồ trình bày các bản thiét kế nghiên cứu. 1, 2 đại diện cho ao đối chứng và 3, 4 đại diện cho ao được xử lý ở hai bảng thời gian khác nhau, đại diện cho khu vực không có cá I
Sanolife PRO-W được bổ sung vào ao đã xử lý với tỷ lệ 30 g mỗi ao (50 g/feddan) 2 tuần/lần theo hướng dẫn của nhà sản xuất.
2.4. Mẫu và chiết xuất Meiofauna
Ba mẫu trầm tích lặp lại được thu thập ngẫu nhiên từ mỗi ao và khu vực (theo hai thiết kế đã đề cập trước đó) bằng cách sử dụng lõi kim loại (dài 10 cm và đường kính 3,6 cm). Các mẫu được đặt trong túi nhựa, cố định và nhuộm màu lần lượt bằng dung dịch đệm formalin 10% và Rose Bengal 0,01%; sau đó, chúng được chuyển đến phòng thí nghiệm để xử lý tiếp. Meiofauna được chiết xuất bằng kỹ thuật chiết tuyển nổi được mô tả bởi Somerfield và cộng sự (2005).
2.5. Cá rô phi sông Nile: Thích nghi, thả giống và cho ăn
Cá rô phi sông Nile đơn tính được cho thích nghi trong điều kiện trang trại trong hai tuần. Cá (trọng lượng trung bình: 20 ± 0,725 g; n = 12.000) được thả ngẫu nhiên vào các ao được mô tả trước đó. Chúng được cho ăn khẩu phần ăn cá rô phi thương mại (300 g/kg protein thô và 12,6 MJ/kg năng lượng tiêu hóa) do Nhà máy thức ăn chăn nuôi ALEKHWA® (Kafrelsheikh, Ai Cập) sản xuất từ tháng 9 – 10 năm 2019 và từ tháng 4 – 7 năm 2020 với tỷ lệ cho ăn từ 4% đến 2% trọng lượng cơ thể tùy theo trọng lượng cá.
2.6. Ước tính sinh khối
Phân tích sinh trắc học Meiofauna (chiều dài và chiều rộng) được đo (cm) bằng kính hiển vi giải phẫu hai mắt được kết nối với máy tính có cài đặt phần mềm phân tích hình ảnh Motic 3.0. Giá trị sinh khối (trọng lượng khô) được tính theo phương pháp của (Ramsay và cộng sự, 1997). Sinh khối taxon trung bình được ước tính cho 11 taxon đại diện bởi Nematoda, Rotifera, Oligochaeta, ve, Copepoda, Cladocera, Collembola, Chironomidae, ấu trùng Dipteran, Dipteran và Gastrotricha. Các đơn vị phân loại khác không được xem xét trong ước tính sinh khối vì chúng là giai đoạn ấu trùng của các đơn vị phân loại nói trên hoặc chúng không được tìm thấy đủ số lượng để ước tính hợp lệ.
2.7. Lấy mẫu phi sinh học
Các thông số sinh thái được biểu thị bằng nhiệt độ (°C), khả năng oxy hóa-khử (mv), pH, oxy hòa tan (% và mg/L), độ dẫn điện (μs/cm), tổng lượng chất hòa tan (mg/L) và độ mặn (psu) được đo tại hiện trường bằng Máy dò chất lượng nước đa thông số Aquaprobe® AP-700. 2 bộ ba mẫu trầm tích tái tạo được thu thập trên mỗi khu vực để đánh giá kích thước hạt trung bình của trầm tích và xác định chất hữu cơ trong phòng thí nghiệm. Sử dụng sàng rây ướt để xác định kích thước hạt trung bình theo mô tả của Buchanan (1984). Hàm lượng chất hữu cơ được xác định theo phương pháp của Ben-Dor và Banin (1989).
2.8. Hiệu suất tăng trưởng của cá và hiệu quả sử dụng thức ăn
Để đánh giá hiệu suất tăng trưởng của cá, cá được thu hoạch vào cuối giai đoạn nghiên cứu và được gây mê bằng dầu đinh hương (Merck, Đức) với tốc độ 50 µL/L nước. Cá được cân riêng lẻ để xác định trọng lượng cuối cùng (trọng lượng ban đầu được đo khi bắt đầu thí nghiệm). Tổng chiều dài của từng cá thể được xác định bằng bảng đo. Các công thức sau đây được sử dụng để tính toán hiệu suất tăng trưởng và sử dụng thức ăn:
Tăng trọng = trọng lượng cơ thể cuối cùng (g) – trọng lượng cơ thể ban đầu (g),
Tốc độ tăng trưởng cụ thể (%/ngày) = 100 × (ln trọng lượng cơ thể cuối cùng − ln trọng lượng cơ thể ban đầu)/t,
trong đó t là thời gian nghiên cứu tính bằng ngày,
Tỷ lệ chuyển đổi thức ăn = lượng ăn vào (g)/tăng trọng (g),
Hệ số điều kiện = 100 × (trọng lượng cơ thể cuối cùng/chiều dài cuối cùng3)
2.9. Phân tích thống kê
Các yếu tố môi trường, cũng như sự phong phú, sinh khối và tính đa dạng của meiofauna, được phân tích bằng PRIMER 6 và PERMANOVA+ (Anderson và cộng sự, 2008). Dữ liệu phi sinh học được chuyển đổi log+1- và chuẩn hóa để tính toán ma trận tương tự. Dữ liệu sinh học được lấy căn bậc hai và biến đổi log+1- tương ứng cho độ phong phú và sinh khối để tính toán ma trận tương đồng của chúng. Các ma trận tương tự được sử dụng để vẽ đồ thị tỷ lệ đa chiều không theo hệ mét (nMDS), thực hiện các thử nghiệm PERMANOVA (chính và theo cặp) và các thử nghiệm CAP (phân tích chính tắc trên tọa độ chính) (được sử dụng để kiểm tra sự khác biệt giữa các địa điểm, ngày lấy mẫu và khu vực ao) và trực quan hóa các hành động tương tác, không thể hiện rõ từ nMDS hoặc sự sắp xếp tọa độ chính. Mô hình tuyến tính dựa trên khoảng cách được sử dụng để ước tính các biến số môi trường liên quan đến dữ liệu sinh vật. Chỉ số đa dạng của Shannon được tính toán bằng PRIMER 6 & PERMANOVA+.
Dữ liệu về hiệu suất tăng trưởng của cá và hiệu quả sử dụng thức ăn được đánh giá bằng cách sử dụng Graph Pad Prism 6 v6.0 (San Diego, CA, USA) để đánh giá sự phân bố bình thường thông qua phân tích dư lượng. Những dữ liệu này được phân tích phụ bằng cách sử dụng phân tích Student’s t-test. Dữ liệu được trình bày dưới dạng phương tiện ± lỗi tiêu chuẩn. Ý nghĩa thống kê được đặt ở mức xác suất 5%.
3. Kết quả
3.1. Biến số môi trường
Các biến số môi trường của địa điểm nghiên cứu và diện tích ao được trình bày trong Bảng 1. Các biến môi trường có giá trị khác nhau đáng kể giữa các địa điểm, ngày lấy mẫu và sự tương tác của chúng, nhưng không có sự khác biệt đáng kể giữa các diện tích ao nuôi theo phân tích PERMANOVA (Bảng 2; Hình 2).
Bảng 1. Các biến số môi trường tại địa điểm, khu vực ao và ngày lấy mẫu
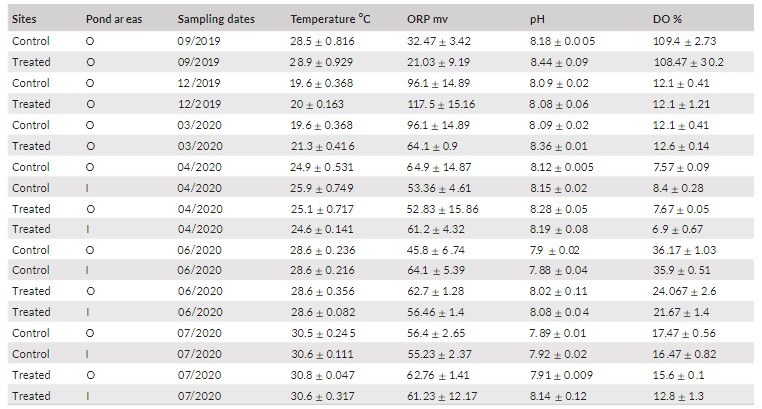
O= diện tích ao O (có cá), I= diện tích ao I (không có cá), ORP, khả năng oxy hóa-khử; DO%, phần trăm oxy hòa tan; DO mg/l, nồng độ oxy/lít; EC, độ dẫn điện; và TDS, tổng chất rắn hòa tan
Bảng 2. Thử nghiệm chính PERMANOVA về các yếu tố môi trường giữa các địa điểm, khu vực ao và ngày lấy mẫu cũng như sự tương tác của chúng với giá trị P(perm) của chúng
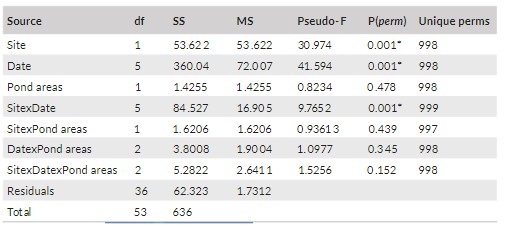
*Biểu thị sự khác biệt có ý nghĩa ở mức α = 0,05 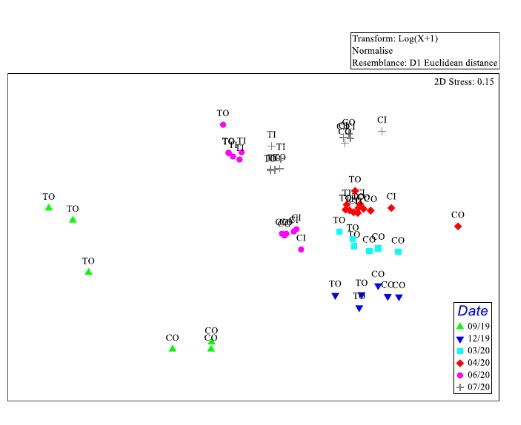
Hình 2. Tỷ lệ đa chiều phi số liệu (nMDS) của biến đổi môi trường log+1- của hai ao và khu vực của chúng (C=đối chứng, T=được xử lý, O= diện tích ao O và I= diện tích ao I); (9= Tháng 9 năm 2019, 12= Tháng 12 năm 2019, 3= Tháng 3 năm 2020, 4=Tháng 4 năm 2020, 6= Tháng 6 năm 2020 và 7= Tháng 7 năm 2020)
Hàm lượng carbon hữu cơ cao vào tháng 9 và tháng 12 năm 2019, cũng như nồng độ oxy vào tháng 9 năm 2019. Hơn nữa, nhiệt độ cao vào tháng 9 năm 2019 và tháng 6 năm 2020 và đạt đỉnh điểm vào tháng 7 năm 2020. Trong ao được xử lý bằng men vi sinh, tổng lượng chất hòa tan và độ dẫn điện nhìn chung thấp so với các ao đối chứng. Ngoài ra, nồng độ amoniac đạt đỉnh điểm vào tháng 7 năm 2020 ở ao đối chứng.
3.2. Tổng quan sự phong phú của hệ sinh vật meiofauna
Loài Ephippia có lượng CO và TO trung bình tổng thể cao nhất, lần lượt là 24.293 và 98.154 cá thể/m2 (tăng khoảng 4 lần trong ao được xử lý bằng chế phẩm sinh học). Về CO, độ phong phú trung bình thấp nhất là ở Collembola với 45 cá thể/m2; đây cũng là mức độ phong phú trung bình thấp nhất đối với ấu trùng Collembola, Chironomidae, Diptera và Gastrotricha ở TO. Ở CI và TI, độ phong phú trung bình cao nhất là Rotifera với mật độ lần lượt là 6.004 và 57.091 cá thể/m2 (tăng khoảng 10 lần trong ao được xử lý bằng chế phẩm sinh học). Ngược lại, mật độ trung bình tối thiểu ở CI là 109 cá thể/m2 đối với ấu trùng Copepoda, mites và Nematoda, với cùng mức độ phong phú trung bình tối thiểu của Collembola và mites được tìm thấy ở TI. Độ phong phú trung bình của Nematoda ở TI cao gấp 21 lần so với CI và 1,5 lần ở TO so với CO. Tương tự, độ phong phú của Oligochaeta ở TO cao gấp 11 lần so với CO. Copepoda trưởng thành không được tìm thấy ở TI hoặc CI (Bảng 3).
3.3. Sự phong phú của meiofauna thay đổi theo thời gian và không gian
Những thay đổi về độ phong phú của meiofauna tương đối nhất quán. Độ phong phú trung bình tối đa được ghi nhận vào tháng 9 năm 2019 đối với CO và TO lần lượt là 83.507 và 477.137 cá thể/m2 ở Rotifera và ephippia. Nematoda có mức độ phong phú trung bình cao vào tháng 9 năm 2019 và vào tháng 4, tháng 6 và tháng 7 năm 2020 ở TO so với mức độ phong phú ở CO. Vào tháng 9 năm 2019 và vào tháng 3, tháng 4 và tháng 6 năm 2020, mức độ phong phú trung bình của Oligochaeta trong TO lớn hơn mức được phát hiện ở CO trong cùng thời kỳ (Bảng 3). Ở cả hai địa điểm, mức độ phong phú thấp nhất được ghi nhận vào tháng 12 năm 2019 và ngày 6 tháng 3, 2020: trong CO, Collembola và Oligochaeta được phát hiện196 cá thể/m2 vào tháng 12 năm 2019 và Rotifera vào tháng 3 năm 2020; ở TO, Copepoda và Oligochaeta cũng được phát hiện 196 cá thể/m2 vào tháng 12 năm 2019 cũng như mites và Nematoda vào tháng 3 năm 2020.
Tương tự, mô hình phong phú trong CI và TI tương đối nhất quán. Độ phong phú tối đa được ghi nhận vào tháng 7 năm 2020 là 7.532 và 138.851 cá thể/m2 đối với Rotifera lần lượt ở CI và TI. Mức độ phong phú trung bình của Nematoda tăng từ tháng 4 đến tháng 7 năm 2020 ở TI so với mức độ phong phú của Nematoda trong CI (Bảng 3). Trong khi đó, mật độ thấp nhất được ghi nhận vào tháng 4 năm 2020 (327 cá thể/m2) đối với ấu trùng Copepoda, ve và Nematoda ở CI và mites và Collembola ở TI.
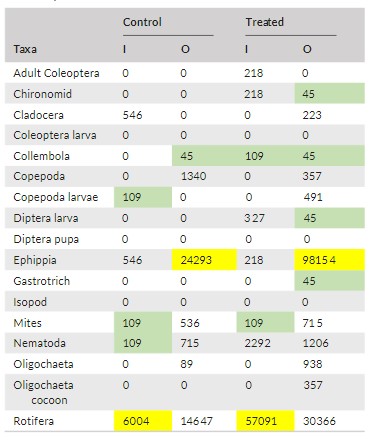
O= diện tích ao O (có cá), I= diện tích ao I (không có cá)
Phân tích PERMANOVA của dữ liệu độ phong phú được chuyển đổi căn bậc hai từ toàn bộ thời gian nghiên cứu cho thấy không có sự khác biệt đáng kể giữa các địa điểm. Tuy nhiên, mức độ phong phú thay đổi đáng kể theo các ngày lấy mẫu (mùa) và giữa các khu vực ao (Bảng 4; Hình 3a– c tương ứng cho các địa điểm, ngày tháng và diện tích ao).
Khi chia các khoảng thời gian lấy mẫu thành thu đông (tháng 9, tháng 12 và tháng 3) và xuân hè (tháng 4, tháng 6 và tháng 7), các thử nghiệm PERMANOVA cho kết quả hơi khác nhau. Mức độ phong phú của CO và TO không khác nhau về mặt không gian trong mùa thu đông [P(perm) = 0,677]; tuy nhiên, chúng khác nhau về mặt thời gian [P(perm) = 0,008] (Bảng 4; Hình 3d,e tương ứng cho các địa điểm và ngày tháng). Ngược lại, có sự khác biệt đáng kể về không gian [P(perm) = 0,0481] và thời gian [P(perm) = 0,0235] giữa mức độ phong phú của các địa điểm CO và TO trong mùa xuân hè (Bảng 4; Hình 3f, g tương ứng với các địa điểm và ngày tháng).
Phân tích PERMANOVA của quần thể động vật thủy sinh có nhiều ở CI và TI vào mùa xuân hè cho thấy sự khác biệt đáng kể về không gian [P(perm) = 0,029] nhưng không có sự khác biệt về thời gian [P(perm) = 0,204] (Bảng 4; Hình 3h,i tương ứng với các địa điểm và ngày tương ứng).
Sự phong phú ở các khu vực O và I trong các địa điểm C và T vào mùa xuân hè khác nhau đáng kể về mặt thời gian và không gian [địa điểm C: P (perm) = 0,003 và 0,007, (Bảng 4, Hình 3j, k cho ngày tháng và diện tích ao , tương ứng); địa điểm T: P(perm) = 0,023 và 0,019 tương ứng (Bảng 4; Hình 3l,m tương ứng cho ngày và diện tích ao)].
Bảng 4. Thử nghiệm chính của PERMANOVA về dữ liệu phong phú giữa các địa điểm
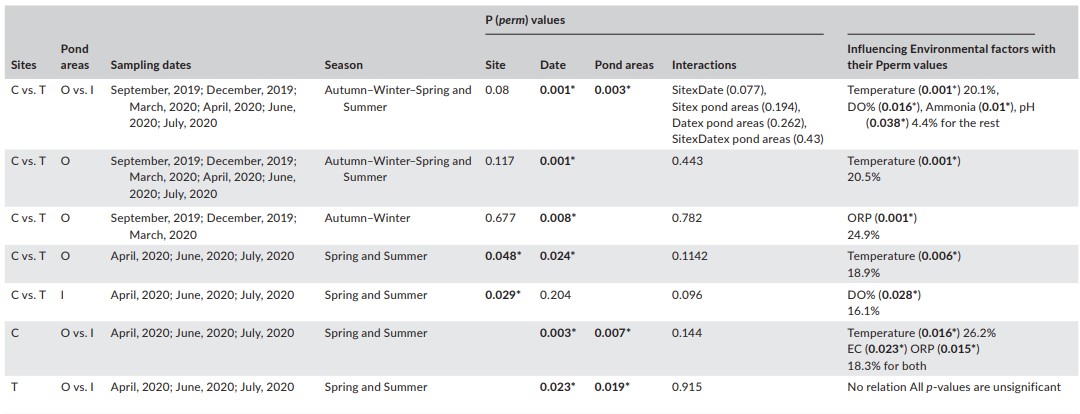
(C= đối chứng, T=được xử lý), diện tích ao (O= diện tích ao O (có cá), I= diện tích ao I (không có cá) và ngày lấy mẫu cũng như tương tác của chúng với giá trị P perm của chúng đối với tất cả các kết hợp so sánh có thể có. Pperm= giá trị p sử dụng hoán vị 999. * Biểu thị sự khác biệt đáng kể ở mức α = 0,05
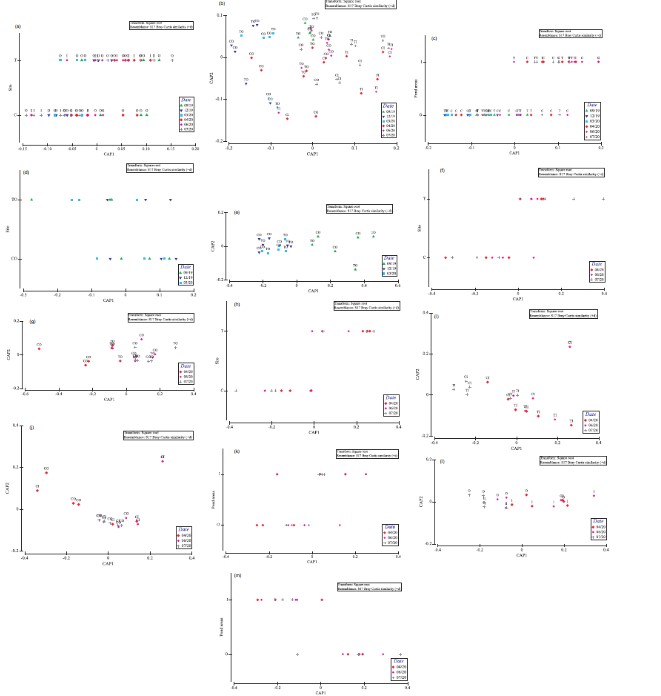
Hình 3. Phân tích chính tắc về tọa độ chính (CAP) của sự phong phú của meiofauna [tất cả các kết hợp so sánh có thể có (trong ngoặc)]. (a) COITOI 9123467 (địa điểm); (b) COITOI 9123467 (Ngày lấy mẫu); (c) COITOI 9123467 (khu vực ao nuôi); (d) COTO 9123 (Địa điểm); (e) COTO 9123 (Ngày lấy mẫu); (f) COTO 467 (Địa điểm); (g) COTO 467 (Ngày lấy mẫu); (h) CITI 467 (Địa điểm); (i) CITI 467 (Ngày lấy mẫu); (j) COCI 467 (Ngày lấy mẫu); (k) COCI 467 (khu vực ao nuôi); (l) TOTI 467 (Ngày lấy mẫu); (m) TOTI 467 (khu vực ao); (C=đối chứng, T=xử lý, O= diện tích ao O và I= diện tích ao I); (9= tháng 9 năm 2019, 12= tháng 12 năm 2019, 3= tháng 3 năm 2020, 4=tháng 4 năm 2020, 6= tháng 6 năm 2020 và 7= tháng 7 năm 2020
Các biến số môi trường không có tác động mạnh đến sự phong phú của quần thể sinh vật trong đó lời giải thích của chúng về sự biến đổi của quần xã là 4,4%– 26,2% (Bảng 4).
3.4. Sinh khối riêng lẻ trung bình
Ngoại trừ Nematoda và Rotifera, các thử nghiệm PERMANOVA chỉ ra rằng, sinh khối taxon trung bình của các taxon được phát hiện không khác biệt đáng kể ở cấp độ địa điểm, diện tích ao, ngày tháng và sự tương tác giữa các biến này.
3.5. Sinh khối meiofauna biến đổi theo thời gian và không gian
Phân tích PERMANOVA về dữ liệu tổng sinh khối được chuyển đổi log+1- giữa các địa điểm, khu vực ao và ngày trong toàn bộ thời gian nghiên cứu cho thấy có sự khác biệt đáng kể tồn tại giữa các địa điểm (C và T) và ngày tháng nhưng không tồn tại giữa các khu vực ao (O và I). Hơn nữa, vào vụ xuân hè, tổng sinh khối chỉ có sự khác biệt rõ rệt giữa các địa điểm chứ không khác biệt giữa các ngày hoặc giữa các diện tích ao nuôi.
Đối với diện tích ao O, so sánh tổng sinh khối trong toàn bộ thời gian nghiên cứu cho thấy sự khác biệt giữa địa điểm (C và T) và ngày tháng (mùa) là có ý nghĩa thống kê. Tổng sinh khối cũng khác nhau theo mùa giữa các địa điểm và vào các ngày khác nhau. Vào mùa thu đông, không có sự khác biệt đáng kể giữa các địa điểm [P(perm) = 0,285] nhưng sự khác biệt có ý nghĩa giữa các ngày [P(perm) = 0,004]. Tuy nhiên, mô hình này đã bị đảo ngược vào mùa xuân hè khi có sự khác biệt đáng kể giữa các địa điểm [P(perm) = 0,009] nhưng không có sự khác biệt đáng kể giữa các ngày [P(perm) = 0,101] (Bảng 5).
Đối với diện tích ao I, tổng sinh khối vào mùa xuân hè khác biệt đáng kể giữa các địa điểm [P(perm) = 0,002] nhưng không khác nhau giữa các ngày [P(perm) = 0,092]. Tổng sinh khối tại mỗi địa điểm trong suốt mùa xuân hè không khác biệt đáng kể theo diện tích ao (O hoặc I) hoặc ngày [P(perm) = 0,15 4 và 0,335], tương ứng, đối với địa điểm đối chứng; [P(perm) = 0,077 và 0,164], tương ứng, đối với vị trí được xử lý bằng men vi sinh (Bảng 5).
Bảng 5. Thử nghiệm chính của PERMANOVA về tổng dữ liệu sinh khối giữa các địa điểm
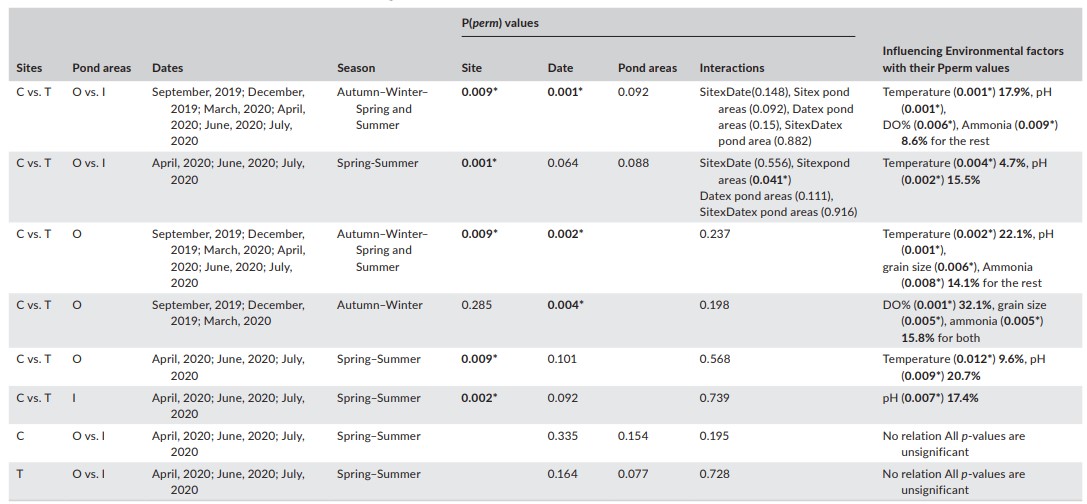
(C= đối chứng, T= được xử lý), diện tích ao (O= diện tích ao O (có cá), I= diện tích ao I (không có cá) và ngày lấy mẫu cũng như sự tương tác của chúng với các giá trị Pperm của chúng đối với tất cả các kết hợp so sánh có thể có. Pperm= giá trị p sử dụng hoán vị 999. * Biểu thị sự khác biệt đáng kể ở mức α = 0,05
Các biến số môi trường không ảnh hưởng đáng kể đến tổng sinh khối quan sát được trong đó tổng biến thiên sinh khối dao động từ 4,7%– 32,1%.
Tổng sinh khối biến đổi khác nhau theo thời gian giữa CO và TO. Nó ổn định hơn ở vị trí được xử lý bằng men vi sinh, nơi nó chỉ khác biệt giữa tháng 12 năm 2019 và tháng 7 năm 2020; tuy nhiên, trong CO, phát hiện hai sự khác biệt đáng kể giữa (i) tháng 9 năm 2019 và tháng 3 năm 2020 và (ii) tháng 9 năm 2019 và tháng 4 năm 2020. Hơn nữa, sự khác biệt này xuất hiện sớm hơn ở địa điểm đối chứng so với ở địa điểm được xử lý bằng chế phẩm sinh học. (Hình 4).
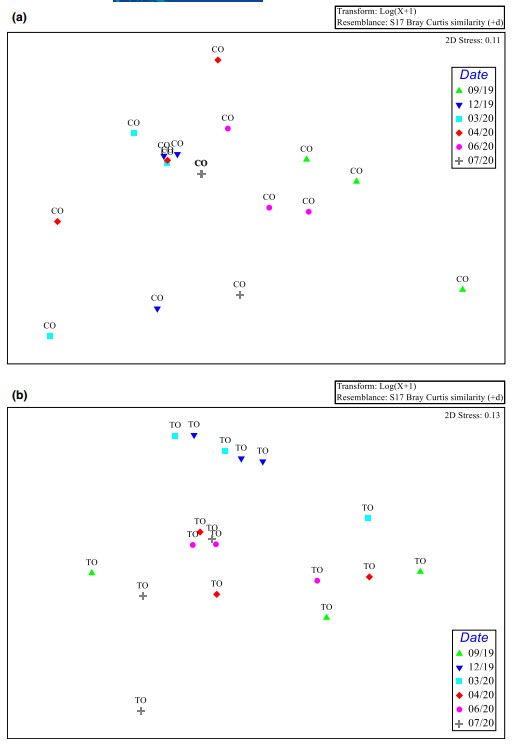
Hình 4. nMDS tổng sinh khối trong thời gian nghiên cứu ở (a) CO và (b) TO. (C=đối chứng, T=xử lý, O= diện tích ao O); (9= Tháng 9 năm 2019, 12= Tháng 12 năm 2019, 3= Tháng 3 năm 2020, 4=Tháng 4 năm 2020, 6= Tháng 6 năm 2020 và 7= Tháng 7 năm 2020)
3.6. Chỉ số đa dạng
Phân tích PERMANOVA về các chỉ số đa dạng được biểu thị bằng dữ liệu chỉ số của Shannon (số lượng loài hiệu quả) cho thấy rằng sự khác biệt về không gian và thời gian không tồn tại đối với CO so với TO trong mùa xuân hè [P (perm) = 0,101 và 0,339], COI so với TOI trong toàn bộ thời gian nghiên cứu [P(perm) = 0,937 và 0,53], CO so với CI vào mùa xuân–hè [P(perm) = 0,293 và 0,059] và CO so với TO vào mùa thu– mùa đông [P(perm) = 0,687 và 0,881]. Hơn nữa, tính đa dạng không khác nhau về mặt không gian đối với CI so với TI hoặc về mặt thời gian đối với TO so với TI [P(perm) = 0,298 và 0,142, tương ứng]. Tuy nhiên, các chỉ số đa dạng khác nhau về mặt không gian giữa hai khu vực ao của T và chúng khác nhau về mặt thời gian giữa khu vực ao I đối với C so với T [cả P (perm) = 0,013] (Bảng 6).
Bảng 6. Thử nghiệm chính PERMANOVA về chỉ số đa dạng (chỉ số Shannon) giữa các địa điểm
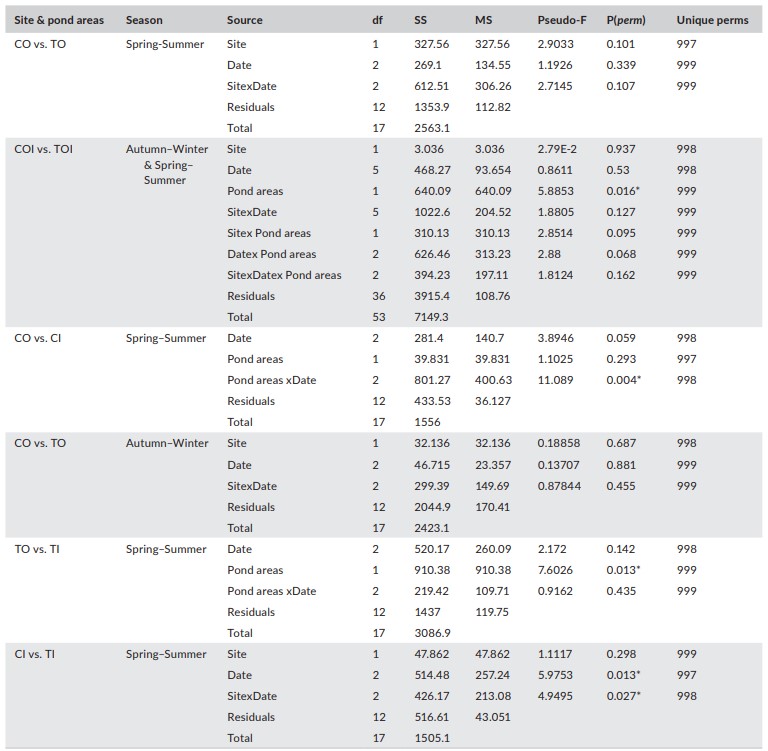
(C= đối chứng, T=được xử lý), diện tích ao (O= diện tích ao O (có cá), I= diện tích ao I (không có cá) và ngày lấy mẫu cũng như sự tương tác của chúng.
* Biểu thị sự khác biệt có ý nghĩa ở mức α = 0,05
3.7. Hiệu suất tăng trưởng của cá và hiệu quả sử dụng thức ăn
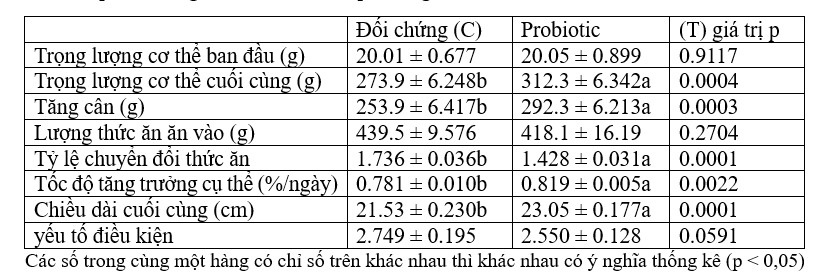
Hiệu suất tăng trưởng và hiệu quả sử dụng thức ăn của cá rô phi sông Nile nuôi trong ao đối chứng và ao được xử lý bằng men vi sinh được trình bày trong Bảng 7. So với cá nuôi trong ao đối chứng (C), cá được nuôi trong ao được xử lý bằng men vi sinh ( T) cho thấy trọng lượng cơ thể cuối cùng, tăng trọng, tốc độ tăng trưởng cụ thể và chiều dài cuối cùng tăng đáng kể, cũng như sự cải thiện đáng kể về tỷ lệ chuyển đổi thức ăn (p < 0,05). Tổng lượng thức ăn ăn vào và hệ số tình trạng của cá không khác biệt đáng kể giữa ao được xử lý bằng men vi sinh (T) và ao đối chứng (C).
Bảng 7. Ảnh hưởng của chế phẩm sinh học (Sanolife PRO-W) đến hiệu suất tăng trưởng và hiệu quả sử dụng thức ăn của cá rô phi sông Nile
4. Thảo luận
Mặc dù có rất nhiều nghiên cứu liên quan đến chế phẩm sinh học về hiệu suất tăng trưởng của cá và hiệu quả sử dụng thức ăn, cũng như các nghiên cứu về động vật không xương sống nuôi trồng có tầm quan trọng về mặt kinh tế khác, nhưng một số nghiên cứu đã đánh giá tác động của chế phẩm sinh học đối với hệ động vật đáy và tác động mà những tác động này có thể có đối với hoạt động nuôi cá. Tác dụng của men vi sinh đối với hệ meiofauna đã được báo cáo (chủ yếu đối với Rotifera, Cladocera và Artemia) (Arndt, 1993) (Agasild & Nõges, 2005) (Nevejan và cộng sự, 2016) (Marques và cộng sự, 2006) ), và tác dụng trực tiếp của men vi sinh đối với sinh vật nuôi cấy đã được nghiên cứu rộng rãi (Olafsen, 2001) (Elsabagh và cộng sự, 2018) (Islam và cộng sự, 2018). Người ta đã công nhận rằng tác dụng dinh dưỡng của men vi sinh có thể ảnh hưởng đến cả thức ăn sống và sinh vật mục tiêu trong nuôi trồng thủy sản (Balcázar và cộng sự, 2006) (Nevejan và cộng sự, 2016). Tuy nhiên, sự tương tác giữa men vi sinh và quần thể meiofauna trong các ao đất nuôi trồng thủy sản qua các mùa trước đây chưa được báo cáo.
Sự tồn tại của một taxon (đơn vị phân loại) được xác định bởi các tiêu chí như độ nhạy cụ thể đối với các kích thích môi trường. Ví dụ, các loài khác nhau về nhiệt độ tối ưu, hàm lượng oxy, độ dẫn điện và áp lực săn mồi (Ricci, 1991). Hơn nữa, sự hiện diện của các chủng vi khuẩn cụ thể có thể ảnh hưởng đến sự hiện diện của vi tảo do tác dụng diệt tảo của chúng, do đó có thể ảnh hưởng đến sự phong phú của một số loài vi tảo (Fukami và cộng sự, 1997; Munro và cộng sự, 1995; Rengpipat và cộng sự , 2008; Sihag & Sharma, 2012; Venkat và cộng sự, 2004).
Sự phong phú cao của cladocerans (ephippia) trong TO (gấp khoảng 4 lần so với CO) cung cấp bằng chứng cho thấy chế phẩm sinh học là nguồn thức ăn cho những sinh vật này. Kết quả này phù hợp với kết quả của Tezuka (1971), Geller và Müller (1981), Wylie và Currie (1991), và Nevejan và cộng sự (2016), đã phát hiện ra rằng khả năng lọc cao của một số loài giáp xác để cho thấy rằng vi khuẩn là một phần nguồn cung cấp thức ăn cho chúng. Các loài giáp xác chiếm ưu thế như ephippia có thể là do mật độ quá dày và căng thẳng về cá săn mồi (He và cộng sự, 2001; Milardi và cộng sự, 2016; Ślusarczyk và cộng sự, 2005). Cladocera tìm nơi ẩn náu khi đang ngừng phát dục trong lớp trầm tích, đây là một chiến lược được sử dụng để giảm bớt căng thẳng này. Nguyên nhân tương tự cũng có liên quan đến CO, nhưng mức độ phong phú thấp hơn được phát hiện do thiếu chế phẩm sinh học. Những phát hiện này phù hợp với nghiên cứu của Ślusarczyk (1999) và Slusarczyk và cộng sự (2013) đã nhấn mạnh ảnh hưởng của dịch tiết và mùi hương của cá đối với Daphnia magna làm tăng sản lượng trứng nghỉ.
Sự phong phú của Rotifera ở TI cao gấp 10 lần so với CI, điều này có thể là do sự dư thừa của vi khuẩn do sử dụng probiotic, đặc biệt là vi khuẩn là thức ăn chính của Rotifera (Agasild & Nõges, 2005 ; Arndt, 1993; Lê và cộng sự, 2017; Nevejan và cộng sự, 2016). Hơn nữa, do Rotifera được bảo vệ khỏi cá săn mồi ở khu vực ao I và mối tương quan tích cực đáng kể đã được báo cáo giữa mật độ luân trùng và/hoặc số lượng phân và lượng vi khuẩn (Le và cộng sự, 2017), nên sự phong phú của Rotifera tăng lên tương đối trong khu vực ao O. Một khả năng khác là luân trùng phản ứng với lưới như một nơi ẩn náu an toàn khỏi sự săn mồi và/hoặc xáo trộn của cá, dẫn đến sự phong phú của chúng ngày càng tăng. Phát hiện này phù hợp với phát hiện của Gonzalez Sagrario và Balseiro (2010), đã báo cáo rằng động vật phù du tránh được các địa điểm có thể xảy ra săn mồi. Tương tự, Sun và cộng sự (2010) chỉ ra tầm quan trọng của nơi trú ẩn cho động vật phù du khỏi sự săn mồi của cá rô phi.
Mặc dù căng thẳng săn mồi cá như nhau ở mỗi địa điểm, sự gia tăng tổng thể về số lượng Nematoda và Oligochaeta ở T so với ở C cho thấy phản ứng tích cực của các sinh vật này đối với việc sử dụng probiotic. Kết quả này phù hợp với kết quả của Ikeda và cộng sự (2007), Kim và Mylonakis (2012), Sharma và cộng sự (2019) đã phát hiện ra rằng việc tăng cường khả năng miễn dịch nhờ cho ăn men vi sinh sẽ làm tăng tuổi thọ của Caenorhabditis elegans. Tương tự, Subashini và cộng sự (2014) phát hiện ra rằng việc xử lý bằng probiotic đã cải thiện khả năng tái sinh của giun Eudrilus eugeniae bị cắt đứt. Hơn nữa, Herawati và cộng sự (2016) báo cáo rằng probiotic lên men từ chất thải động vật đã tăng cường đáng kể cả sự tăng trưởng và sinh khối của Tubifex tubifex. Tuy nhiên, Oligochaeta không có mặt ở cả TI và CI trong nghiên cứu này có thể là do chúng cần thêm thời gian để xâm chiếm khu vực ao I, rất có thể là do phương thức phân tán của chúng. Thật vậy, Bingham và Miller (1989) đã báo cáo rằng sự phân tán Oligochaeta chỉ xảy ra thông qua việc trôi dạt hoặc bò; do đó, quá trình xâm chiếm của chúng tiến triển chậm.
Nhìn chung, khu vực trú ẩn nhỏ hơn có thể là một lý do dẫn đến các loài giáp xác trưởng thành không xuất hiện ở CI và TI, đặc biệt do tính chất di động cao của những sinh vật này (Sun và cộng sự, 2010).
Độ phong phú của hệ vi sinh vật thay đổi theo mùa và tổng khối lượng sinh học có thể được giải thích như sau. Sự giống nhau giữa lượng CO và TO dồi dào trong mùa thu đông cho thấy rằng chế phẩm sinh học không tăng cường hệ sinh vật meiofauna trong giai đoạn này do sự thay đổi trong vòng lặp vi sinh vật theo thời gian và không gian, điều này đã được Bouvy và cộng sự (1994) và (Kim và cộng sự, 2000) báo cáo trước đây; điều này đã được xác nhận bởi Hart và cộng sự (2000), đã báo cáo tốc độ phát triển và năng suất vi khuẩn cao trong mùa xuân hè so với mùa thu đông. Kết quả của chúng tôi hỗ trợ kết quả của Nevejan và cộng sự (2016), đã báo cáo rằng tác dụng dinh dưỡng của men vi sinh có thể ảnh hưởng đến cả thức ăn sống và sinh vật nuôi trong nuôi trồng thủy sản.
Sự tương đồng về tổng sinh khối giữa các khu vực ao O và I trong khu vực C và T có thể được giải thích như sau. Đầu tiên, kích thước nhỏ của khu vực I so với khu vực O có thể đã ngăn cản khu vực I vượt qua tổng sinh khối của khu vực O (Sun và cộng sự, 2010). Thứ hai, thời gian thử nghiệm tương đối ngắn (ba tháng) có nghĩa là meiofauna ở khu vực ao I bị tước đi cơ hội tăng mức độ xâm chiếm của chúng cao hơn mức độ xâm chiếm của meiofauna ở khu vực ao O.
Sự phong phú hệ vi sinh vật cao hơn được phát hiện ở khu vực ao I có thể là do chúng tránh bị cá săn mồi cũng như sự phát triển của vi sinh vật trong suốt mùa xuân hè. Schroeder và cộng sự (2012) cũng lập luận rằng sự thay đổi mật độ meiofauna quan sát được vào mùa hè là do lượng vi khuẩn tăng cao. Trong nghiên cứu này, các biến số môi trường giải thích tỷ lệ biến thiên thấp, điều này cho thấy rằng các yếu tố khác cũng ảnh hưởng đến sự biến đổi của sự phong phú của hệ sinh vật meiofauna. Hiệu ứng kiểm soát cá săn mồi và/hoặc gây xáo trộn từ trên xuống là một trong những yếu tố tiềm năng quan trọng (Abada và cộng sự, 2017).
Sihag và Sharma (2012) đã báo cáo rằng các yếu tố quyết định như nhiệt độ và chất lượng thức ăn không phải là yếu tố kiểm soát duy nhất hình thành nên quần thể vi sinh vật. Thật vậy, họ lập luận rằng các sinh vật vào đúng thời điểm và địa điểm sẽ xâm nhập vào môi trường sống để sinh sôi nảy nở, điều này tạo thành yếu tố ngẫu nhiên đi kèm với các yếu tố quyết định hình thành nên cộng đồng. Hơn nữa, Jahangiri và Esteban (2018) nhận thấy rằng nhiệt độ, thời gian tiêm men vi sinh, liều lượng và phương thức sử dụng cũng như độ tuổi của cá được xử lý là một số thông số chính ảnh hưởng đến hiệu quả của men vi sinh được sử dụng trong nước. Họ xác nhận rằng sự kết hợp này định hình hệ vi sinh vật hiện có và do đó làm tăng tính phức tạp của việc nghiên cứu tác dụng của chế phẩm sinh học. Hơn nữa, meiofauna được cho là ít bị ảnh hưởng theo mùa hơn so với chính trang trại nuôi cá (Abada và cộng sự, 2017; Grego và cộng sự, 2009).
Trong nghiên cứu này, khối lượng sinh khối trung bình của từng đơn vị phân loại khác nhau hỗ trợ cho những phát hiện của Nevejan và cộng sự (2016), đã chỉ ra rằng vi khuẩn có thể có những tác động khác biệt đối với toàn bộ cộng đồng. Họ coi vi khuẩn là nguồn dinh dưỡng không cần thiết cho giáp xác chân chèo do thiếu bộ máy lọc vi khuẩn hiệu quả và/hoặc thiếu hụt dinh dưỡng. Do đó, họ mong đợi không có phản ứng nào từ các loài giáp xác chân chèo so với các loài phân loại meiofauna khác vốn phụ thuộc vào vi khuẩn làm nguồn thức ăn chính, chẳng hạn như Rotifera. Probiotic cũng được biết là có ảnh hưởng đến các giai đoạn sống cụ thể và không nhất thiết là toàn bộ vòng đời của sinh vật (Rengpipat và cộng sự, 2008; Sihag & Sharma, 2012; Venkat và cộng sự, 2004). Hơn nữa, Ricci (1991) đã phát hiện những khác biệt về tăng trưởng giữa các chủng Rotifera được thu thập từ cùng một môi trường sống; sự tăng trưởng của chúng không đồng đều mặc dù chúng được cho ăn cùng loại tảo.
Tác dụng tích cực của probiotic đối với tổng sinh khối meiofauna trong nghiên cứu này cho thấy tổng sinh khối chủ yếu phụ thuộc vào sự phong phú của meiofauna hơn là vào sinh khối trung bình của từng đơn vị phân loại.
Giá trị chỉ số của Shannon giống nhau giữa các địa điểm C và T trong suốt thời gian nghiên cứu có thể phản ánh sự kiểm soát cá nuôi từ trên xuống ở cả hai địa điểm, có khả năng tương đương nhau (Abada và cộng sự, 2017).
Tuy nhiên, sự tương đồng được báo cáo giữa các chỉ số đa dạng của khu vực ao O và I tại địa điểm C có thể là do diện tích I nhỏ và thời gian thử nghiệm ngắn (tức là thời gian xâm chiếm không đủ) (Sun và cộng sự, 2010). Tuy nhiên, sự khác biệt được phát hiện về chỉ số đa dạng giữa hai khu vực ao trong khu vực T có thể là do việc áp dụng chế phẩm sinh học, đây có thể là một yếu tố thúc đẩy bổ sung cùng với những yếu tố ở khu vực đối chứng.
Men vi sinh có thể mang lại những tác động tích cực gáin tiếp cho cá thông qua khẳng định sự cải thiện điều kiện môi trường xung quanh (tức là sự phổ biến của những loài dễ bị tổn thương khi cho cá ăn như Rotifera, Cladocera, Nematode và Oli gochaeta). Theo nghiên cứu của Nevejan và cộng sự (2016), 20% – 70% khẩu phần ăn của động vật phù du có thể bao gồm vi khuẩn tự nhiên. Điều này cho thấy, men vi sinh đối với các sinh vật nuôi cấy, bao gồm cả meiofauna đóng vai trò là chất mang men vi sinh và chúng cho thấy tầm quan trọng tiềm tàng của meiofauna trong việc cung cấp men vi sinh đến các sinh vật nuôi cấy, đây là một lĩnh vực nghiên cứu đáng để nghiên cứu thêm.
5. Kết luận
Một nghiên cứu gần đây đã được thực hiện để đánh giá tác động của men vi sinh Sanolife PRO-W đối với sự phong phú, sinh khối và đa dạng của meiofauna trong ao đất. Nghiên cứu cho thấy, men vi sinh đã làm tăng đáng kể tất cả các chỉ số này, đặc biệt là vào mùa xuân và mùa hè. Sự gia tăng này được ghi nhận ở tất cả các đơn vị phân loại meiofauna, nhưng Cladocera, Rotifera, Nematoda và Oligochaeta là những loài chiếm ưu thế nhất. Các biến số môi trường, chẳng hạn như nhiệt độ, pH và oxy hòa tan, không có ảnh hưởng đáng kể đến sự phân bố của meiofauna. Sự gia tăng đồng thời của meiofauna và cá trong ao được xử lý bằng men vi sinh cung cấp thêm bằng chứng hỗ trợ cho những phát hiện trước đây về tác động tích cực của men vi sinh trong nuôi trồng thủy sản.
Theo Ahmed Elsayed Ahmed Abada, Ashgan Sabry Kamel ElWakeil, Radi Mohamed, Alyaa Elsaid Abdelaziz Fadl
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
Xem thêm:
- Protein Không Có Carbon: Nền Tảng Của Hệ Thống Thực Phẩm Bền Vững
- Các Liệu Pháp Dựa Trên RNAi chống Lại Bệnh Do Virus Ở Tôm Như Thế Nào?
- Đánh Giá Đặc Điểm Độc Lực Và Kháng Kháng Sinh Của Vibrio Phân Lập Từ Tôm Thẻ Chân Trắng (Penaeus vannamei) Trong Hệ Thống Nuôi Ở Miền Nam Trung Quốc

 English
English